SCI论文(www.lunwensci.com):
摘要:目的探讨抑郁模型大鼠高脂血症的发生情况,并探究TLR4/NF-κB信号通路在其中所起作用。方法将40只雄性SD大鼠随机分为四组(n=10):对照组、抑郁模型组、TLR4对照组、TLR4沉默组。
对照组不予处理,其余三组均采用慢性不可预知性温和应激法(CUMS)构建抑郁模型。抑郁建模前一天,TLR4沉默组尾静脉注射AAV-CMV-U6-shRNA(TLR4)病毒沉默大鼠体内TLR4表达,TLR4对照组注射等量空白病毒载体,对照组、抑郁模型组注射等量生理盐水。
4周后,采用糖水偏好试验检测大鼠行为学表现;血脂试剂盒检测大鼠血清TC、TG、HDL-C、LDL-C水平;Western blot技术检测海马组织、主动脉TLR4、NF-κB、IL-1β、TNF-α蛋白表达水平。
结果与对照组相比,抑郁模型组与TLR4对照组大鼠糖水偏好分数显著减小(P<0.001),HDL-C水平显著降低,LDL-C、TG、T-CHO水平显著升高(P<0.001),海马组织、主动脉TLR4、NF-κB、IL-1β及TNF-α蛋白表达量明显升高(P<0.05);TLR4沉默组糖水偏好分数无显著差异(P>0.05),LDL-C升高(P<0.001),HDL-C、TG、T-CHO差异无显著性(P>0.05),TLR4、NF-κB、IL-1β及TNF-α蛋白表达量较对照组升高,但差异无显著性(P>0.05)。
结论抑郁可以导致大鼠高脂血症的产生,且其机制可能与激活TLR4/NF-κB信号通路相关。
关键词:TLR4;NF-κB;抑郁;高脂血症
本文引用格式:王宁,王静,李金浩,等.TLR4/NF-κB信号通路在抑郁模型大鼠高脂血症产生中的作用研究[J].世界最新医学信息文摘,2019,19(52):198-200.
The Role of TLR4/NF-κB Signaling Pathway in the Production of Hyperlipidemia in Depression Model Rats
WANG Ning1,WANG Jing2,LI Jin-hao1,GAO Jing1,XIAO Jian1,YUAN Jie1(1.North China University of Science and Technology,Tangshan Hebei;2.Tangshan Vocational and Technical College,Tangshan Hebei)
ABSTRACT:Objective To explore the process and characteristics of depression-induced hyperlipidemia and explore the role of the TLR4/NF-κB signaling pathway.
Methods Forty adult male SD rats were randomLy divided into four groups(n=10):controlgroup,depression model group,TLR4 silence group and TLR4 control group.
The control group was not treated,and the other three groups were constructed with a chronic unpredictable mild stress method(CUMS)to construct a depression model.
One day before the modeling of depression,the TLR4 silence group and the TLR4 control group were injected with the same amount of AAV-CMV-U6-shRNA(TLR4)virus and blank virus in the tail vein.The control group and the depression model group were injected with the same amount of normal saline.After 4 weeks,the performance of the rats was tested by sucrose preference test.
The serum lipid kit was used to detect the levels of serum TC,TG,HDL-C and LDL-C in rats.Western blot was used to detect the expression of TLR4,NF-κB,IL-1βand TNF-αprotein in hippocampus and aorta.Results Compared with the control group,the sucrose preference scores of the depression model group and the TLR4 control group were significantly decreased(P<0.001).
HDL-C was significantly decreased,and LDL-C,TG,T-CHO were significantly increased(P<0.001).The expression of TLR4,NF-κB,IL-1βand TNF-αprotein in hippocampus and aorta were significantly increased(P<0.05).In TLR4 silenced group,there was no significant difference in sucrose preference score,HDL-C,TG and T-CHO(P>0.05).The expression of TLR4,NF-κB,IL-1βand TNF-αprotein was higher than that of the control group,but the difference was not significant(P>0.05).
Conclusions Depression can lead to the development of hyperlipidemia in rats,and its mechanism may be related to the activation of TLR4/NF-κB signaling pathway.
KEY WORDS:TLR4;NF-κB;Depression;Hyperlipidemia
0引言
抑郁症是以显著而持久的心境低落、思维迟缓、认知功能损害、意志活动减退和躯体症状为主要临床特征的一类心境障碍,其患病率逐年升高,预计到2020年将成为全球第二位医疗疾患[1]。
高脂血症可引起冠心病、动脉粥样硬化等多种疾病[2],随着人们生活方式的改变、人口老龄化的加剧,高脂血症现已严重危害人类健康。已有研究表明,抑郁症与高脂血症之间存在相关性[3-6],但相关机制尚不明确。本研究拟探讨抑郁模型大鼠高脂血症的产生情况,并探究TLR4/NF-κB信号通路在其中所起作用。
1材料与方法
1.1实验动物及材料
健康雄性SD大鼠,40只,体重180~200 g,由华北理工大学实验动物中心提供,许可证号:SCXK(京)2016-0002。实验前大鼠在室温25℃,相对湿度为45%的环境中适应性饲养1周。AAV-CMV-U6-shRNA(TLR4)病毒、空白病毒载体购于和元生物技术(上海)股份有限公司。
TLR4、NF-κB及TNF-α抗体购于美国Proteintech Group公司。IL-1β、β-actin抗体购于英国Abcam公司。T-CHO、TG、HDL-C、LDL-C试剂盒购于南京建成生物工程研究所。
1.2方法
1.2.1动物分组与模型制备
适应性饲养1周后,筛选血脂水平与糖水偏好试验结果相近的40只大鼠随机分为4组(n=10):对照组、抑郁模型组、TLR4沉默组、TLR4对照组。对照组不予处理,其余三组均采用慢性不可预知性温和应激法(CUMS)构建抑郁模型。
CUMS共采用11种应激方式,包括:鼠笼垫料浸湿24 h,45°倾斜鼠笼24 h,连续光照36 h,禁食24 h,禁水24 h,4℃冰水强迫游泳5 min,42℃热水强迫游泳5 min,夹尾1 min,鼠笼摇晃15 min,行为限制24 h,天敌声音
30 min。
每天随机选择一种应激方式,应激时间随机,且连续2天不采用同一种方式,连续应激4 w。抑郁建模前一天,TLR4沉默组、TLR4对照组分别尾静脉注射等量AAV-CMV-U6-shRNA(TLR4)病毒[7]、空白病毒。对照组和抑郁模型组尾静脉注射等量生理盐水。
1.2.2糖水偏好试验(sucrose preference test,SPT)
在饲养的1周内,对大鼠进行糖水适应训练。抑郁建模4周后,对各组大鼠进行FST。实验前对大鼠禁水禁食24 h,测试时间选取大鼠活动正常的夜间,且保持实验过程光线昏暗,测试时大鼠单只单笼摆放,给予饲料和提前称重、标记的两个外形相同的饮水瓶,饮水瓶中分别装有1%的蔗糖水和清水,使大鼠自由选择摄取。
1 h后,对两个饮水瓶进行称重记录。依据公式计算糖水偏好分数。糖水偏好分数=糖水摄入量/(糖水摄入量+清水摄入量)×100%
1.2.3血清T-CHO、TG、HDL-C、LDL-C水平检测大鼠抑郁建模4周后,对各组大鼠进行血脂水平检测。按试剂盒说明书方法,采用酶标仪分别检测各组大鼠血清T-CHO、TG、HDL-C、LDL-C水平。
1.2.4大鼠海马组织、主动脉TLR4、NF-κB、IL-1β、TNF-α蛋白表达水平检测实验结束后,大鼠10%水合氯醛麻醉后处死,冰上迅速取海马组织及主动脉,加入RIPA裂解液,提取总蛋白,BCA定量后按照30g蛋白量上样,进行12%SDS-PAGE电泳,PVDF膜电转印,脱脂奶粉封闭,TLR4、NF-κB、IL-1β、TNF-α一抗4℃孵育过夜,二抗IgG室温孵育1h,增强化学发光法(ECL)显色。内参照β-actin的Western blot分析方法同上。Image J分析图像,以目的条带与内参照的灰度比值表示蛋白表达水平。
1.3统计学方法
采用SPSS 13.0统计分析软件对数据进行统计学分析。计量资料以均数±标准差(±s)表示。组间比较采用单因素方差分析和最小显著差法(LSD)检验。P<0.05为差异具有统计学意义。
2结果
2.1SPT结果
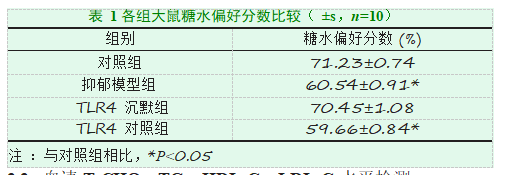
与对照组[(71.23±0.74)%]相比,抑郁模型组[(60.54±0.91)%]与TLR4对照组[(59.66±0.84)%]大鼠糖水偏好分数明显降低,差异具有显著性(P<0.001);TLR4沉默组[(70.45±1.08)%]大鼠糖水偏好分数差异无显著统计学意义(P>0.05),结果见表1。
与TLR4对照组[(59.66±0.84)%]大鼠糖水偏好分数明显降低,差异具有显著性(P<0.001);TLR4沉默组[(70.45±1.08)%]大鼠糖水偏好分数差异无显著统计学意义(P>0.05),结果见表1。
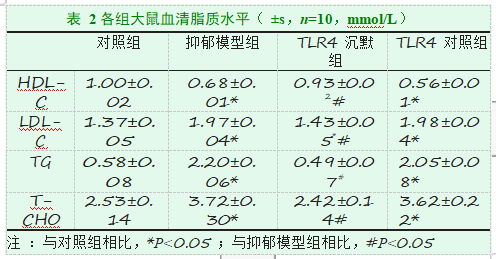
2.2血清 T-CHO、TG、HDL-C、LDL-C 水平检测如表 2 所示,与对照组相比,抑郁模型组与 TLR4 对照组大鼠 HDL-C 明显降低,LDL-C、TG、T-CHO 明显升高,差异具有显著性(P<0.001);TLR4 沉默组大鼠 LDL-C 升高,差异具有显著性(P<0.001),HDL-C、TG、T-CHO 差异无显著统计学意义(P>0.05)。与抑郁模型组相比,TLR4 沉默组 HDL-C、LDL-C、 TG、T-CHO 均有显著性差异(P<0.001)。
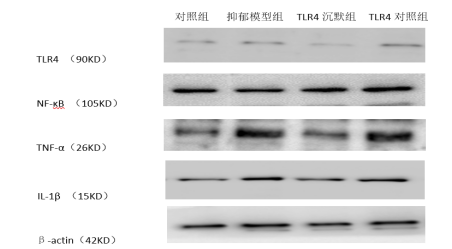
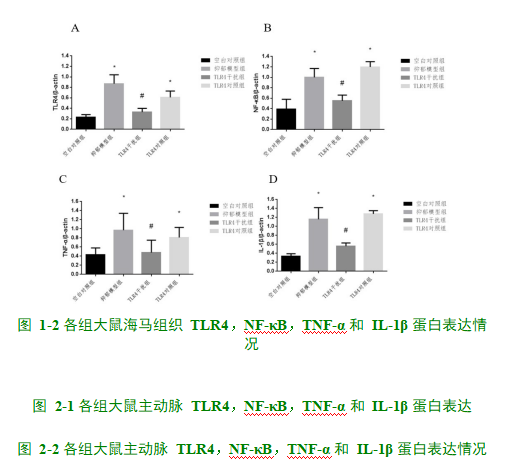
2.3大鼠海马组 织、主动脉 TLR4、NF-κB、IL-1β、TNF-α 蛋白表达水平如图1、2所示,与对照组相比,抑郁模型组与TLR4对照组大鼠海马组织、主动脉TLR4、NF-κB、IL-1β、TNF-α蛋白表达水平明显升高,差异具有显著性(P<0.05);TLR4沉默组大鼠蛋白表达水平略升高,但差异无显著性(P>0.05)。与抑郁模型组相比,TLR4沉默组TLR4、NF-κB、IL-1β、TNF-α蛋白表达水平均显著降低(P<0.05)。
3讨论
抑郁症的患病率逐年提高,现已成为当前研究的热点问题。本研究通过模仿人类长期、慢性、低强度的日常压力,采用 CUMS 法构建大鼠抑郁模型。通过对大鼠行为学水平的检测,评估大鼠抑郁样行为表现。抑郁模型组、TLR4 对照组大鼠糖水偏好时间显著延长,出现抑郁样行为。
TLR4 沉默组大鼠糖水偏好分数与脑组织中 TLR4、NF-κB 呈高表达,同时脑组织炎症反应加剧,且与小鼠抑郁样症状程度有关。Tang[14] 构建动脉粥样硬化(AS)小鼠模型,发现沉默TLR4表达后,能有效抑制NF-κB及多种炎症因子表达,并显著抑制AS的形成。本研究通过对大鼠海马组织、主动脉TLR4、NF-κB、IL-1β、TNF-α蛋白表达水平的检测,判断TLR4/NF-κB信号通路激活情况。
结果表明,与对照组相比,抑郁模型组与TLR4对照组大鼠TLR4、NF-κB、IL-1β、TNF-α蛋白表达水平明显升高。TLR4沉默组大鼠蛋白表达水平略升高,但差异无显著性。与抑郁模型组相比,TLR4沉默组TLR4、NF-κB、IL-1β、TNF-α蛋白表达水平均显著降低。这项研究提示在大鼠抑郁诱导高脂血症产生的过程中,TLR4/NF-κB信号通路的激活及下游炎症因子的释放可能起着重要作用。
综上所述,抑郁可以导致大鼠高脂血症的产生,且其机制可能与激活TLR4/NF-κB信号通路,促进下游炎症因子的释放相关。这为临床抑郁症与高脂血症的共病治疗提供了新思路和新策略。
参考文献
[1]Dennis C L,Dowswell T.Interventions(other than pharmacological,psychosocial or psychological)for treating antenatal depression[J].Cochrane Database Syst Rev,2013(7):D6795.
[2]Karr S.Epidemiology and management of hyperlipidemia[J].Am J Manag Care,2017,23(9 Suppl):S139-S148.
[3]Chuang C S,Yang T Y,Muo C H,et al.Hyperlipidemia,statin use and the risk of developing depression:a nationwide retrospective cohort study[J].Gen Hosp Psychiatry,2014,36(5):497-501.
[4]Wee H Y,Ho C H,Liang F W,et al.Increased risk of new-onset depression in patients with traumatic brain injury and hyperlipidemia:the important role of statin medications[J].J Clin Psychiatry,2016,77(4):505-511.
[5]
Bica T,Castello R,Toussaint L L,et al.Depression as a Risk Factor of Organic Diseases:An International Integrative Review[J].J Nurs Scholarsh,2017,49(4):389-399.
[6]Armstrong N M,Meoni L A,Carlson M C,et al.Cardiovascular risk factors and risk of incident depression throughout adulthood among men:The Johns Hopkins Precursors Study[J].J Affect Disord,2017,214:60-66.
[7]Deverman B E,Pravdo P L,Simpson B P,et al.Cre-dependent selection yields AAV variants for widespread gene transfer to the adult brain[J].Nat Biotechnol,2016,34(2):204-209.
[8]Brown E S,Varghese F P,Mcewen B S.Association of depression with medical illness:does cortisol play a role?[J].Biol Psychiatry,2004,55(1):1-9.
[9]王海坤,韩代书.Toll样受体(TLRs)的信号转导与免疫调节[J].生物化学与生物物理进展,2006(09):820-827.
[10]常晓彤,辇晓峰,王振辉.Toll样受体信号转导途径研究进展[J].生理科学进展,2011,42(05):340-346.
[11]Zhu Y J,Wang C,Song G,et al.Toll-like receptor-2 and-4 are associated with hyperlipidemia[J].Mol Med Rep,2015,12(6):8241-8246.
[12]Wang L,Chen J.Progress in studies on TLR4 signaling pathway and major depressive disorder[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2017,42(6):725-729.
[13]Cheng Y,Pardo M,Armini R D S,et al.Stress-induced neuroinflammation is mediated by GSK3-dependent TLR4 signaling that promotes susceptibility to depression-like behavior[J].Brain,Behavior,and Immunity,2016,53:207-222.
[14]Tang Y L,Jiang J H,Wang S,et al.TLR4/NF-kappaB signaling contributes to chronic unpredictable mild stress-induced atherosclerosis in ApoE-/-mice[J].PLoS One,2015,10(4):e123685.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/11461.html