SCI论文(www.lunwensci.com):
摘要:目的探析延续性护理干预对胃癌根治术后患者改善治疗依从性、希望水平及生活质量的影响。方法选择我院2014年1月至2018年12月经胃癌手术的80例患者为研究对象,随机分为延续性护理干预的观察组与仅提供常规护理干预对照组每组各40例,通过自制调查问卷及量表等形式对比两组患者的遵医依从性、希望水平及生活质量。结果实行延续性护理的观察组患者总体遵医依从率97.50%高于对照组的80.00%,希望水平总体良好率95.00%高于对照组的77.50%,在精神状态、家庭/社会关系、癌症知识掌握及日常健康行为每项评分观察组也均高于对照组,差异均具有统计学意义(P<0.05);而两组患者在延续性护理干预前,在以上四个方面评分并没有显著统计学差异(P>0.05)。结论延续性护理干预对胃癌根治术后患者改善治疗依从性、希望水平及生活质量产生了显著的积极影响。
关键词:延续性护理干预;胃癌根治术后;治疗依从性;希望水平;生活质量
本文引用格式:沈永英,许文娟.延续性护理干预对胃癌根治术后患者改善治疗依从性、希望水平及生活质量的影响观察[J].世界最新医学信息文摘,2019,19(59):31-32.
Effect of Continuous Nursing Intervention on Improvement of Treatment Compliance,Hope Level and Quality of Life in Patients after Radical Gastrectomy
SHEN Yong-ying,XU Wen-juan*
(Department of Gastrointestinal Surgery,Ninth People's Hospital,Suzhou Jiangsu)
ABSTRACT:Objective To investigate the effects of continuous nursing intervention on the improvement of treatment compliance,hope level and quality of life in patients undergoing radical gastrectomy.Methods Eighty patients who underwent gastric cancer surgery from January 2014 to December 2018 in our hospital were selected as subjects.They were rando mLy divided into observation group for continuous nursing intervention and 40 patients in each group with regular nursing intervention.The questionnaires and scales were used to compare the compliance,hope level and quality of life of the two groups of patients.Results The overall compliance rate of patients in the observation group who underwent continuous care was 97.50%higher than that of the control group,and the overall good rate of hope was 95.00%higher than 77.50%of the control group.In mental state,family/social relationship,cancer The knowledge acquisition and daily health behaviors were also higher in the observation group than in the control group,and the differences were statistically significant(P<0.05).However,the scores of the two groups were not significant in the above four aspects before the continuous nursing intervention.Statistical difference(P>0.05).Conclusion Continuous nursing intervention has a significant positive effect on the improvement of treatment compliance,hope level and quality of life in patients undergoing radical gastrectomy.
KEY WORDS:Continuous nursing intervention;Radical operation after gastric cancer;Treatment compliance;Hope level;Quality of life
0引言
在全世界范围内,胃癌是第五大最常见的癌症,2012年诊断出95.2万例[1],在男性中以及在发展中国家更为常见[2]。据2012年的统计,胃癌占男性癌症病例的8.5%,成为男性中第四大常见癌症。同样在2012年,死亡人数为70万,比1990年的77.4万人略有下降,使其成为仅次于肺癌和肝癌之后癌症相关死亡的第三大原因[3]。不到5%的胃癌发生在40岁以下的人群中,其中81.1%发生在30~39岁的人群中,18.9%发生在20~29岁的人群中[4]。在临床上手术仍是胃癌的主要治疗方法[5],但在胃癌手术后有高达70%接受全胃切除术的人会出现倾倒综合征和反流性食管炎等并发症[6]。当今医疗观念一直在改变,临床护理干预措施更加重视患者术后的生活质量,而不仅仅是以延长患者寿命为目的[7]。采取延续性的护理干预措施,可以将护理工作延伸到患者出院后的家庭生活中,持续检测患者的身体状况以及为患者不间断地提供医疗护理服务,以便能更好的改善患者的生活质量[8]。本实验选择我院2014年1月至2018年12月经胃癌手术的80例患者为研究对象,对其中40名观察组实施延续性护理干预,取得了良好的效果,现报道如下。
1资料与方法
1.1一般资料
选择我院2014年1月至2018年12月经胃癌手术的80例患者为研究对象,随机分为观察组与对照组,每组各40例。纳入标准:①经CT及活检确诊胃癌;②研究对象均自愿签署知情同意书,中途不退出;③胃癌术前无化疗史;④精神状态正常,意识清楚,书写及语言表达正常;⑤选取年龄30岁~80岁之间;⑥预期生存期大于1年;⑦胃癌无远处转移。排除标准:①患有其它恶性肿瘤;②患有严重心肝肾疾病;③拒绝参与研究及中途退出者;④有精神意识障碍;⑤预期生存期小于1年。观察组男23例,女17例;年龄33~73岁,平均为(52.4±7.1)岁;受教育水平:小学5例,初中9例,高中及以上26例。对照组男19例,女21例;年龄36~74岁,平均年龄(54.8±6.9)岁;受教育水平:小学3例,初中14例,高中及以上23例。两组患者基线资料对比差异无统计学意义(P>0.05),可进行比较。
1.2方法
对照组患者进行常规护理:①监测患者生命体征,肠内营养等基础护理;②对患者进行胃癌疾病、合理饮食、药物使用等知识的健康教育;③对患者进行心理护理,改善不良情绪;④患者出院后进行常规定期随访。观察组以常规护理为基础,增加延续性护理干预措施:①成立延续性护理小组,制定专门的护理方案;②根据患者不同的受教育水平进行针对性个性化健康教育;③建立微信群,群里专门安排医师及护士解答患者疑问,指导患者饮食用药,追踪患者健康状况及心理变化。
1.3观察指标
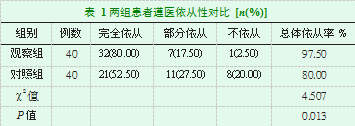
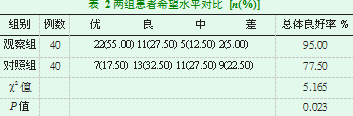
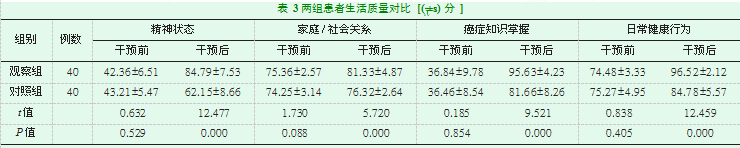
两组患者遵医依从性对比,总体依从率=(完全依从+部分依从)/总例数×100。两组患者希望水平对比,采用自制调查问卷统计从社交、对未来展望、日常积极行为等几个方面患者对自身状况的希望水平,分成优、良、中、差四个希望水平部分进行评估,总体希望水平良好率=(优+良+中)/总例数×100。两组患者生活质量对比,采用自制生活质量量表对患者进行评估,分为精神状态、家庭/社会关系、癌症知识掌握及日常健康行为四个方面,每项满分100分。
1.4统计学方法
采用IBM SPSS 21.0版本软件对问卷和量表进行分析,t检验用于计量资料,以(±s)表示;2检验用于计数资料,以n(%)表示,以P<0.05为统计学有意义。
2结果
2.1两组患者遵医依从性对比
延续性护理干预后,观察组总体遵医依从率97.50%高于对照组的80.00%,两组比较差异有统计学意义(P<0.05),见表1。
2.2两组患者希望水平对比
延续性护理干预后,观察组希望水平总体良好率95.00%高于对照组的77.50%,两组比较差异有统计学意义(P<0.05),见表2。
2.3两组患者生活质量对比
两组患者在延续性护理干预前,在精神状态、家庭/社会关系、癌症知识掌握及日常健康行为四个方面没有显著统计学差异(P>0.05),在干预后每项评分观察组均高于对照组,差异均具有统计学意义(P<0.05),见表3。
3讨论
胃癌是一种从胃内壁发展而来的癌症[9],早期症状可能包括胃灼热、上腹部疼痛、恶心和食欲不振[10]。晚期症状和体征可能包括体重减轻、皮肤和眼白发黄、呕吐、吞咽困难和便血等[10],癌症可能会从胃扩散到身体的其他部位,特别是肝、肺、骨骼、腹部和淋巴结[11]。胃癌最常见的病因是幽门螺杆菌感染,占病例总数的60%以上[12]。某些类型的幽门螺杆菌比其他类型的幽门螺杆菌具有更大的风险,吸烟、饮食因素如腌制蔬菜以及肥胖是其他风险因素。约10%病例是基于家庭因素,由于遗传因素继承的胃癌[13]。胃癌类型可以分为许多子类型,淋巴瘤和间充质肿瘤也可能在胃中发展。诊断通常是在内窥镜检查期间进行活组织检查。还有就是医学影像学检查,以确定癌症是否已扩散到身体的其他部位[1]。吸烟会显着增加患胃癌的风险,从轻度吸烟者胃癌的风险增加40%到重度吸烟者增加82%,由吸烟引起的胃癌主要发生在靠近食道的胃上部[14]。一些研究表明,饮酒也会增加胃癌的风险[15]。有些食物包括熏制食品、盐和富含盐的食物、红肉、加工过的肉、腌制蔬菜和蕨菜都与胃癌的高风险有关[16]。腌制肉类中的硝酸盐和亚硝酸盐可被某些细菌包括幽门螺旋杆菌,转化为已被发现导致动物胃癌的化合物。新鲜水果和蔬菜摄入量、柑橘类水果摄入量和抗氧化剂摄入量与降低患胃癌的风险相关。肥胖是一种身体风险因素,已被发现通过促进胃食管反流病的发展而增加胃腺癌的风险,肥胖引起胃食管反流病的确切机制尚不完全清楚,研究假设由于脂肪组织过多,增加的饮食脂肪导致胃和下食道括约肌的压力增加可能起作用,但尚未收集到统计学上显着的数据[17]。然而,已发现存在胃食管反流病的胃贲门腺癌的风险对于肥胖者而言增加超过2倍,此外碘缺乏与胃癌之间也存在相关性。
本研究结果显示,实行延续性护理的观察组患者总体遵医依从率97.50%高于对照组的80.00%,且希望水平总体良好率95.00%高于对照组的77.50%,比较差异均有统计学意义(P<0.05)。两组患者在延续性护理干预前,在精神状态、家庭/社会关系、癌症知识掌握及日常健康行为四个方面没有显著统计学差异(P>0.05),在干预后每项评分观察组均高于对照组,差异均具有统计学意义(P<0.05)。
综上所述,延续性护理干预应用在胃癌根治术后患者,更加能争取患者配合,从而提高患者治疗依从性。因为提供更好的心理护理,从而给与患者积极的生存希望。此外由于微信群持续性提供对患者的出院后健康指导,明显改善了患者生活质量。
参考文献
[1]McGuire S.World Cancer Report 2014.Geneva,Switzerland:World Health Organization,International Agency for Research on Cancer,WHO Press,2015[J].Adv Nutr,2016,7(2):418-9.
[2]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[3]Lozano R,Naghavi M,Foreman K,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2095-128.
[4]Liu S,Feng F,Xu G,et al.Clinicopathological features and prognosis of gastric cancer in young patients[J].BMC Cancer,2016,16:478.
[5]Orditura M,Galizia G,Sforza V,et al.Treatment of gastric cancer[J].World J Gastroenterol,2014,20(7):1635-49.
[6]Syn NL,Wee I,Shabbir A,et al.Pouch Versus No Pouch Following Total gastrectomy:Meta-analysis of Randomized and Non-randomized Studies[J].Ann Surg,2018.
[7]刘洪敏,赵岳,詹宏杰,等.胃癌病人全胃切除术后延续性健康教育对近期生活质量及生理指标的影响[J].护理研究,2013,27(13):1262-1264.
[8]梁永红.个体化延续性护理对晚期胃癌合并腹腔积液患者的影响[J].内科,2016,11(01):144-146.
[9]Kinami S,Funaki H,Fujita H,et al.Local resection of the stomach for gastric cancer[J].Surg Today,2017,47(6):651-659.
[10]Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2014(ver.4)[J].Gastric Cancer,2017,20(1):1-19.
[11]Cree IA.Cancer biology[J].Methods Mol Biol,2011,731:1-11.
[12]Chang AH,Parsonnet J.Role of bacteria in oncogenesis[J].Clin Microbiol Rev,2010,23(4):837-57.
[13]González CA,Sala N,Rokkas T.Gastric cancer:epidemiologic aspects[J].Helicobacter,2013,18(Suppl 1):34-8.
[14]Praud D,Rota M,Pelucchi C,et al.Cigarette smoking and gastric cancer in the Stomach Cancer Pooling(StoP)Project[J].Eur J Cancer Prev,2018,27(2):124-133.
[15]Thrumurthy SG,Chaudry MA,Hochhauser D,et al.The diagnosis and management of gastric cancer[J].BMJ,2013,347:f6367.
[16]Jakszyn P,Gonzalez CA.Nitrosamine and related food intake and gastric and oesophageal cancer risk:a systematic review of the epidemiological evidence[J].World J Gastroenterol,2006,12(27):4296-303.
[17]Crew KD,Neugut AI.Epidemiology of gastric cancer[J].World J Gastroenterol,2006,12(3):354-62.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/17460.html