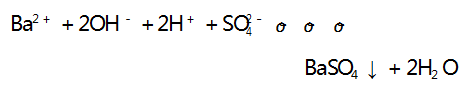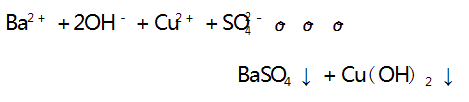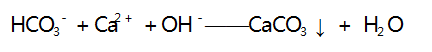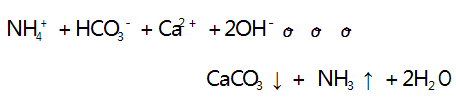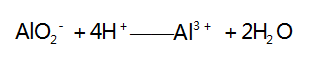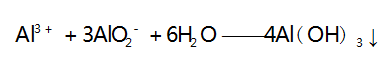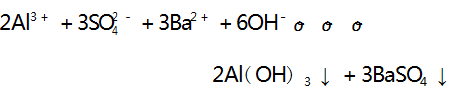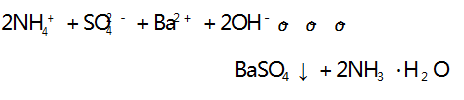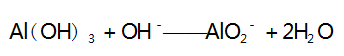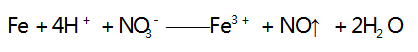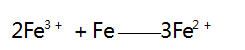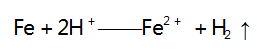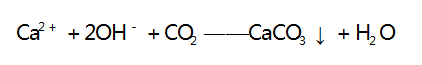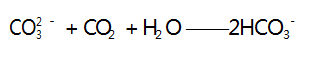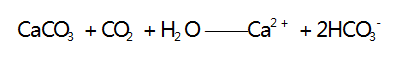SCI论文(www.lunwensci.com):
摘 要 : 以典型的离子反应(一步反应型、分步反应型) 为例,说明了其解题思路与解题方法, 其解题关键是要把握反应原理,抓住图像特点进行分析判断.旨在培养学生对图像的观察能力及分析问题与解决问题的能力,提高求解离子反应图像题的能力.
关键词 : 反应原理; 离子反应; 图像题;高中化学
有关离子反应图像题,在考查反应原理的同 时,能充分考查考生对图像的观察判断能力及分 析问题与解决问题的能力,因而倍受命题专家的 青睐.现举例说明其解题思路与解题方法,以期抛砖引玉.
1 一步反应型
对于一步反应型的离子反应图像题,其解题关 键有三点 : 一是要把握反应原理 ; 二是要弄清图像的 物理意义( 尤其要弄清图像的起点、最低点、最高 点、变化趋势、平台等的物理意义) ; 三是要融合反应原理与图像于一体,进行分析判断.
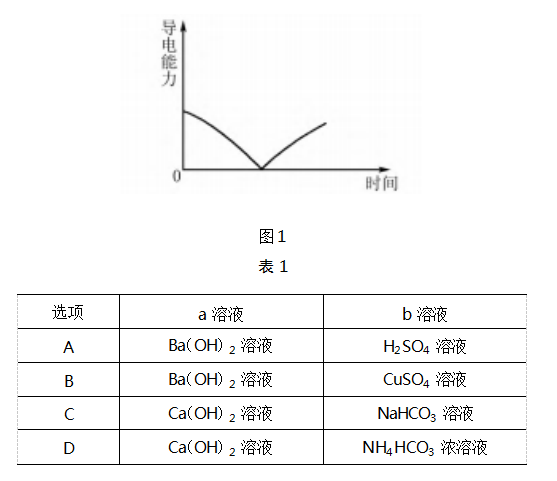
例题 1 向 0.01 mol·L -1 的 a 溶液 中匀速 滴入 0.02 mol·L -1 的 b 溶液,不符合图 1 所示图 像的是( 忽 略 弱 电解质和难溶电解质的电离)( ) .
解析 A 选项,向 Ba( OH) 2 溶液中滴加 H2 SO4溶液,反应的离子方程式为 :
溶液中离子浓度逐渐减小,溶液的导电能力逐渐减弱, 当 Ba(OH) 2 恰好完全反应时,溶液中的离子浓度为 0, 溶液的导电能力为 0,之后再滴加 H2 SO4 溶液,溶液中 的离子浓度又逐渐增大,溶液的导电能力又逐渐增强, 与图像符合,A 选项不符合题意.B 选项,向 Ba(OH) 2溶液中滴加 CuSO4 溶液,反应的离子方程式为:
溶液中离子浓度逐渐减小,溶液的导电能力逐渐减 弱,当 Ba( OH) 2 恰好完全反应时,溶液中的离子浓 度为 0,溶液的导电能力为 0,之后再滴加 CuSO4 溶 液,溶液中的离子浓度又逐渐增大,溶液的导电能力 又逐渐增强,与图像符合,B 选项不符合题意.C 选 项,向Ca( OH) 2 溶液中滴加 NaHCO3 溶液,NaHCO3
少量,反应的离子方程式为 :
溶液中离子浓度逐渐减小,溶液的导电能力逐渐减 弱,当 Ca( OH) 2 恰好完全反应时,溶液中含有 Na + 和 OH -,溶液的导电能力不可能为 0,与图像不符, C 选项符合题意.D 选项,向 Ca( OH) 2 溶液中滴加NH4 HCO3 浓溶液,反应的离子方程式为 :
溶液中离子浓度逐渐减小,溶液的导电能力逐渐减 弱,当 Ca( OH) 2 恰好完全反应时,溶液中的离子浓 度为 0,溶液的导电能力为 0,之后再滴加 NH4 HCO3 浓溶液,溶液中的离子浓度又逐渐增大,溶液的导电 能力又逐渐增强,与图像符合,D 选项不符合题意.
因此,此题的答案为 C 选项.
2 分步反应型
对于分步反应型的离子反应图像题,其解题关键有三点 : 一是要把握反应原理,根据“强者先行”的规律弄清反应的先后顺序 ; 二是要明确图像的物 理意义( 尤其要弄清图像的起点、拐点、最高点、变 化趋势、平台等的物理意义) ; 三是要根据各步反应原理,对图像进行分析判断.
例题 2 图 2 所列图像表示错误的是( ) .
A.向盐酸中滴加 NaAlO2 溶液
B.向 NH4 Al(SO4 ) 2 溶液中滴加 Ba( OH) 2 溶液
C.向 H2 SO4 和 HNO3 物质的量之比为 2 ∶ 1 的混合稀酸溶液中逐渐加入 Fe 粉
D.向 NaOH 和 Ca( OH) 2 物质的量之比为 2∶ 1的混合溶液中通入 CO2
解析 A 选项,向盐酸中滴加 NaAlO2 溶液,开 始时盐酸过量,第一步反应( AlO2- 与过量的 H + 反应生成 Al3 + ) 的离子方程式为 :
此时无沉淀产生,假设 H + 完全反应时消耗 AlO2- 的 物质的量为 1 mol,则生成 1 mol Al3 + ; 之后再滴加 NaAlO2 溶液,则第二步反应[Al3 + 与 AlO2- 发生双水解反应生成 Al( OH) 3 沉淀]的离子方程式为 :
此时开始产生沉淀,当 Al3 + 恰好全部反应时沉淀量 达到最大值,此时又消耗 3 mol AlO2-,则 H + 完全反应(无沉淀产生) 时消耗 AlO2- 的物质的量与沉淀量达到最大值时消耗 AlO2- 的物质的量之比为 1∶ 3,A 选项正 确.B 选项,向 NH4 Al (SO4 ) 2 溶液中滴加Ba(OH) 2 溶液,假设 NH4 Al(SO4 ) 2 的物质的量为2 mol,第一步反应[Al3 + 和 SO - 分 别 与 OH - 和 Ba2 + 反 应 生 成Al(OH) 3 沉淀和 BaSO4 沉淀]的离子方程式为:
第一步反应消耗 3 mol Ba( OH) 2 使 Al3 + 全部生成 沉淀,剩余 1 mol SO - 和 2 mol NH4+ ; 之后再滴加Ba( OH) 2 溶液,发生第二步反应,其离子方程式为 :
第二步反应使 SO - 全部沉淀,沉淀量达到最大值,又消耗 1 mol Ba( OH) 2 ; 之后再滴加 1 mol Ba( OH) 2 时 OH -过量使 2 mol Al( OH) 3 沉淀完全溶解,发生第三步反应,其离子方程式为 :
此时沉淀的质量减少一部分( BaSO4 沉淀不溶解) ; 这三步 反 应 消 耗 Ba ( OH ) 2 的物质的量之比为 3∶ 1∶ 1,B 选项正确.C 选项,在 H2 SO4 和 HNO3 物质的 量之比为2∶ 1 的混合稀酸溶液中,设 H2 SO4 的物质的 量为2 mol,HNO3 的物质的量为 1 mol,则混合溶液中, H + 的物质的量为 5 mol,NO3- 的物质的量为 1 mol ; 向
其中逐渐加入 Fe 粉,第一步反应的离子方程式为:
当 1 mol NO3- 全部反应时,消耗 1 mol Fe 和 4 mol H + ,而生成 1 mol Fe3 + 和 1 mol NO,剩余 1 mol H + ; 之后再逐渐加入 Fe 粉,发生第二步反应,其离子方程式为 :
此时无气体产生,当 1 mol Fe3 + 全部转化为 Fe2 + 时,又消耗 0.5 mol Fe ; 之后再逐渐加入 Fe 粉,发生第三步反应,其离子方程式为 :
当1 mol H + 完全反应时又消耗0.5 mol Fe ; 这三步反应 消耗 Fe 的物质的量之比为 1∶ 0.5∶ 0.5 = 2∶ 1∶ 1,C 选项 正确.D 选项,NaOH 和 Ca(OH) 2 物质的量之比为2∶ 1 的混合溶液 中,假 设 NaOH 的物质 的量为 2 mol, Ca( OH) 2 的物质的量为 1 mol,则混合溶液中,Ca2 + 的物质的量为 1 mol,OH - 的物质的量为 4 mol ; 向其
中通入 CO2 ,第一步反应的离子方程式为 :
此时产生沉淀,当 1 mol Ca2 + 完全沉淀时沉淀量达 到最大值( 生成 1 mol CaCO3 沉淀) ,消耗 1 mol CO2 和 2 mol OH -,还剩余 2 mol OH - ; 之后再通入 CO2 ,发生第二步反应,其离子方程式为 :
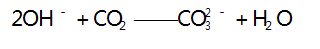
此时无明显现象产生,当 2 mol OH - 完全反应时又 消耗 1 mol CO2 ,而生成 1 mol CO - ; 之后再通入CO2 ,发生第三步反应,其离子方程式为 :
-
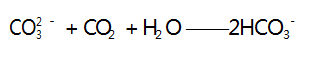
此时无明显现象产生,当 1 mol CO - 完全反应时又消耗 1 mol CO2 ; 之后再通入 CO2 ,发生第四步反应,其离子方程式为 :
此时沉淀逐渐溶解,当 1 mol CaCO3 沉淀完全溶解 时又消耗 1 mol CO2 ; 则 Ca2 + 完全沉淀消耗 CO2 的 物质的量∶ 无明显现象消耗 CO2 的物质的量∶ CaCO3 沉淀完全溶解消耗 CO2 的物质的量 = 1 ∶ 2 ∶ 1,D 选项错误.因此,此题的答案为 D 选项.
参考文献 :
[1]袁婷婷.高中化学图像题解题策略探究[J].数 理化解题研究,2019(19) : 89-90 .
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/72888.html