SCI论文(www.lunwensci.com):
摘 要:文章以“利用手持技术测定电导率探究离子反应的实质”为例,探讨核心素养视域下 手持技术在高中化学教学中的应用,培养学生的“科学探究与创新意识”核心素养.
关键词:核心素养;手持技术;电导率;离子反应;高中化学
1 手持技术
手持技术( Hand - held Technology) , 又称“数字化手持技术实验系统”,是由各种传感器、数据采集 器与配套的软件( 如爱迪生软件)组成,通过与电脑 连接来定量采集和处理数据的实验辅助系统.它可 通过采集数据并对数据进行处理,可将表征实验现 象的实验数据通过计算机实时呈现,并可将实验数 据图像化、动态化、直观化,因此利用手持技术辅助 实验往往可达到快速突破教学重难点,优化教学过 程和提高教学效率的目的.
2 利用手持技术测定电导率探究离子反应的实质
2 . 1 探究实验 1:初探 Ba( OH) 2 溶液与 H2 SO4 溶液的反应
在鲁科版化学必修 1 第二章第二节“ 电解质 ” 中实验“稀硫酸与氢氧化钡在水溶液中的反应”对 离子反应的实质进行了探究,通过课本实验,学生们 难以观察和理解微观离子之间是如何反应的,其反 应过程如何.此时,教师可指导学生利用手持技术测 定电导率的方式,对离子反应的实质进行更为深入的探究,进而培养学生对知识的运用能力和“科学 探究与创新意识”核心素养.
实验步骤:组装好实验装置后,将 20 mL 饱和 Ba( OH) 2 溶液倒入小烧杯中放置,加入磁力球,打 开磁力搅拌器,打开“ 爱迪生 ”软件,点击开始,用 “ 爱迪生”软件测定 Ba( OH) 2 溶液的电导率,用胶 头滴管逐滴加入 H2 SO4 溶液,待 Ba(OH) 2 溶液完全反 应后(图像趋于水平直线),停止滴加,进行数据处理.
实验现象:向饱和 Ba( OH) 2 溶液中逐滴加入 H2 SO4 溶液时,有白色沉淀产生,其反应原理为:
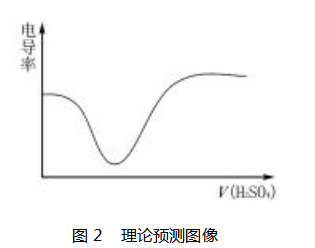
分析溶液的电导率图像可知,溶液的电导率先 迅速下降,后快速上升.所得实验图像( 如图 1 所 示)与理论预测图像( 如图 2 所示)相差较大.
实验分析及反思:实验所得数据所呈现的图像 与预设图像差别较大,猜想可能是下列 4 个方面的因素造成:猜想一,所做实验只是个定性实验,未考 虑 H2 SO4 溶液和 Ba( OH) 2 溶液的浓度对电导率的 影响,可能是 H2 SO4 和 Ba( OH) 2 浓度差太大对实 验造成较大影响;猜想二,即使是同浓度的 H2 SO4 和 Ba( OH) 2 溶液,其电导率也可能存在较大的差 距,溶液的电导率与溶液本身的性质有关;猜想三, 图像出现明显转折,可能是使用胶头滴管不能控制 滴加溶液的速率,溶液未能持续滴入,导致反应不存 在连续性;猜想四,酸碱中和反应为放热反应,且当 H2 SO4 溶液浓度过高时和水接触也会放出大量的 热,使溶液温度升高,可能是电导率还会受到温度的 影响.为了验证上述猜想,教师可指导学生查阅资料 并进一步设计实验方案来验证上述猜想.
2 . 2 探究实验 2:探究电导率的影响因素
电导率( total dissolved solids ) 是物体传导电流 的能力.根据欧姆定律,电导率是电阻的倒数,其 基本单位是西门子( S) . 其影响因素主要有离子浓 度大小及温度等.利用手持技术测电导率来探究 离子反应的实质的过程中也要考虑电导率的影响 因素带来的影响.
实验 1 :探究温度对电导率的影响
组装好装置后,打开爱迪生软件,向烧杯中加入 20mL Ba( OH) 2 溶液,点击开始,待图像稳定后,打 开磁力搅拌器并按下加热键,观察图像,实验 2 . 1 实 验图像如图 3 所示,可得实验结论为:加热Ba( OH) 2溶液,电导率随溶液温度升高而增大.
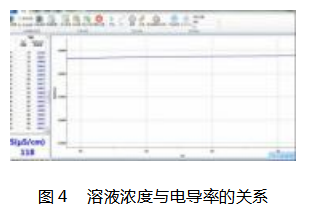
实验 2:探究溶液浓度与电导率的关系
组装装置后,打开爱迪生软件,向烧杯中倒入 1 . 0 mol/LCuSO4 溶液,点击开始,待图像稳定后,打 开磁力搅拌器,开始滴入 H2 O 并观察图像.实验 2 . 2 实验图像如图 4 所示.可得实验结论为:对于强电解 质,当浓度降低时,溶液电导率上升,即对强电解质, 浓度越大,电导率越小.通过以上两个探究实验验证 了猜想一和猜想四,溶液的电导率确实受到温度及 溶液浓度的影响.此时可调整实验方案为探究同浓 度的 Ba( OH) 2 溶液与 H2 SO4 溶液反应,利用手持 技术测其电导率的变化.
2 . 3 探究实验 3:探究同浓度的 Ba ( OH) 2 溶液与 H2 SO4 溶液反应时电导率的变化
实验 1:配置 250 mL 1 mol/L 的饱和Ba(OH) 2 溶 液,配置 250 mL 1 mol/L H2 SO4 溶液
利用 Ba( OH) 2 固体和 98% H2 SO4 溶液来配制 所需溶液,通过计算需要 42 . 750 g Ba( OH) 2 固体, 但在配制实验过程中发现,将 42 . 750 g Ba( OH) 2 固 体溶于水时,会有大量固体析出,所配溶液为过饱和 溶液,无法配制 1 mol/L 的 Ba( OH) 2 溶液.经查询, 常温常压下,100 g 水只能溶解 3 . 89 g 的 Ba( OH) 2 固体,忽略溶液体积的变化,此时所得 Ba( OH) 2 溶 液的溶液约为 0 . 22 mol/L , 故此,将实验方案调整为 配制 0 . 10 mol/L Ba ( OH ) 2 溶 液 与 0 . 10 mol/L H2 SO4 溶液.
实 验 2:利 用 手 持 技 术 测 定 0 . 10 mol/L Ba( OH) 2 溶液与 0 . 10 mol/L H2 SO4 溶液反应时电 导率的变化
实验 2 . 1 :利 用 手 持 技 术 分 别 测 定 蒸 馏 水、 0 . 10 mol/L Ba( OH) 2 溶液、0 . 10 mol/L H2 SO4 溶液 的电导率.实验结果如图 5 、图 6 、图 7 所示.综合分 析上述三个实验的实验数据,可发现溶液的电导率与电解质本身的性质有很大的关系,由电导率图像 可知,浓度相同的 Ba( OH) 2 溶液与 H2 SO4 溶液电 导率相差较大,验证了猜想四的正确.
实验 2 . 2:利 用 手 持 技 术 测 定 向 0 . 1 mol/L H2 SO4 溶液中逐滴滴加 0 . 1 mol/L Ba( OH) 2 溶液的 电导率.
通过前面的一系列实验,明确了实验的温度、反 应物本身的性质、溶液的溶度等均对溶液电导率存 在一定的 影 响,此 时 可 设 计 实 验 测 定 同 浓 度 的 H2 SO4 溶液与 Ba( OH ) 2 溶 液 反 应 的 电 导 率.组 装好实验 装 置,利 用 手 持 技 术 测 定 向 0 . 1 mol/L H2 SO4 溶液中 逐 滴 滴 加 0 . 1 mol/L Ba ( OH ) 2 溶 液的电导率.所得实验 数据如图 8 所示.由实验 数据图像可知,向 0 . 1 mol/L Ba( OH) 2 溶液中逐 滴滴加 0 . 1 mol/L H2 SO4 溶液,随着反应的开始, 溶液的电导率开始下降说明溶液中大量可移动离子相互反应导致离子浓度减小从而引起溶液电导率下降,当反应恰好完全时,
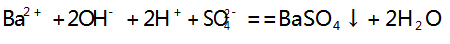
溶液电导率接近于水的 电 导 率,继 续 滴 入 过 量 H2 SO4 , 溶 液 中可移动的 H + 与 SO- 离子浓度增大,溶液电导率上升至最 高 点,到 达 一 定 的 临 界 点 后,继 续 滴 入 H2 SO4 溶液,离 子 浓 度 继 续 上 升,离 子 间 相 互 作 用增强使溶液的电导率真又下降,直至溶液均 一 稳定后,电 导 率 的 数 值 趋 于 平 稳.此 时 有 学 生 可
能会得出结论:离子反应实质是反应物的某些离 子浓度减少的过程.但离子反应的实质 一 定是反 应物的某 些 离 子 浓 度 少 吗? 可 否 为 某 些 离 子 浓 度的增加 呢? 由 此 设 计 了 下 面 的 实 验 方 案 来 验 证上述猜想 .
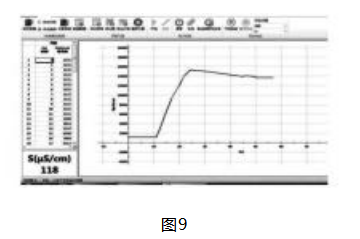
2 . 4 探究实验4:探究 1 mol/L 的醋酸溶液与1 mol/L 的氨水反应时电导率的变化
组装好实验装置后,打开爱迪生软件,向烧杯中 倒入 50 mL 1 mol/L 醋酸的溶液,用分液漏斗添加 1 mol/L的氨水溶液,打开磁力搅拌器,取下分液漏 斗上活塞,打开分液漏斗旋塞,开始实验.实验数据 如图 9 所示.分析实验数据可知,向 1 mol/L 的醋酸 溶液中滴加 1 mol/L 的氨水溶液,因为弱电解质在 发生 电 离 过 程 中,电 离 出 离 子 数 量 非 常 少,但 CH3 COO - 与 NH4+ 结合生成的盐 CH3 COONH4 为强电解 质,其 反 应 原 理 为:CH3 COOH + NH3 · H2 O==CH3 COONH4 + H2 O , 使可移动离子浓度增大,电导率增 大,故 实 验 图 像 开 始 时 上 升,待 反 应 结 束后,随 着 氨 水 不 断 加 入,CH3 COONH4 浓 度 降 低,电导率降低,导致图像曲线往下降.综合实验 3 与实验 4 , 通 过 电 导 率 变 化 图 像 分 析 可 得 出 结 论,离子反应的实质应为反应物的某些离子浓度 发生改变的过程 .
参考文献:
[1] 朱鹏飞,马宏伟.利用数字化实验发展学生化学学科核心素养[ J ] . 中小学数字化教学( 京),2018(7) : 4 - 7 .
[2] 中华人民共和国教育部.普通高中化学课程标 准(2017 年版)[ M] . 北京:人民教育出版社, 2017 .
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/72713.html
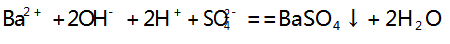



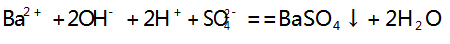 溶液电导率接近于水的 电 导 率,继 续 滴 入 过 量 H2 SO4 , 溶 液 中可移动的 H + 与 SO- 离子浓度增大,溶液电导率上升至最 高 点,到 达 一 定 的 临 界 点 后,继 续 滴 入 H2 SO4 溶液,离 子 浓 度 继 续 上 升,离 子 间 相 互 作 用增强使溶液的电导率真又下降,直至溶液均 一 稳定后,电 导 率 的 数 值 趋 于 平 稳.此 时 有 学 生 可
溶液电导率接近于水的 电 导 率,继 续 滴 入 过 量 H2 SO4 , 溶 液 中可移动的 H + 与 SO- 离子浓度增大,溶液电导率上升至最 高 点,到 达 一 定 的 临 界 点 后,继 续 滴 入 H2 SO4 溶液,离 子 浓 度 继 续 上 升,离 子 间 相 互 作 用增强使溶液的电导率真又下降,直至溶液均 一 稳定后,电 导 率 的 数 值 趋 于 平 稳.此 时 有 学 生 可