SCI论文(www.lunwensci.com):
摘要:目的全面总结中药黄芩研究情况,提供近年来国际国内黄芩研究的最新动向和进展。方法对近年来国内外主要期刊和著作中有关黄芩的文献进行综述和比较分析。结果近年来国际国内对黄芩研究以化学成分的提取分离、抗氧化、抗HIV和清除自由基为热点。结论中药黄芩的研究方兴未艾,然国内研究与国际水平的差距大、隔阂深,亟待沟通与整理提高。
关键词:黄芩;研究进展
本文引用格式:陈秉虎,陈秉雄.黄芩的研究进展[J].世界最新医学信息文摘,2019,19(71):132-134.
0引言
中药正品黄芩为唇形科多年生草本植物黄芩(Scutellaria baicalensis Georg)的干燥根[1]。味苦性寒,具有清热燥湿、泻火解毒、凉血止血、除热安胎的功效,泡茶喝有清凉败火、消炎去暑的功效。系极常用中药,为我国大宗中药材[2]。随着中医药现代化的不断发展,黄芩药材需求量不断增大,野生黄芩资源锐减,已不能满足市场需求,栽培黄芩已成为国内黄芩药材的主要来源。现代中医药研究证明黄芩中主要含有黄酮类衍生物,具有抗病原体、抗炎、镇痛、抗过敏、抗肿瘤、增强免疫系统功能、保肝、抗氧化、抗自由基损伤、调节中枢神经系统等诸多作用[3,4]。而最新研究结果表明,黄芩中的萜类等成分也具有很强的生物活性。现将近年来国内外对黄芩的研究进展综述如下。
1植物基源、本草考证
正品黄芩为唇形科多年生草本植物黄芩(Scutellaria baicalensis Georg)的干燥根,别名黄金茶、山茶根、烂心草等。黄芩始载于《神农本草经》,被列为上品,曰:“生秭归(今湖北秭归县)川谷及冤句(今山东荷泽县)。”陶弘景曰:“今第一出彭城(今江苏铜山县)、郁州(今江苏灌云县)亦有之。”《新修本草》载:“今出宜州(今湖北宜昌)、鹿州(今陕西鹿县)、泾州(今甘肃泾县)者佳,兖州者大实而好,名炖尾芩也。”《本草图经》云:“今川蜀、河东、陕西近郡皆有之。苗长尺余,茎干粗如箸,叶从地四面丛生,类紫草,高一尺许,亦有独茎者,叶细长,青色,两面相对,六月开紫花,根黄如知母粗细,长四五寸。”《吴普本草》云:“二月生,赤黄叶,两两四四相值,茎空中,或方园,高三四尺,四月花紫红赤。五月实黑,根黄。”李时珍《本草纲目》载:“宿芩乃旧根,多中空,外黄内黑,即可谓片芩。子芩乃新根,多内实,即可谓条芩。或云西芩多中空而色黔,北芩多内实而深黄。”据此,古人所描述的黄芩植物形态与现在所用的黄芩一致[5-6]。
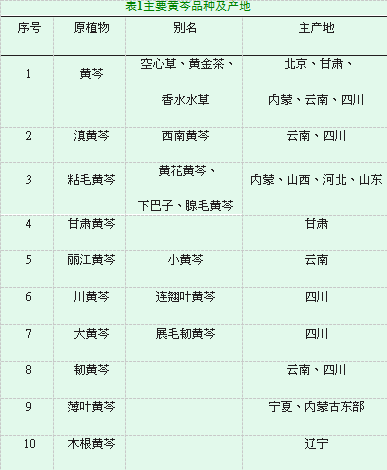
正品黄芩在我国各地都有分布,生长适应性很强,不怕严寒和干旱,荒山、荒坡、树林、野地等处均可生长。此外,黄芩属中尚有几种植物的根在有些地区也作黄芩使用,但《中国药典》(2010版)只以唇形科多年生草本植物黄芩(Scutellaria baicalensis Georgi)的干燥根为正品[7-10]。黄芩属植物全世界约有300种,我国约有100种,南北均产。目前各地其他入药的黄芩品种主要有:滇黄芩、粘毛黄芩、连翘叶黄芩、甘肃黄芩、丽江黄芩、大黄芩、念珠根黄芩、乌苏里黄芩、狭叶黄芩[11-16]。如下表1。
2种植和质量研究
苏淑欣等[17]对黄芩生长发育规律进行研究,发现黄芩种子必须足墒且在20℃时出苗;适量施氮肥有利于根系、种子产量的形成。应在苗期追施氮肥,适量追施氮磷钾肥,以提高黄芩产量。谢晓亮等[18]在黄芩GAP的研究中,明确了黄芩的品种特征、产地环境、种子标准、育苗技术、栽培措施、采收加工、外观品质、成分含量、农药残留以及包装、储运等。方阵等[19]通过田间试验及高效液相色谱法(HPLC)测定黄芩不同月份生长及器官中黄芩苷的含量,结果显示,6~7月及8~9月为黄芩地上部分生长的两个高峰期,地下部分在8~10月生长旺盛;根中黄芩苷含量以l0月份较高,符合传统采收季节。建议6~9月前加强田间水肥管理,以11月中旬前后为最佳采收时期。王秀敏等[20]用HPLC法测定不同时间采集的不同株龄的黄芩中黄芩苷的含量,结果表明栽培黄芩中黄芩苷含量在5~6月及9月最高,黄芩在栽培后的头3年,黄芩苷含量无明显增加,但3年生黄芩根重(9月)较2年生的显著升高,从产量和黄芩苷含量两个因素综合考虑,河北怀柔栽培黄芩的最佳采收时期为栽培后第3年的9月。
3遗传多样性研究
冯学锋等[21]用随机扩增的DNA多态性分析(RAPD)方法,对13个居群62个黄芩和并头黄芩(S.scordifolia)样本进行了遗传多样性及黄芩居群遗传变异测定,结果表明黄芩样本RAPD聚类分析(UPGMA)没有表现出明显的分支,但显示出与地理位置有关3个类群,首次在分子水平上证明黄芩道地性与遗传变异和地理环境有关系。邵爱娟等[22]对34个黄芩不同种源进行了RAPD分析,表明不同种源黄芩间具有丰富的遗传多样性,34个黄芩种源可明显聚为A、B、C、D等4大类,山东蒙阴3、山东蒙阴2、山东平邑种源间的遗传距离较近,可考虑在黄芩系统选育中作为单一品种育种。黄芩种源间的遗传背景较为复杂,在遗传学上的分析结果与其外观形态大体上相似,但是与地理分布却没有一定的相关性,所以,在黄芩良种选育过程中必须加强优良种子的选育和管理。
4生物技术
4.1组织培养
Hirotani M等[23]从黄芩幼苗的叶柄、子叶和根部取材进行培养,获得三者的愈伤组织,用HPLC测定其中黄芩苷含量分别为8.5%,7.1%和0.6%;黄芩素分别为0.3%,1.2%和0.2%,以上含量均以鲜重计。如果60℃低温干燥后再测定,黄芩苷含量下降90%以上,而黄芩素则升高约2倍。可见组织培养材料的选择和提取加工方法对这2种成分的生产极为关键。9种黄芩的愈伤组织都能产生黄芩苷、汉黄芩素7-葡萄糖苷、黄芩素、汉黄芩素、黄芩新素-Ⅰ、黄芩新素-Ⅱ、白杨黄素、acteoside等8种黄酮类成分,但以含量高低可分为4组:爱约黄芩(Scutellaria iyoensis)和范氏黄芩(S.ventenatii)以黄芩苷、汉黄芩素-7-葡萄糖苷和汉黄芩素为主;侧花黄芩(S.laterif lora)以黄芩素和汉黄芩素为主;灰毛黄芩(S.incana),东方黄芩(S.orientalis)和牛黄芩(S.taurica)以汉黄芩素-7-葡萄糖苷和汉黄芩素为主;并头草(S.galericulata)以黄芩苷为主。爱约黄芩(S.iyoensis)中黄芩苷在光照培养和暗培养条件下的含量分别为4.04%和4.06%,没有明显的差异[24]。该项研究表明黄芩苷等是广泛存在的黄酮化合物,如果中药黄芩有特殊药效,则一定还有其他类型活性成分。
4.2细胞悬浮培养
Ahn YO等[25]研究发现,在黄芩的细胞悬浮培养过程中,维生素C的浓度不断增加,到21 d达到最高,大约120 ng·g-1(干细胞重),而且证明L-半乳糖和L-半乳糖-1,4-内酯是黄芩细胞培养中维生素C生物合成的重要前体。Satoshi M等[26]研究发现,在悬浮培养过程中细胞代谢产生大量H2O2,并由于β-葡萄糖醛酸酶的作用,使得黄芩苷水解成黄芩素,而黄芩素又很快被过氧化物酶氧化,影响黄芩素收率,采用β-葡萄糖醛酸酶抑制剂糖酸1,4-内酯降低H2O2的产生。实际上黄芩素本身就是β-葡萄糖醛酸酶的抑制剂,可以阻止进一步的氧化反应的发展[27]。因此黄芩细胞悬浮中黄酮葡萄糖苷酶、葡萄糖酸酶和葡萄糖醛酸酶的活性成为调控关键。研究发现,用酵母激发可使黄芩细胞悬浮培养诱导产生三萜类成分[28]。
4.3克隆技术的应用
Hirotani M等[30]研究了黄芩毛状根中黄酮-7-葡萄糖基转移酶的克隆和尿核苷二磷酸葡萄糖的基因表达[29]。Nishikawa K等从黄芩克隆体根部分离到黄芩新素Ⅰ和acteoside两种已知黄酮和一种新化合物。日本学者用聚合酶链式反应(PCR)技术将T 2-DNA直接植入获得黄芩的转基因毛状根,并从中分离到一种新的黄酮苷,即5,7,2',6'-四甲氧基黄酮2'-O-β-葡吡喃糖苷[31]。
5生物活性研究
5.1抗氧化
Gao ZH等[32]研究发现,黄芩素和黄芩苷清除羟自由基、DPPH和烷自由基呈剂量依赖关系,在10 nmol·L-1浓度时明显抑制由Fe2+2Vc,二脒基丙烷-AAPH或NADPH引起的大鼠大脑皮层线粒体脂质过氧化和卵磷脂质体代谢,10 nmol·L-1浓度时对培养人体神经细胞瘤SH2SY5Y细胞株中,可对抗H2O2引起的损伤;而汉黄芩素和汉黄芩苷几乎无清除自由基作用,仅能抑制NADPH引起的脂质过氧化。Shao ZH等[33]研究发现黄芩素是以上4种黄酮中抗氧化作用最强的,与其A环上3个邻位羟基有密切关系。体外实验证明,黄芩素具有直接清除超氧-、氢过氧化-、和羟-自由基的作用,用细胞内荧光探针二氯二氢荧光素的乙酰乙酸盐(对H2O2和羟-自由基敏感)和二羟乙锭(对超氧-自由基敏感)证明黄芩对心肌缺血再灌有保护作用,对照组细胞死亡率(47±3)%,存活细胞未见恢复收缩,给黄芩提取物组为(26±2)%,有显著差异(P<0.001),而且细胞恢复收缩。此外,Shen ZY等[34]研究发现黄芩的丙酮提取物按100 mg·L-1量加入canola油中的抗氧化作用(以耗氧量和亚麻酸及亚油酸量为检测指标)比200 mg·L-1的丁基羟甲苯强,而且与提取物中黄芩素水平呈正相关,提示黄芩的丙酮提取物可望成为保存加工食品的天然抗氧化剂。
5.2抗菌和抗病毒作用
Liu IX等[35]研究发现黄芩苷在低于细胞毒浓度时可以抑制T细胞和HIV21型Env蛋白,而且在HIV21被吸附之初,黄芩苷可以阻止其复制,其作用机制和主要环节在于干扰HIV21攻击靶细胞,因此有望开发成为新的抗艾滋病药物。黄芩苷16 ng·mL-1与苄基青霉素合用,可使对新霉素和青霉素的金葡抗性株的最低有效浓度分别从125和250 ng·mL-1下降为4和16 ng·mL-1,并有量效关系。对这类β内酰氨抗菌素抗性株,加用16 ng·mL-1的黄芩苷,可恢复其抗菌作用,为临床合理应用这类抗菌素提供理论依据。此外,黄芩对皮肤和指甲的致病真菌有抑制作用。
5.3抗致癌作用
Kimura Y等研究[36]显示黄芩素可抑制黄曲霉毒素B1和亚硝胍对沙门菌的致突作用,并且有量效关系,在浓度5 nmol·L-1时可降低黄曲霉毒素致染色体畸变的频率,但在浓度50 nmol·L-1或以上时则加强黄曲霉毒素B1的染色体断裂作用。此外,黄芩素对白细胞介素和肿瘤坏死因子均有增强作用。
5.4免疫作用
Hui KM等[37]研究发现与γ-氨基丁酸受体亲合能力的大小顺序为汉黄芩素、黄芩素、scutellarein和黄芩苷,可部分地解释苷元比苷的作用强的生化基础。Kim HM等[38]研究发现黄芩本身对NO的产生无直接作用,但与重组干扰素合并应用则能刺激小鼠腹膜巨噬细胞增加NO的产生,从而起到抗菌、抗病毒作用。黄芩素和汉黄芩素对小鼠巨噬细胞因脂多糖引起的NO增加和NO合成酶的蛋白表达均有明显的抑制作用,此结果有助于阐明黄芩的抗炎解热作用[39]。
5.5对血管作用
Chen ZY等[40]研究发现黄芩素对离体大鼠肠系膜动脉在低浓度时表现为收缩作用,而在高浓度时则表现为松弛血管平滑肌作用,其机制是抑制了蛋白激酶的收缩作用。
5.6保肝作用
罗德生等[41]发现动物经CCl4处理后,血清丙氨酸转氨酶(ALT)和琥珀酸脱氢酶(SDH)活性均迅速显著地升高,应用黄芩煎剂后血清酶活性降低,降低程度与药物剂量呈量效关系。说明黄芩煎剂具有良好的保护CCl4致大鼠急性肝损伤的作用,为黄芩作为临床护肝药物提供了实验依据。
5.7在复方中作用
日本学者研究了黄芩和含有黄芩的复方(三黄泻心汤、小柴胡汤)水提取物对神经胶元细胞内Ca2+浓度有抑制作用,并呈现量效关系[42]。以上3种水提取物以及黄芩苷,通过抑制前列腺素E2(PGE2)的释放,降低花生四烯酸的浓度,对防治高血压和糖尿病等有重要的临床意义。比较黄芩苷和黄芩素对组胺、去甲肾上腺素、卡巴胆碱可引起的细胞内钙浓度升高的抑制作用(降低磷酸酯酶C的活性),发现苷元比苷的作用强很多[43]。柴朴汤是日本用于支气管哮喘治疗的有效汉方药,复方和黄芩素均可抑制来自多态核白细胞的白三烯B4及C4(LTB4和LTC4)的释放,半数有效浓度为63nmol·L-1,而方中甘草次酸可选择性地抑制LTC4的释放[44]。
6结语
中药黄芩的研究方兴未艾,且国内研究与国际水平的差距大、隔阂深,亟待沟通与整理提高。长期以来,国内对黄芩的研究多局限于黄酮成分及其抗菌抗炎作用,然而,从近年国际发展的趋势来看,生物技术突飞猛进,已经达到基因和克隆水平;化学成分方面,通过黄芩化学成分研究而分离鉴定了多种萜类,并且显示有很强的生物活性;活性方面,抗氧化、与β内酰氨类抗菌素联用对付抗性株、对心血管和微循环的调节,以及抗HIV病毒等均有所突破。因此,在科技迅猛发展的国际大背景下,我们必须借助国内外先进的科学成果与技术,不固守一角,努力开展黄芩多角度纵深的全面研究,为黄芩的开发利用开辟更广阔的前景。
参考文献
[1]中华人民共和国卫生部药典委员会.中国药典一部[M].北京:化学工业出版社,2010,282-283.
[2]宋立人,洪恂,丁绪亮,等.现代中药学大辞典[M].北京:人民卫生出版社,2001:1865-1869.
[3]宋扬文,陈忻.中药黄芩药理作用的研究进展[J].中国中医药科技,2010,17(4):375-376.
[4]Kow alczykE,K rzes isk iP,KuraM,et al.Ph arm acological effects of flavonoid s from scutellaria baicalen sis[J].Przeg l Lek,2006,63(2):95-96.
[5]李子,郝近大.黄芩本草考证[J].中药材,2008(10):67-70.
[6]林慧彬,路宁,王臣臣,等.黄芩的本草考证[J].四川中医,2007,(12):123-125.
[7]谢宗万.中药材品种论述(中册).上海:上海科学技术出版社,1994:5502-5551.
[8]苏淑欣,李世,尚文艳,等.黄芩生长发育规律的研究[J].中国中药杂志,2003,28(11):1018-1021.
[9]方阵,杨金兵,王康才.黄芩生长特性与有效成分积累[J].中药材,2002,25(2):84-85.
[10]郭朝民,郭秀丽.黄芩与滇黄芩的鉴别[J].河南中医,2003,23(9):72-73.
[11]戴宝合,等.野生植物资源学[M].北京:中国农业出版社,2003,2:124-126.
[12]陈柏君,高山林,余国奠.黄芩及其同属药用植物研究进展[J].中国野生植物资源,1999,18(3):20--24.
[13]李欣,黄璐琦,邵爱娟,等.黄芩种质资源的研究概况[J].世界科学技术-中医药现代化,2003,5(6):54--58.
[14]马林,宋万志,吴丰.中药黄芩类的品质评价及资源利用[J].天然产物研究与开发,1993,5(4):9--12.
[15]王兰珍,刘勇.黄芩种质资源及培育技术研究进展[J].北京林业大学学报,2007,29(2):138-143.
[16]冯学锋,胡世林,郭宝林,等.黄芩种群遗传多样性初步研究[J].世界科学技术-中药现代化,2002,4(4):38-43.
[17]苏淑欣,李世,尚文艳,等.黄芩生长发育规律的研究[J].中国中药杂志,2003,28(11):1018-1021.
[18]谢晓亮,温春秀,吴志明,等.黄芩GAP栽培技术标准操作规程(草案)[J].现代中药研究与实践,2003,17(4):35-37.
[19]方阵,杨金兵,王康才.黄芩生长特性与有效成分积累[J].中药材,2002,25(2):84-85.
[20]王秀敏,邓英杰,钟海军,等.河北怀柔栽培黄芩最佳采收期研究[J].中药材,2005,28(1):5-7.
[21]冯学锋,胡世林,郭宝林,等.黄芩种群遗传多样性初步研究[J].世界科学技术—中药现代化,2002,4(4):38-43.
[22]邵爱娟,李欣,黄璐琦,等.不同种源黄芩的RAPD分析[J].中国中药杂志,2006,31(6):452-455.
[23]Hirotani M,Nagashim S,Yoshikawa T.Baicalin and baicaletin productions of cultured Scutellaria baicalensis cells[J].Nat Med,1998,52(5):440.
[24]Nishikawa K,Furukawa H,Fujioka T,et al.Phenolics in tissue cultures of Scutellaria[J].Nat Med,1999,53(4):209.
[25]Ahn YO,Kwon SY,Lee HS,et al.Biosynthesis and metabolism of vitamin C in suspension cultures of Scutellaria baicalensis[J].J Biochem Mol Biol,1999,32(5):451.
[26]Satoshi M,Norifumi T,Tomuko M.Novel hydrogen peroxide metabolism in suspension cells of Scutellaria baicalensis Georgi[J].J Biol Chem,1998,273(20):12606.
[27]Nishioka T.NITES2Baicalein,an a2Glucosidase Inhibitor for Scutellaria baicalensis[J].J Nat Prod,1998,61(11):1413.
[28]Yoon HJ.Induced accumulation of triterpenoids in Scutellaria baicalensis suspension cultures usi yeast elicitor[J].Biotechnol Lett,2000,22(13):1071.
[29]Hirotani M.Cloning and expression of UDP2glucose:flavonoid 7-O-glucosytransferase from hairy root cultures Scutellaria baicalensis[J].Planta,2000,210(6):1006.
[30]Nishikawa K,Furukawa H.Flavone production in transformed root cultures Scutellaria baicalensis Georgi[J].Phytochemist ry,1999,52(5):885.
[31]ZhouY.Flavonoids and phenylethanoids from hairy root cultures of Scutellaria baicalensis[J].Phytochemist ry,1997,44(1):83.
[32]Gao ZH,Huang KX,Yang XL,et al.Free radical scavenging and antioxidant activities of flavonoids extracted from the radix of Scutellaria baicalensis Georgi[J].Biochem Biophys Acta,1999,1472(3):643.
[33]Shao ZH,Li CQ,Vanden HT,et al.Extract from Scutellaria baicalensis Georgi attenuates oxidant stress in cardiomyocytes[J].J Mol Cell Cardiol,1999,31(10):1885.
[54]Shen ZY,Su YL,Bi YR,et al.Food science and technology-ef-fect of baicalein and acetone extract of Scutellaria baicalensis on canola oil oxidation[J].J A m Oil Chem Soc,2000,77(1):73.
[35]Liu IX,Durham DG,Richards RM.Baicalin synergy with beta-lactam antibiotics against methicillin-resistant Staphylococcus au-reus and other beta-lactam-resistant strains of S.aureus[J].J Pharm Pharmacol,2000,52(3):361.
[36]Kimura Y.Effects of baicalein isolated from roots of Scutellaria baicalensis Georgi on interleukin 1 and tumour necrosis factor-in-duced tissue-type plasminogen activator and plasminogen activator inhibitor-1 production in cultured human umbilical vein endothe-lial cells[J].Phytother Res,1997,11(5):363.
[37]Hui KM,Wang XH,Xue H.Letters-interaction of Flavones from the Roots of Scutellaria baicalensis with the Benzodi-azepine Site[J].Planta Med,2000,66(1):91.
[38]Kim HM,Moon EJ,Li E,et al.The nitric oxide-producing ac-tivities of Scutellaria baicalensis[J].Toxicology,1999,135(2-3):109.
[39]Wakabayashi I.Inhibitory effects of baicalein and wogonin on lipopolysaccharide-induced nitric oxide production in macrophages[J].Pharmacol Toxicol,1999,84(6):288.
[40]Chen ZY,Su YL,Lau CW,et al.Endothelium-dependent con-traction and direct relaxation induced by baicalein in rat mesenter-ic artery[J].European Journal of Pharmacology,1999,374(1):41.
[41]罗德生,郑红花,等.黄芩煎剂对四氯化碳致大鼠急性肝损伤的保护作用[J].陕西中医,2004,25(2):184.
[42]Kyo R,Nakahata N,Sakakibara I,et al.Effects of Sho-saiko-to,San'o-shashin-to and Scutellariae Radi x on in tracellular Ca2+mobilization in C6 rat glioma cells[J].Bio Pharma Bull,1998,21(10):1067.
[43]Kyo R,Nakahat N,Sakakibara I,et al.Baicalin and baicalein,constituents of a important medicinal plant,inhibit intracellularCa2+elevation by reducing phospholipase C activity in C6 ratglioma cells[J].J Pharm Pharmacol,1998,50(10):1179.
[44]Homma M,Minami M,Taniguchi C,et al.Inhibitory effects of lignans and flavonoids in Saiboku-To,a herbal medicine for bronchial asthma,on the release of leukotrienes from human polymorphonuclear leukocytes[J].PlantaMed,2000,66(1):88.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/20119.html