SCI论文(www.lunwensci.com):
摘要:目的分析单孔近红外荧光胸腔镜肺段切除术的围手术期优势及技术要点。方法回顾性分析我院完成连续的255例单孔近红外荧光胸腔镜肺段切除术,根据肺段手术质控标准进行手术。均采用单孔胸腔镜手术,妥善离断靶段血管、支气管后,使用吲哚菁绿反染法确定段间平面,以适形裁剪法进行段间交界的分离。结果手术均顺利完成,手术时间较短,出血少,术后患者快速康复,顺利康复。结论结合近红外荧光技术、单孔胸腔镜技术,在良好的术前三维重建规划和术前定位的指引下,可以实现精准的肺段切除术。
关键词:荧光胸腔镜;近红外;单孔;肺段切除术;三维重建
本文引用格式:刘政呈,杨如松,曹珲,等.连续255例单孔近红外荧光胸腔镜解剖性肺段切除术的应用研究[J].世界最新医学信息文摘,2019,19(66):170-171.
0引言
肺段切除术越来越多的应用于早期肺癌的治疗,其最大的优势之一是减少切除的肺组织[1]。足够的切缘距离是肺段切除术的最关键因素[2],段间平面的精确界定尤为重要,以往的肺段切除术使用改良膨胀-萎陷法确定段间平面,耗时较长,而且难以在合并肺气肿的情况下显示良好的分界。使用近红外荧光胸腔镜可以通过吲哚箐绿(indocyanine green,ICG)反染法简单、快捷、精确的确认段间平面[3]。单孔胸腔镜手术具有术后疼痛少,术后康复快的优势[4],然而单孔胸腔镜肺段切除术技术难度更大,对段门结构的解剖操作及对术者的要求更高[4]。
本研究通过回顾性分析2018年01月至2019年03月我院完成的连续255例单孔近红外荧光胸腔镜肺段切除术,总结其围手术期优势及技术要点。
1临床资料与方法
1.1临床资料
2018年01月至2019年03月间我院共完成255例单孔近红外荧光胸腔镜肺段切除术,回顾性分析其临床资料,男116例,女139例,平均年龄47.5岁。入组患者均为意向性肺段切除术,手术适应证:(1)薄层胸部CT见肺部结节直径≤2 cm,且具备以下至少一个特征:a.原位腺癌,b.CT示磨玻璃成分≥50%,c.病灶倍增时间≥400天;(2)病灶距离脏层胸膜较远,难以行楔形切除术。所有患者术前行胸部增强CTA检查,应用EDDA-IQQA软件进行术前三维重建。术前行CT引导经皮肺穿刺定位。恶性病灶者需确保肺段切缘与病灶距离≥2 cm,或≥肿瘤直径。
1.2麻醉及手术方法
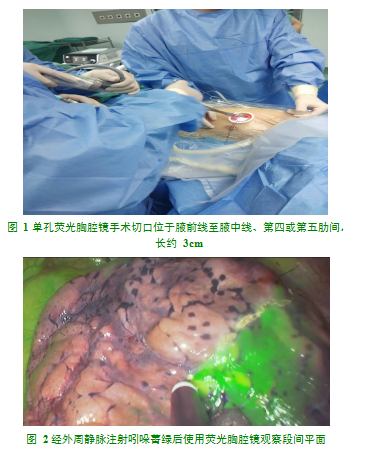
所有患者均行静脉复合麻醉,双腔气管插管,采用单孔法,切口位于腋前线至腋中线、第四或第五肋间,长约3cm(图1)。
根据术前三维重建结果,妥善离断靶段动脉、支气管,提起靶段支气管、动脉残端后,再次结合三维重建,寻找明确的靶段内静脉,也可在打开段门时判断段内静脉并予以离断。
使用荧光胸腔镜(Pinpoint系统,Novadaq Technologies ULC,Stryker)时,改为荧光模式,经外周静脉注射吲哚菁绿25 mg,待吲哚菁绿经过肺动脉到达肺组织,需切除的靶段不显色,其余肺组织显示为绿色,可在胸膜面形成清晰的段间平面,以电凝钩标记段间平面后即可退出荧光模式(图2)。
段间交界的分离需结合能量设备及直线切割闭合器进行适形裁剪。提起靶段支气管、动脉的远心端,找及段间静脉,沿段间静脉及胸膜标志线分离,使用电凝进行分离,分离至靶段的段门充分舒展,可使用直线切割闭合器沿胸膜标记线进行裁剪,根据定位针位置保证足够的手术切缘。
根据术中快速病理结果指导淋巴结采样方式,若为原位腺癌,则无需行肺门、纵隔淋巴结采样,若考虑为微浸润腺癌则行纵隔、肺门、肺内淋巴结采样,若考虑为高分化腺癌,则行淋巴结清扫术。
胸腔注入温水,进行双肺通气试漏。若发现支气管破损所致的漏气,则需予以缝合。肺组织少量漏气时,创面覆盖盖可吸收聚乙醇酸网(Neoveil,Gunze Limited,Kyoto,Japan),喷洒生物蛋白胶。
放置22F胸腔引流管,引流管置于切口中央部位。
1.3术后康复
拔除气管后,予抗感染、祛痰、镇痛等治疗措施,每三天复查胸片直至拔除胸腔引流管,拔管指征:胸片示肺复张良好且无明确的胸腔积液,胸管无漏气,引流量≤200毫升/天。鼓励患者术后早期进食及功能锻炼。使用VAS评分体系评估患者术后疼痛情况。
2结果
应用近红外荧光技术完成单孔胸腔镜肺段切除术255例,病变位于右肺上叶78例,右肺下叶53例,左肺上叶73例,左肺下叶51例,切除的肺段包括RS1、RS2、RS3、RS2b+3a、RS3a+S1b、RS6、RS7+8、RS9+10、RS8、RS9、RS10、RS7-10、LS1+2+3、LS1+2、LS3、LS4+5、LS1+2b+c、LS6、LS8、LS9、LS10、LS9+10、LS7-10。
除单纯肺段切除术外,15例为肺段切除术+楔形切除术,其中9例为同一肺叶的肺段切除+楔形切除术(右肺上叶3例,左肺上叶6例),6例为不同肺叶的肺段切除术+楔形切除术,6例为肺段切除术+肺叶切除术,1例为肺段切除术+前纵隔病灶切除术。使用吲哚箐绿反染法出现清晰的交界线的平均时间为12.5s(10-14),有19例右肺上叶尖段切除术病例,在完成肺门解剖,静脉注射ICG后发现肺段面显色模糊、浅淡,改良方法为:以纱布压迫中下叶动脉干,然后注射ICG,使更多的血液流入右肺上叶,段间面显色明显改善。有13例因反染法后非显色区域不足而再次探查段内结构,离断其余靶段肺动脉分支,第二次使用ICG显色,获得较好的段面显色,而且切缘良好。段间静脉均走行于染色区域内,并予以保留。无中转开胸案例。行同一肺叶的肺段切除+楔形切除术时,有2例首先行楔形切除术,之后静脉注射ICG后显色不理想,染色边界扭曲不齐,且对解剖、打开段门的操作造成影响,后7例改为先解剖段门结构,行ICG染色,完成肺段切除术后再行楔形切除术,达到良好的段间面显色效果。
肺段切除术的病灶平均最大直径为9.8mm(5-20),病灶距离脏层胸膜的平均距离为19.2mm(10-25),平均病灶内磨玻璃成分比例为16.3%(0-50)。单纯肺段切除术的平均手术时间为103min(65-165),平均术中出血量47mL(30-450),平均切缘距离22.1mm(18-27)。平均淋巴结切除数为4.1(1-7),术后病理均证实为未见肿瘤转移。平均术后置管时间为3.6天(3-8),平均术后住院时间为4.7天(4-10)。总并发症18.4%(47/255),房颤2例,肺部感染1例,术后>3天的漏气5例,痰中带血39例。无术后30天死亡病例。
术后病理包括良性病灶10例(肺泡上皮增生9例,粘液栓1例),非典型腺瘤样增生11例,原位腺癌114例,微浸润腺癌91例,高分化腺癌29例。
术后第1天平均VAS评分为2.7(2-6),第3天平均VAS评分为2.3(2-6),第7天平均VAS评分为1.5(2-6),第30天平均VAS评分为0.9(1-5)。
3讨论
肺段切除术的最大优势是充分切除病变的同时尽可能保留健康肺组织,其基础是精准解剖[5]。段间平面的辨认也是肺段切除术的关键,良好显现的段间平面也可为精确肺段间适形裁剪提供指引[6]。近红外荧光胸腔镜的核心优势在于可以通过ICG反染法快速显示段间面,时间明显短于改良膨胀-萎陷法,而且与肺组织膨胀状态、是否合并慢性阻塞性肺疾病等因素无关[7]。
我们应用术前三维重建进行手术路径规划,近红外荧光胸腔镜技术实现肺段间面的精准界定,肺穿刺定位的主要目的是进一步保证足够的手术切缘。ICG反染法难以适时显示肺组织内的段间面,我们的方案是以ICG反染法确定脏层胸膜面的段间面,以电凝由内向外打开段门部分肺组织,辨识段间静脉并注意保护,以段间静脉及脏层胸膜标记线为指引,进行充分的适形裁剪,将段间面打开至近似于直线,这时可以使用直线切割闭合器切除靶段,实现精准肺段切除术。单孔胸腔镜下也可以顺利完成这些操作,同时应用单孔胸腔镜技术和近红外荧光胸腔镜,充分体现了肺段切除术的肿瘤学原则和微创优势。
我们的临床实践中,发现在右肺上叶的肺段切除术中,ICG反染法显示的段间面较为模糊,尤其在右肺上叶尖段切除术中更为明显,可能的原因在于:三维重建显示后段动脉可能存在深部的动脉分支供应尖段,而解剖时无法处理该支血管,使得肺段面显色不佳,此时可解剖游离、辨识段间静脉,以段间静脉为指引,以定位针确定切缘,完成肺段切除术。此外,右肺上叶的动脉血流相对较少,肺动脉血压较其他肺叶更低,静脉注射ICG后进入右肺上叶的药物量也相对较少,造成段间面显色不清晰,我们以纱布暂时压迫中下叶动脉,再注射ICG,使更多的血液流入右肺上叶,ICG进入右肺上叶的剂量更多,段间面显色效果明显改善。
行同一肺叶的肺段切除+楔形切除术时,如果首先行楔形切除术,静脉注射ICG后显色均不理想,染色边界扭曲不齐,可能的原因是行楔形切除术后肺组织扭曲,肺内动脉走行改变,肺动脉血流也方向随之改变,而且切割线会对解剖、打开段门的操作造成影响。我们先解剖段门结构,进行肺段切除术的操作,行ICG染色,达到良好的段间面显色效果后完成肺段切除术,再行楔形切除术,使得手术更加精准、流畅。
相对于其他胸腔镜肺段切除术,单孔胸腔镜手术创伤更小,术后疼痛更少,康复更快,而且安全可靠[8]。在单孔入路下,更需要结合术前三维重建规划适合的手术方案。本组病例均采用单孔胸腔镜术式,手术均顺利完成,患者术后恢复顺利、迅速,说明了单孔胸腔镜肺段切除术的安全性、优越性。
4结论
结合近红外荧光技术、单孔胸腔镜技术,在良好的术前三维重建规划和术前定位的指引下,可以实现精准的肺段切除术。
参考文献
[1]Bedetti B,Bertolaccini L,Rocco R,et al.Segmentectomy versus lobectomy for stage I non-small cell lung cancer:a systematic review and meta-analysis[J].Journal of Thoracic Disease,2017,9(6):1615-1623.
[2]中华医学会,中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2018版)[J].中华肿瘤杂志,2018,40(12):935.
[3]Mun M,Okumura S,Nakao M,et al.Indocyanine green fluorescence-navigated thoracoscopic anatomical segmentectomy[J].J Vis Surg,2017,3:80.
[4]Liu Z,Yang R,Shao F.Comparison of Postoperative Pain and Recovery between Single-Port and Two-Port Thoracoscopic Lobectomy for Lung Cancer[J].Thoracic&Cardiovascular Surgeon,2019,67(02):142-146.
[5]Wu WB,Xu XF,Wen W,et al.Three-dimensional computed tomography bronchography and angiography in the preoperative evaluation of thoracoscopicsegmentectomy and subsegmentectomy[J].J Thorac Dis,2016,8
(Suppl 9):S710-S715.
[6]Ito A,Takao M,Shimamoto A,et al.Prolonged intravenous indocyanine green visualization by temporary pulmonary vein clamping:real-time intraoperative fluorescence image guide for thoracoscopic anatomical segmentectomy[J].European journal of cardio-thoracic surgery:official journal of the European Association for Cardio-thoracic Surgery,2017,52(6):1225.
[7]Kasai Y,Tarumi S,Chang SS,et al.Clinical trial of new methods for identifying lung intersegmental borders using infrared thoracoscopy with indocyanine green:comparative analysis of 2-and 1-wavelength methods[J].European Journal of Cardio-thoracic Surgery,2013,44(6):1103-1107.
[8]Kim H K,Han K N.Uniportal Video-Assisted Thoracoscopic Surgery Segmentectomy[J].Thorac Surg Clin,2017,27(4):387-398.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/18918.html