[摘要]目的探讨白蛋白结合型紫杉醇联合替吉奥一线治疗晚期胃癌的效果。方法回顾性选取2022年1月—2023年6月赤峰市医院收治的100例晚期胃癌一线治疗患者的临床资料,按治疗方案不同分为观察组(50例,白蛋白结合型紫杉醇联合替吉奥治疗)与对照组(50例,奥沙利铂联合替吉奥治疗)。对比两组临床疗效、不良反应发生率、血清肿瘤标志物。结果观察组治疗有效率为64.00%(32/50)、疾病控制率88.00%(44/50)均较对照组的42.00%(21/50)、70.00%(35/50)更高,差异有统计学意义(χ2=4.858、4.883,P均<0.05)。观察组不良反应的总发生率为36.00%(18/50)低于对照组的40.00%(20/50),差异无统计学意义(χ2=0.170,P>0.05)。治疗4周期后,观察组的血清肿瘤标志物均低于对照组,差异有统计学意义(P均<0.05)。结论晚期胃癌一线治疗联用白蛋白结合型紫杉醇、替吉奥,可提高治疗效果,保障治疗安全,降低血清肿瘤标志物水平,值得临床借鉴。
[关键词]晚期胃癌,白蛋白结合型紫杉醇,替吉奥,奥沙利铂,治疗有效率,疾病控制率
胃癌是消化系统发病率与病死率极高的一种癌症[1],早期缺乏特异性症状或无症状,导致患者确诊时多已至中晚期,错失黄金治疗时机[2-3]。晚期患者根治手术效果受限,治疗方案多转向联合化疗,以控制病情进展[4]。早期诊断意识的提升,对于改善胃癌治疗效果至关重要。白蛋白结合型紫杉醇是紫杉醇类药物,可加快人体中的紫杉醇转运速度、吸收速度,提高药物利用率,有效杀伤肿瘤细胞。替吉奥是常见化疗药物,可对细胞DNA合成造成干扰,抑制肿瘤细胞的生长、繁殖,继而控制肿瘤病情。本研究旨在比较不同化疗方案的效果,现报道如下。
1资料与方法
1.1一般资料
回顾性选取2022年1月—2023年6月赤峰市医院收治的100例晚期胃癌一线治疗患者的临床资料,按治疗方案不同分为观察组与对照组,各50例。对照组中男32例、女18例;年龄53~78岁,平均(65.81±4.26)岁;病程0.5~3.5年,平均(2.08±0.51)年;肿瘤分期:Ⅲ期29例、Ⅳ期21例。观察组中男30例、女20例;年龄52~78岁,平均(65.37±4.21)岁;病程0.5~4.0年,平均(2.31±0.54)年;肿瘤分期:Ⅲ期27例、Ⅳ期23例。两组患者一般资料对比,差异无统计学意义(P均>0.05),具有可比性。本研究经赤峰市医院伦理委员会审核批准(20230212)。
1.2纳入与排除标准
纳入标准:符合《中华医学会胃癌临床诊疗指南(2021版)》中的晚期胃癌诊断标准[5];生存时间>6个月;经消化内镜及病理学等确诊;遵从医嘱按时治疗。
排除标准:对研究所用药物过敏者;伴肠道梗阻者;伴精神障碍者;伴其他恶性肿瘤者。
1.3方法
对照组使用奥沙利铂联合替吉奥治疗。奥沙利铂注射液(国药准字H20031047,规格:40 mL∶0.2 g)静脉滴注,一次130 mg/m2,1次/d,第1天用药,1周期21 d;替吉奥胶囊(国药准字H20100151,规格:25 mg)口服,一次40 mg/m2,2次/d,持续服用14 d,1周期21 d;持续治疗4周期。
观察组使用白蛋白结合型紫杉醇联合替吉奥治疗。注射用紫杉醇(白蛋白结合型)注射剂(国药准字H20183044,规格:100 mg)静脉滴注,一次125 mg/m2,持续滴注30 min,于第1天、第8天用药,1周期21 d;替吉奥胶囊应用方法、剂量、频率同对照组,1周期21 d;持续治疗4周期。
1.4观察指标
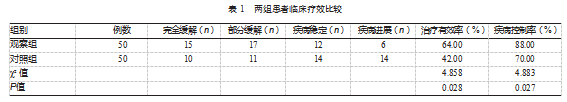
临床疗效。参考实体瘤疗效评价标准,完全缓解:肿瘤病灶消失,持续时间>1个月,无新病灶;部分缓解:肿瘤病灶缩小>30%,持续时间>1个月,无新病灶;疾病稳定:肿瘤病灶无明显缩小、无新病灶出现;疾病进展:肿瘤病灶体积增大或有新病灶出现。治疗有效率=(完全缓解例数+部分缓解例数)/总例数×100%;疾病控制率=(完全缓解例数+部分缓解例数+疾病稳定例数)/总例数×100%。
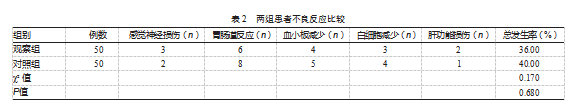
不良反应。包括感觉神经损伤、胃肠道反应、血小板减少、白细胞减少、肝功能损伤,计算不良反应发生率。
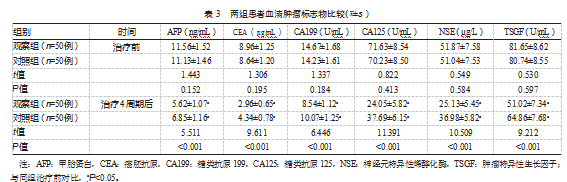
血清肿瘤标志物。包括甲胎蛋白(alpha feto protein,AFP)、癌胚抗原(carcino embryonic antigen,CEA)、糖类抗原199(carbohydrate antigen 199,CA199)、糖类抗原125(carbohydrate antigen 125,CA125)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、肿瘤特异性生长因子(tumor supplied group of factors,TSGF),于治疗前、治疗4周期后采集空腹血样5 mL,通过3 000 r/min速度持续离心15 min,采集上层血清置入全自动生化分析仪,通过酶联免疫吸附法完成检测,检测操作严格遵循说明书进行。
1.5统计方法
采用SPSS 26.0统计学软件处理数据,临床疗效、不良反应为计数资料,以例数(n)和率(%)表示,组间比较行χ2检验;血清肿瘤标志物为计量资料,经Shapiro-Wilk检验符合正态分布,以(±s)表示,组间比较行两独立样本t检验,组内比较行配对t检验,P<0.05为差异有统计学意义。
2结果
2.1两组患者临床疗效比较
观察组的治疗有效率、疾病控制率均高于对照组,差异有统计学意义(P均<0.05)。见表1。
2.2两组患者不良反应比较
观察组不良反应的总发生率(36.00%)低于对照组(40.00%),差异无统计学意义(χ2=0.170,P>0.05)。见表2。
2.3两组患者血清肿瘤标志物比较
治疗4周期后,观察组的血清肿瘤标志物均低于对照组,差异有统计学意义(P均<0.05)。见表3。
3讨论
胃癌多发于50岁以上人群,病死率较高,需临床高度重视[6-7]。随着饮食习惯变迁、生活方式调整,加之社会压力与心理因素的共同作用,胃癌发病率呈现上升趋势,且患者年轻化特征明显[8-9]。胃癌早期症状以腹部不适、嗳气等为主,与慢性胃炎症状相似度高,易被忽视[10]。疾病加重后,患者常有明显上腹痛、恶心呕吐、乏力、吞咽困难等症状,此时肿瘤细胞大多侵犯肌层,甚至损害浆膜,治疗难度显著增加[11]。晚期胃癌多采用根治性手术配合化疗治疗,手术主张切除整个病灶,同时切除可能发生浸润及侵犯的部位,清扫周围淋巴结,重建消化道。然而,术后复发和转移风险较高,五年生存率偏低[12]。为提高晚期胃癌治疗效果,临床更倾向采用联合化疗方案[13]。传统化疗药物如丝裂霉素虽有效,但其显著毒性限制了广泛应用,多数患者不耐受、不良反应较多,促使医疗界寻求更安全、更理想的替代药物[14]。替吉奥作为口服药物,凭借高生物利用度,能在肝脏转化生成5-氟尿嘧啶,其较长的半衰期确保了持续的血药浓度和强大的抗癌活性,成为晚期癌症治疗的优选[15-16]。白蛋白结合型紫杉醇利用白蛋白特性,精准靶向肿瘤细胞,无需溶剂辅助,展现出高抗肿瘤活性,有效控制肿瘤进展,为晚期胃癌患者提供更优治疗选择。
吴进兵等[17]研究指出,相较于奥沙利铂联用替吉奥治疗晚期胃癌,白蛋白结合型紫杉醇联用替吉奥治疗晚期胃癌效果更好,治疗有效率更高(80.00%VS 50.00%,P<0.05),感觉神经损伤及白细胞减少等不良反应率比较,差异无统计学意义(P>0.05)。本研究结果与上述研究一致,观察组治疗有效率64.00%较对照组42.00%更高(P<0.05),观察组不良反应率36.00%与对照组40.00%对比,差异无统计学意义(P>0.05)。文章进一步分析疾病控制率与血清肿瘤标志物,观察组疾病控制率88.00%较对照组70.00%更高(P<0.05),观察组治疗4周期后的血清肿瘤标志物水平较对照组更低(P均<0.05)。原因分析如下:AFP、CEA、CA199等是典型肿瘤标志物,在发生晚期胃癌后均有明显升高,但上述指标的升高可加重肿瘤负担,对组织细胞造成刺激,诱发细胞代谢旺盛,促进肿瘤细胞扩散转移,加快晚期胃癌疾病进展。替吉奥可与白蛋白结合型紫杉醇互相协同,进一步杀灭肿瘤细胞,有效调节肿瘤标志物水平,降低肿瘤负担,延缓晚期胃癌进展,提高治疗效果,进一步控制病情。
综上所述,替吉奥、白蛋白结合型紫杉醇联用可提高晚期胃癌一线治疗效果,保障治疗安全,改善肿瘤标志物水平,值得临床借鉴。
[参考文献]
[1]缪晓东,徐燃,曹海峰,等.用白蛋白结合型紫杉醇与溶剂型紫杉醇对HER2阴性晚期胃癌患者进行二线化疗的效果对比[J].当代医药论丛,2021,19(8):107-109.
[2]闫睿,赵敏,韩冬.脾多肽注射液联合替吉奥+顺铂方案治疗晚期胃癌的效果及对外周血γ干扰素/白细胞介素4比值、T淋巴细胞亚群水平的影响[J].广西医学,2021,43(13):1547-1552.
[3]高振远,陈娟,王雅萍,等.乌苯美司联合奥沙利铂和替吉奥治疗晚期胃癌的疗效及对患者免疫功能的影响[J].现代肿瘤医学,2021,29(11):1929-1933.
[4]杨庆伟,彭世龙,孙艳.康莱特注射液联合SOX方案(替吉奥+奥沙利铂)治疗晚期(ⅢB~Ⅳ期)胃癌患者的临床效果[J].临床医学研究与实践,2021,6(24):14-16.
[5]中华医学会肿瘤学分会,中华医学会杂志社.中华医学会胃癌临床诊疗指南(2021版)[J].中华医学杂志,2022,102(16):1169-1189.
[6]侯依辰,张璇,侯良宝.阿帕替尼联合替吉奥治疗老年晚期胃癌的近期疗效及对血清肿瘤标志物水平的影响[J].肿瘤基础与临床,2022,35(4):312-315.
[7]田红旭,陈希,牛磊萍,等.替吉奥联合奥沙利铂治疗中晚期老年胃癌的疗效及对组织中FOXP1和Ki67表达的影响[J].实用癌症杂志,2022,37(2):296-299,304.
[8]葛昕,王平安,陈媛媛.甲磺酸阿帕替尼结合替吉奥治疗晚期胃癌疗效及对患者肿瘤标志物、生存期影响研究[J].转化医学杂志,2022,11(2):105-109.
[9]刘桂举,刘盈含,杨琳,等.CYP2A6基因变异在曲妥珠单抗联合替吉奥治疗晚期胃癌中的指导价值研究[J].山西医药杂志,2021,50(10):1603-1605.
[10]胡彦辉,于卫江,耿良.养正化瘀方联合阿帕替尼、替吉奥对老年晚期胃癌患者免疫失衡、炎性因子的影响[J].世界中西医结合杂志,2022,17(7):1412-1415,1420.
[11]黄万中,刘燕文,郑薇,等.白蛋白结合型紫杉醇联合替吉奥治疗晚期胃癌术后复发的临床效果研究[J].中国肿瘤外科杂志,2021,13(4):397-400,405.
[12]李婷,马彦娥,贺双.阿帕替尼片联合奥沙利铂、替吉奥胶囊对晚期胃癌患者肿瘤标志物及CCL20、HSP70水平的影响[J].临床医学研究与实践,2023,8(17):25-28.
[13]吴国志,高诗静,徐佳,等.阿帕替尼联合替吉奥治疗晚期胃癌的临床疗效及对血清MMP-2、REGⅣ和SRF水平的影响[J].现代肿瘤医学,2022,30(11):2008-2011.
[14]谢俊杰,易峰涛,邵志雄.白蛋白结合型紫杉醇与溶剂型紫杉醇对HER2阴性晚期胃癌患者进行二线化疗的效果比较[J].临床合理用药,2023,16(7):62-64.
[15]陈静,汪海岩,田伟平.白蛋白结合型紫杉醇联合替吉奥一线治疗晚期胃癌的临床疗效[J].临床与病理杂志,2021,41(11):2568-2572.
[16]由婷,孙涛,车瑛琦,等.阿帕替尼联合替吉奥对晚期食管癌疗效及血清VEGF、VEGFR-2、bFGF水平影响[J].系统医学,2021,6(13):124-126.
[17]吴进兵,胡波,杨家梅.白蛋白结合型紫杉醇联合替吉奥与奥沙利铂联合替吉奥治疗晚期胃癌临床疗效比较[J].肿瘤基础与临床,2023,36(6):497-499.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/81941.html