【摘要】目的:探讨内镜下黏膜切除术(endoscopic mucosal resection,EMR)联合金属钛夹治疗肠息肉的临床效果。方法:回顾性选取2022年2月—2024年2月和县人民医院消化内科收治的55例接受EMR联合金属钛夹治疗的肠息肉患者作为观察组,选择同期仅接受EMR治疗的55例肠息肉患者作为对照组。比较两组手术时间及术中出血量,术后迟发性出血及术后出血量,术前及出院前血红蛋白(Hb),并发症。结果:两组手术时间、术中出血量比较,差异无统计学意义(P>0.05)。观察组术后迟发性出血率及术后出血量均显著低于对照组,差异有统计学意义(P<0.05)。出院前,对照组Hb水平低于术前,观察组Hb水平高于对照组,差异有统计学意义(P<0.05)。两组术后并发症发生率比较,差异无统计学意义(P>0.05)。结论:EMR联合金属钛夹能够降低肠息肉患者术后迟发性出血发生率,减少出血量,具有较好的临床治疗效果及安全性。
【关键词】内镜下黏膜切除术,金属钛夹,肠息肉,临床效果,安全性
肠息肉是指肠黏膜表面的隆起样病变,其发生率随年龄增加而上升,男性较为多见,主要分为炎症性和腺瘤性两种[1]。其中炎症性息肉在炎症治愈后可自行消失,而腺瘤性息肉一般不会自行消失,并且有恶变倾向[2]。目前,临床已知影响肠息肉的诱发因素较多,包括年龄、生活习惯、代谢因素、幽门螺杆菌感染等[3]。学者指出,高脂低纤维饮食、吸烟、酗酒、肥胖和缺乏运动等生活习惯是息肉发生发展的危险因素;而代谢因素如尿酸高、糖尿病等也与肠息肉发病有关[4]。近年来,随着分子生物学认识的加深,遗传因素和基因突变也被证实参与肠息肉的发生发展,尤其是家族性腺瘤性息肉病等[5]。观察可知,多数患者无明显临床症状,部分患者存在腹部胀痛、排便习惯改变甚至便血等症状,极少部分患者有进展至结肠恶性肿瘤风险,临床危害较大,因次,及时干预及治疗肠息肉是消化内科医生关注的重点。当前,肠息肉治疗的最常见方法是通过电子肠镜下手术治疗,首先内镜下精确定位息肉位置,而后进行电凝电切[6]。其中内镜黏膜切除术(endoscopic mucosal resection,EMR)是目前临床广泛应用于消化道肿物切除治疗的手术方式,其能够完整切除病变黏膜,保证送检病理标本的完整性,有明确的检查及治疗等双重作用,具备创伤小且愈合快、手术时间短、费用低等临床优势[7-8]。学者指出,EMR的治疗原理主要为内镜下通过高频电刀和辅助设备,将整块黏膜病变完整切除,视野清晰且操作简单,对患者正常消化道结构影响较小,能够显著缩短手术时间及治疗费用,适用于各类消化道疾病的早诊、早治,对于降低疾病复发率也有重要价值[8]。目前,EMR已成为治疗胃肠道息肉的首选方案,但其作为侵入性操作导致患者生理及心理不适感的风险仍然较高[9]。尤其是术中及术后出血风险不容临床忽视。针对EMR术后迟发性出血发生率较高等问题,联合金属钛夹夹闭切口可能是降低术后迟发性出血的有益举措,有利于改善患者临床预后,降低治疗并发症,现报道如下。
1资料与方法
1.1一般资料
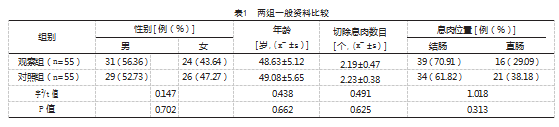
回顾性选取2022年2月—2024年2月和县人民医院消化内科收治的55例接受EMR联合金属钛夹治疗的肠息肉患者作为观察组,同时选择同期仅接受EMR治疗的55例肠息肉患者作为对照组。纳入标准:(1)内镜下明确诊断为肠息肉,且术后病理检查证实为肠息肉;(2)均符合EMR的绝对或相对适应证;(3)临床资料完整;(4)肠息肉直径2 cm。排除标准:(1)合并其他类型的肠道病变,包括但不限于溃疡性结肠炎、肠结核;(2)近6个月内存在消化道出血;(3)近3个月内接受过内镜下消化道息肉摘除术;(4)合并其他肠道恶性病变;(5)存在其他系统肿瘤合并消化道远处转移;(6)意识障碍或认知障碍无法配合本研究;(7)合并严重心肺疾病及肝肾功能不全。观察组年龄31~72岁。对照组年龄29~71岁。两组一般资料比较,差异无统计学意义(P>0.05),有可比性,见表1。患者及家属对本次入院治疗方案知情同意,本研究经本院医学伦理委员会已审批通过。
1.2方法
两组患者在院期间药物治疗方案相同,病情允许情况下停用抗血小板或抗凝药物;术前均完善凝血机制、血常规、血生化、传染指标等检查,评估心肺功能,排除手术禁忌证。术前12 h禁食,4 h禁饮,开放静脉通路;术后均禁食后逐步过渡至正常饮食。
1.2.1观察组给予EMR联合金属钛夹治疗。具体步骤如下:经结肠镜探查明确肠息肉位置及个数,于黏膜下注射肾上腺素加生理盐水(1∶10 000),在肠息肉基底部位周围选择2~3个注射点,观察病变部位及周围黏膜病灶充分隆起后以圈套器套住息肉,向肠腔中提起圈套器,而后通过高频电凝电刀切除息肉,如病变较大则分次切除。术后常规进行创面止血,切除黏膜表面少量渗血则喷洒0.8%去甲肾上腺素后给予钛夹夹闭创面止血。切除息肉病理组织通过圈套器随内镜取出,送病理科进行组织病理学检查。
1.2.2对照组给予EMR。操作步骤同观察组。切口表面喷洒0.8%去甲肾上腺素后观察无出血退镜结束治疗。
1.3观察指标及评价标准
(1)手术时间及术中出血量:记录两组手术时间。手术时间:操作开始至内镜撤除时间。(2)术后迟发性出血及术后出血量:记录两组术后迟发性出血及术后出血量。迟发性出血:EMR术后患者出现便血,红细胞计数及血红蛋白下降,进行肠镜检查可见息肉切除部位有活动出血,需进行二次肠镜下止血治疗[10]。(3)血红蛋白(Hb):比较两组术前及出院前Hb。分别于术前及出院前抽取患者静脉血检测两组患者Hb水平。(4)并发症:记录两组术后并发症。包括消化道症状(腹胀、反酸、嗳气、腹痛)、穿孔及感染等。
1.4统计学处理
本研究数据采用SPSS 25.0统计学软件进行分析和处理,计量资料以(x-±s)表示,组内比较采用配对样本t检验,组间比较采用独立样本t检验,计数资料以率(%)表示,采用字2检验,以P<0.05为差异有统计学意义。
2结果
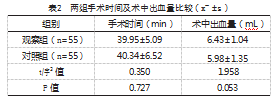
2.1两组手术时间及术中出血量比较
两组手术时间、术中出血量比较,差异无统计学意义(P>0.05),见表2。
2.2两组术后迟发性出血及术后出血量比较
观察组术后迟发性出血2例,对照组术后迟发性出血7例,两组术后迟发性出血发生率比较,差异无统计学意义(字2=2.998,P=0.083);对照组术后迟发性出血患者术后出血量为(7.54±1.29)mL,显著高于观察组的(4.03±0.87)mL,差异有统计学意义(t=16.730,P<0.01)。
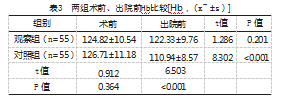
2.3两组术前、出院前Hb比较
术前,两组Hb水平比较,差异无统计学意义(P>0.05);出院前,对照组Hb水平低于术前,观察组Hb水平高于对照组,差异有统计学意义(P<0.05),见表3。
2.4两组并发症比较
两组术后并发症发生率比较,差异无统计学意义(P>0.05),见表4。
3讨论
肠息肉是消化系统较为常见良性疾病之一,其发病诱因多样且有转化为恶性肿瘤的风险,临床早诊早治较为关键,目前电子结肠镜已成为肠息肉诊断及治疗的主要手段,一方面其能精准定位肠息肉位置,另一方面内镜下肠息肉直接摘除是当前治疗肠息肉的主要手段。近年来,随着医疗技术的不断进步和完善,EMR在肠息肉的治疗中应用愈加广泛。这种治疗方法结合了电凝切除和黏膜下注射的优势,具备安全可靠、微创等诸多优点。相比传统内镜下电凝切除术,EMR对机体炎症反应的刺激更小,术后外周血中炎症因子表达水平也更低,同时在治疗费用上并不高,为患者提供了更加便捷、有效的治疗选择[11-12],其具有安全可靠、微创的特点,能够有效治疗肠道疾病,减少对患者的身体和心理造成的影响,为患者提供了更加优质的医疗服务,具备较高的临床应用价值。但是随着该技术在临床的逐步普及,学者发现,EMR切除肠息肉术后存在迟发性出血风险较高等局限性,影响患者术后疾病恢复,甚至需要二次内镜下止血[13]。基于此,临床医生多采取EMR联合金属钛夹用于术后止血,有效降低出血量及术后迟发性出血发生率[14]。
本研究发现,两组患者临床基本资料具有可比性,因此可以忽略患者自身因素及肠息肉疾病因素所致术后出血高风险。笔者及其团队通过比较术中相关指标发现,由于EMR电凝止血的疗效确切,两组患者术中出血量相当,且EMR联合金属钛夹并未增加手术时间,说明EMR联合金属钛夹操作简单,未显著增加临床医生工作量。
后续观察可知,EMR联合金属钛夹能够降低肠息肉手术患者术后迟发性出血风险率,减少术后出血量,这得益于金属钛夹对手术创面的有效止血,能够降低二次出血风险,减少手术创伤,临床疗效确切。更为重要的是,本研究观察了两组患者术后并发症发生情况,这是既往研究未关注的问题,分析可知观察组术后并发症发生率为0,对照组术后并发症发生率为3.63%,观察组术后并发症发生率与对照组比较无显著差异,说明EMR联合金属钛夹在肠息肉的治疗中未增加并发症。但是,也有学者指出,针对结直肠良性病变患者,可以选择性的使用金属钛夹,创面范围广并累及固有肌层的患者更适用于EMR联合金属钛夹,一方面减少术后出血的发生率,另一方面减少医疗耗材的应用,降低患者经济负担[15]。笔者认为,后续仍需开展相关研究进一步探讨金属钛夹的适用疾病人群,指导临床精准治疗。
综上所述,EMR联合金属钛夹能够降低肠息肉患者术后迟发性出血发生率,减少出血量,具有较好的临床治疗效果及安全性。
参考文献
[1]徐梅香,刘有理,彭德清,等.术后早期含服糖果对内镜下肠息肉切除患者不良反应及舒适度和满意度的影响[J].河北医药,2023,45(3):420-422,426.
[2]BOZORG S R,SONG M Y,EMILSSON L,et al.Validation of serrated polyps(SPs)in Swedish pathology registers[J].BMC Gastroenterol,2019,20(1):3.
[3]侯运萌,李海,王李安,等.结肠息肉与幽门螺杆菌感染及胃息肉的关系[J].中国内镜杂志,2023,29(3):73-80.
[4]牛天阳,齐玲芝.结直肠息肉与2型糖尿病临床特点的相关性[J].吉林医学,2023,44(11):3152-3155.
[5]张雪花.CYP24A1基因多态性与结直肠息肉和结直肠癌的相关性研究[J].医学检验与临床,2023,34(2):8-11.
[6]OCHIAI Y,INOSHITA N,IIZUKAT,et al.Clinicopathological features of colorectal polyps and risk of colorectal cancer in acromegaly[J].Eur Endocrinol,2020,182(3):313-318.
[7]纪筠,徐绿燕.内镜下黏膜切除术(EMR)治疗结肠息肉的护理配合分析[J].中国医药指南,2023,21(18):5-8.
[8]段红良,赵红梅,辛建锋,等.内镜下黏膜切除术与黏膜下剥离术治疗早期直肠癌的疗效观察[J].中国肿瘤临床与康复,2022,29(7):798-801.
[9]朱慧新,高艳,刘谷婕.内镜下黏膜切除术治疗胃息肉的护理研究[J].吉林医学,2020,41(10):2524-2526.
[10]闫媛,庄坤,左利平,等.金属钛夹在降低结肠息肉内镜下黏膜切除术后出血发生率中的作用[J].临床医学研究与实践,2018,3(4):15-16.
[11]华婷琰,华娴,闵寒,等.内镜下黏膜切除术治疗胃息肉的疗效及对血清ProGRP、PGI水平的影响[J].现代生物医学进展,2023,23(9):1731-1735.
[12]孙建明,高元平,郝卫刚,等.内镜下黏膜切除术治疗胃肠道息肉对患者红细胞免疫功能、炎性因子的影响分析[J].现代消化及介入诊疗,2019,24(10):1146-1149.
[13]植中敬.探讨EMR联合金属钛夹治疗肠息肉的效果[J].中国实用医药,2021,16(31):47-49.
[14]竺添雨,孔弘伟,殷清华,等.无痛电子肠镜下内镜黏膜切除术联合金属钛夹治疗肠息肉的效果[J].中外医学研究,2020,18(16):144-146.
[15]张帆.内镜下黏膜切除术部分联合金属钛夹治疗结直肠腺瘤的效果观察[J].中国医疗器械信息,2020,26(2):163-164.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/81511.html