摘要:目的分析无锡市女性人乳头瘤病毒感染的现状及年龄分布特点。方法选取2021年1月1日—2022年12月31日在本院接受人乳头瘤病毒(HPV)筛查的23343例女性作为研究样本,采用实时定量荧光PCR技术对患者宫颈脱落细胞进行提取与分析,进行HPV基因分型检测。结果23343例妇女HPV的总感染率为20.86%(4868/23343),高危型感染率为5.33%(1243/23343),多重复合感染率为2.18%(509/23343)。HPV总阳性检出率与年龄相关,相较于<60岁的女性,年龄≥60岁的女性的检出率更高(P<0.05),各年龄组间多重感染阳性检出率差异有统计学意义(P<0.05)。结论在无锡市,女性的感染存在多样性,多种感染混杂,但总体上来说,仍以老龄感染、低危型感染、单一感染为主。该地区医疗部门应充分重视HPV的筛查,加强对HPV常见亚型的监测,加大对育龄和老年女性HPV相关知识的宣传力度,提高HPV感染防范相关知识普及度,以加强宫颈癌的预防和早期发现。
关键词:人乳头瘤病毒,感染,年龄
0引言
宫颈癌是严重威胁妇女健康的恶性肿瘤。每年大约有50万的宫颈癌新发病例,其中80%的病例发生在发展中国家,发病率和病死率呈上升趋势,且呈年轻化趋势[1-2]。目前已知的人乳头瘤病毒感染(HPV)亚型达100多种,根据危害程度又可分为高危型和低危型[3]。随着流行病学研究的深入,最终证实高危型HPV是宫颈癌发生的主要因素之一[4]。为了解无锡市女性HPV感染现状,本研究对2021年1月1日—2022年12月31日在本院进行HPV筛查的23343例女性的HPV检测结果进行回顾性分析,为该地区HPV的筛查和防治提供一个参考。
1资料与方法
1.1一般资料
选取2021年1月1日—2022年12月31日在本院接受人乳头瘤病毒(HPV)筛查的23343例女性作为研究样本。患者年龄为17~85岁,平均(39.16±5.62)岁。纳入标准:①长期居住于无锡地区;②检测前未处于妊娠期或月经期;③知情且同意参与者;④受测前1d未进行性生活者;⑤受测前3d内未使用影响检测结果的药物者。本研究符合伦理学标准。
1.2试剂和仪器
核酸检测试剂盒,Linegene9660 PCR仪(无锡市申瑞生物制品有限公司),Thermo Micro21R高速离心机(美国赛默飞公司)
1.3检测方法
1.3.1标本采集和处理
在进行相关检测时,务必确保将检测者的子宫颈充分暴露,并清除宫颈口处的分泌物,以确保检测结果的准确性和可靠性。之后使用HPV宫颈刷沿宫颈口旋转3~5圈采集上皮细胞样品,最后将采集到的样品放置于保存液中,在样品管上贴好标签后立即送检,对于不能立刻进行检验的样品,放置于冰箱内保存,温度设置在4℃。
1.3.2 HPV检测
DNA的提取和扩增采用申瑞生物制品有限公司HPV试剂盒,基因分型检测用Linegene9660 PCR仪进行。采用核酸扩增(PCR)荧光检测法,根据高危型HPV的全基因组序列设计高度特异的引物和荧光探针,能在同一PCR反应中检测宫颈口脱落细胞中的14种高危型(HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68)的脱氧核糖核酸(DNA)。
1.4统计学方法
以SPSS 22.0进行分析,计数资料以例数或百分率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2结果
2.1 HPV感染的年龄分布
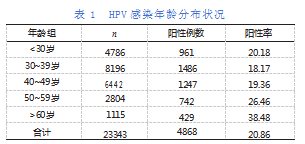
一般人口学资料如下:23343名研究对象中,<30岁4786例(占20.5%)、30~39岁8196例(占35.11%)、40~49岁6442例(占27.6%),50~59岁2804例(占12.01%),60岁以上1115例(占4.78%),平均年龄(39.16±5.62)岁。HPV的总感染率为20.86%(4868/23343)。详见表1。
2.2 HPV感染状况和基因型分布
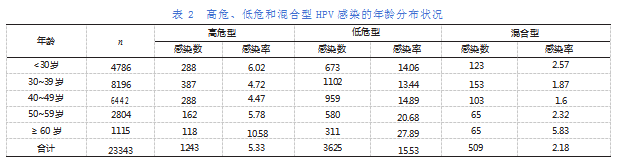
HPV高危型感染率5.33%(1243/23343),HPV低危型的感染率为15.53%(3625/23343),高危型及低危型合并感染率为2.18%(509/23343),三类HPV感染类型与年龄有关,不同年龄段的HPV感染情况不同。HPV高危型中,≥60岁组的感染率明显高于其他组(P<0.05)。年龄段与高危型感染率呈“U”型分布。且无论哪种类型的感染,在50岁之后的感染率均上升,且≥60岁组的感染率与其他组相比,差异有统计学意义(P<0.05)。详见表2。
3讨论
宫颈癌是一种常见的妇科恶性肿瘤,仅次于乳腺癌,十分不利于女性的生活质量和身体健康。流行病学已证实高危型人乳头瘤病毒的持续或反复感染是女性宫颈癌及其癌前病变发生的关键因素之一[5-6]。目前,HPV亚型鉴定已超过120种,不同亚型引起的病变也不同,依据HPV致病性的危险程度不同分为高危型和低危型。高危型持续感染是女性宫颈癌发病的重要因素,它不仅会使得患者体内肿瘤标志物显著增加,还会破坏免疫应答,促进宫颈癌进展,常与宫颈、阴道、外阴、肛门、阴茎、口咽等部位恶性肿瘤发生密切相关,低危型HPV与生殖器疣和寻常疣等皮肤良性病变相关[7-8]。
HPV的感染率与宫颈癌发病风险联系紧密,较高的HPV高感染率会使得宫颈癌风险显著增加,同时,HPV的感染率还与年龄息息相关,年龄越大的患者HPV感染率越高,尤其是≥60岁的女性,这可能与女性进入绝经期后自身免疫力下降及阴道微生态变化有关,细菌性阴道病、外阴阴道假丝酵母菌病等均是HPV感染的高危因素[9]。因此,应做好≥60岁女性的HPV防治宣教工作,加大筛查力度。由于不同亚型HPV的基因变异很大,基本没有交叉保护性抗体,因此极易出现反复感染或多重感染。有研究发现,相较于单一HPV感染,HPV多重感染女性的宫颈癌患病风险更高[10]。并且,年龄较大的女性,感染多重HPV的概率越高。
综上所述,无锡市女性的感染存在多样性,多种感染混杂,但总体上来说,仍以老龄感染、低危型感染、单一感染为主。该地区医疗部门应充分重视HPV的筛查,加强对HPV常见亚型的监测,加大对育龄和老年女性HPV相关知识的宣传力度,提高HPV感染防范相关知识普及度,以加强宫颈癌的预防和早期发现。
参考文献
[1]沈洁,高丽丽,张月,等.北京市宫颈癌筛查妇女中高危型HPV感染状况及在宫颈癌前病变中的分布[J].中华预防医学杂志,2018,52(5):493-497.
[2]袁新华,潘丽,吴玉,等.宫颈癌筛查方法探讨[J].江苏卫生保健,2008,10(4):40-41.
[3]乔友林.中国妇女人乳头瘤病毒感染和子宫颈癌的流行病学研究现状及其疫苗预防前景[J].中华流行病学杂志,2007,28(10):937-940.
[4]廖秦平.宫颈癌病因学研究新进展[J].中国妇产科临床杂志,2003,4(4):243-245.
[5]李永川,徐含青,赵娜,等.重庆地区32882例女性宫颈人乳头瘤病毒的感染状况调查[J].第三军医大学学报,2016,38(9):1031-1034.
[6]马会清,魏晓强,唐猛.508例女性人乳头瘤病毒感染及相关因素分析[J].中华妇幼临床医学杂志(电子版),2012,8(4):361-363.
[7]杨与柔,柳欣林,王大宁,等.人乳头瘤病毒中和表位及抗体中和作用机制的研究进展[J].病毒学报,2019,35(1):174-180.
[8]陶祥,郑宝文,赵澄泉.子宫颈细胞学和高危型人乳头瘤病毒感染多中心临床资料分析[J].中国妇产科临床杂志,2018(2):187-189.
[9]吴晓燕,许继芹,朱立梅,等.阴道微生态与高危型人乳头瘤病毒感染对老年宫颈病变患者的影响及其关系[J].中国老年学,2017(23):5932.
[10]梅洁,汪玲玲,王丹菡,等.人乳头瘤病毒多重感染与宫颈癌的临床特征[J].中华医院感染学杂志,2017,27 (24):5660.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/80450.html