SCI论文(www.lunwensci.com)
【摘要】目的 探讨利拉鲁肽对高糖环境下牙周膜成纤维细胞(PDLF )凋亡的影响,为糖尿病合并牙周疾病的治疗提供依据。方 法 选取 2019 年 12 月广州医科大学附属惠州医院接受正畸治疗需拔出的前磨牙的 5 名志愿者, 取牙周膜组织标本, 体外培养 PDLF ,根 据培养液成分设置为低糖对照组(5.5 mmol/L 葡萄糖) 、高糖组(25 mmol/L 葡萄糖) 、低糖给药组(5.5 mmol/L 葡萄糖 +1× 10-7 mmol/L 的利拉鲁肽) 及高糖给药组(25 mmol/L 葡萄糖 +1× 10-7 mmol/L 的利拉鲁肽) 。应用流式细胞仪测定细胞凋亡情况;采用Western Blot 法 测定牙周膜成纤维细胞中 B 细胞淋巴瘤 -2 基因(Bcl-2)、Bcl-2相关 X 蛋白(Bax )表达水平;采用酶联免疫吸附法检测 PDLF 悬液炎症 因子肿瘤坏死因子 -α(TNF-α ) 、白细胞介素 -1β(IL-1β) 、白细胞介素 -6(IL-6 )、C- 反应蛋白(CRP )的表达。结果 低糖对照组、 低糖给药组、高糖对照组和高糖给药组细胞凋亡率分别为( 4.97±0.15 )%、(3.07±0.12 )%、( 11.33±1.10 )%、(5.87±0.49 )% 。 与低糖对照组比,高糖对照组细胞凋亡率显著升高;且低、高糖给药组凋亡率显著低于低、高糖对照组;低糖对照组的 Bax 蛋白相对表 达量低于高糖对照组,Bcl-2 蛋白相对表达量高于高糖对照组;低、高糖给药组 Bax 蛋白相对表达量分别低于低、高糖对照组,低糖给 药组均低于高糖给药组;Bcl-2 蛋白相对表达量分别高于低、高糖对照组,低糖给药组均高于高糖给药组;低糖对照组细胞中 TNF-α 、 IL-1β 、IL-6 、CRP 水平低于高糖对照组;低、高糖给药组细胞中炎症因子水平分别低于低、高糖对照组,且低糖给药组低于高糖给药组 (均 P<0.05 )。结论 利拉鲁肽能够抑制高糖诱导的 PDLF 凋亡,调控 Bax/Bcl-2表达,降低炎症反应,可促进牙周组织愈合修复。
牙周病是一种常见的口腔疾病,主要因牙菌斑内细 菌及代谢产物破坏牙周支持组织,导致牙龈炎症或出血、 牙齿松动的病症,严重者可引起牙齿移位或脱落。牙周 膜成纤维细胞(PDLF)是牙周组织中一种重要的多能细 胞,通过不断生长分化形成新的纤维和牙骨质,参与牙周 组织的修复过程,对维持牙周膜完整性具有至关重要的 作用 [1] 。有多项研究显示,高血糖会刺激 PDLF 产生炎症 因子,促进细胞凋亡,加剧牙周组织的破坏,进而诱发 牙周疾病 [2-3]。糖尿病合并牙周疾病患者, 当血糖状况得 到有效控制后,配合牙周局部基础治疗,牙周病变会明显 好转,但在实际临床上,部分患者血糖控制不佳,牙周基 础治疗无法顺利开展,因此,研究高糖环境下牙周损伤 的修复具有重要意义。利拉鲁肽属于胰高血糖素样肽 -1 (GLP-1)类似物,主要用于二甲双胍或磺脲类药物控制不 佳的糖尿病患者的治疗。有报道称,利拉鲁肽能够降低血 糖、减轻炎症反应、改善心血管功能 [4] ,但其对糖尿病合 并牙周疾病的影响报道较少。基于此,本研究通过体外培养人牙周膜成纤维细胞,观察利拉鲁肽对高糖环境下细胞 凋亡及炎症因子的影响,探讨利拉鲁肽对糖尿病合并牙周 疾病的保护机制,为糖尿病合并牙周疾病的治疗提供依据, 现报道如下。
1 材料与方法
1.1主要实验材料 利拉鲁肽注射液(丹麦诺和诺德公 司,国药准字 J20160037.规格: 3 mL ∶ 18 mg ),DMEM 培养基(美国 Gibco 公司),胎牛血清(美国 Gibco 公 司),胰酶(美国 Sigma 公司),碘化丙啶(PI)染液 (美国 BD 公司),Matrigel 胶(美国 BD 公司),磷酸盐 (PBS)溶液(武汉赛维尔生物科技有限公司),流式细胞 仪(美国 BD 公司,型号:FACSCanto),二氧化碳(CO2 ) 培养箱(深圳市瑞沃德公司,型号:CIB-191C),台式低 速离心机(湖南湘仪实验室仪器有限公司,型号:L 500), 倒置荧光显微镜(广州微域光学仪器有限公司,型号: WSF-1600 )。
1.2原代细胞培养 牙周膜组织标本来源于口腔科,选 取 2019 年 12 月广州医科大学附属惠州医院接受正畸治疗 需拔出的前磨牙的 5 名志愿者。纳入标准:①年龄≥ 18 岁;②牙周健康,无龋齿、牙体缺损或牙髓疾病;③无 基础病史,近 3个月内未服用过激素或影响血糖的药物; ④对研究知情并签署知情同意书。患牙拔出后用含有双抗 的 PBS 缓冲液反复冲洗,在无菌条件下锐性刮取牙根中 部 1/3 处牙周膜组织。将获取的牙周膜组织标本用含庆大 霉素 PBS 液反复冲洗,然后剪成 1 mm3 大小的组织块铺 于细胞培养皿中,加入含有 10% 胎牛血清、200 U/mL 庆 大霉素、100 U/mL 青霉素的 DMEM 培养液 3 mL,置于 CO2 孵箱中 37 ℃ 下培养,每 3 d 换液 1 次,待细胞生长 至 80% 时,加入胰蛋白酶消化并传代培养。取第 4 代细 胞做细胞爬片,通过二氨基联苯胺(DAB)染色观察细胞 形态学结构,鉴定细胞。
1.3细胞分组 取第 5 代牙周膜成纤维细胞进行实验观 察,以 2 × 103 个 / 孔的细胞密度进行接种。根据培养液 成分分组:低糖对照组(含 5.5 mmol/L 葡萄糖的 DMEM 培养基)、高糖组(含 25 mmol/L 葡萄糖的 DMEM 培 养基)、低糖给药组(1 × 10-7 mmol/L 的利拉鲁肽 + 含5.5 mmol/L 葡萄糖的 DMEM 培养基)和高糖给药组 ( 1 × 10-7 mmol/L 的利拉鲁肽 + 含 25 mmol/L 葡萄糖的 DMEM 培养基)。
1.4流式细胞仪检测 取 1.3 中各组培养 72 h 的牙周膜 成纤维细胞,采用胰蛋白酶消化,PBS 漂洗 2 遍,离心弃 上清。加入 100 μL 标记溶液重悬细胞,避光孵育 15 min, 离心收集细胞,PBS 洗涤 1 次。加入 AnnexinV 和 PI 在 37 ℃ 下避光染色 15 min,然后上机检测细胞凋亡率。
1.5 Westerrn-blot检测 取 1.3 中各组培养 72 h 的牙周 膜成纤维细胞,提取全蛋白,按照 BCA 蛋白定量试剂盒 测定蛋白浓度。上样 50 mg 蛋白进行电泳分离,然后转 至聚偏二氟乙烯(PVDF)膜上,再加入 B 细胞淋巴瘤 -2 基因(Bcl-2 )、Bcl-2 相关 X 蛋白(Bax)抗体,4 ℃ 孵育 过夜,TBST 漂洗 3 次,加入羊抗兔二抗,常温孵育 2 h, TBST 漂洗 3 次,然后在 Tanon 600 图像分析系统中显色 分析。
1.6酶联免疫吸附法检测细胞炎症因子 收集 1.3 中各组 培养 24、48、72 h 时的细胞上清液,取 500 μL 置于洁净 EP 管中。采用酶联免疫吸附法测定细胞上清液中肿瘤坏死因 子 - α(TNF-α )、白细胞介素 -1β(IL-1β)、白细胞介素 -6 (IL-6 )、C- 反应蛋白(CRP)水平。
1.7统计学方法 采用 SPSS 21.0 统计学软件分析数据, 计量资料经 S-W 法检验证实符合正态分布,以 (x ±s) 表 示,多组比较用单因素方差分析,组间两两比较用 LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1人牙周膜成纤维细胞形态与鉴定 培养 8~10 d 后, 人牙周膜成纤维细胞脱离组织块向外延伸,细胞呈星形或 长梭形,交织成为网状;随着培养时间延长,细胞以组织 块为中心放射状生长,约 3 周后,细胞长满培养皿内壁, 密度明显增加,长梭形细胞比例升高,少数呈不规则星 形。免疫组化检测可见波形蛋白染色阳性,细胞角蛋白染 色阴性,说明该细胞来源于中胚层间充质细胞,与实验要 求一致,见图 1.
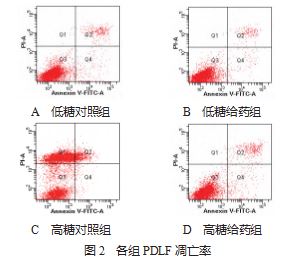
2.2细胞凋亡率 低糖对照组、低糖给药组、高糖对 照组和高糖给药组细胞凋亡率分别为(4.97±0.15 )%、 (3.07±0.12 )%、( 11.33±1.10 )%、(5.87±0.49 )%。与低糖 对照组比,高糖对照组细胞凋亡率显著升高;且低、高糖 给药组凋亡率显著低于低、高糖对照组,差异均有统计学 意义(均P<0.05),见图 2.
2.3各组 PDLF中 Bax、Bcl-2蛋白表达情况 低糖对照 组的 Bax 蛋白相对表达量低于高糖对照组,Bcl-2 蛋白相对 表达量高于高糖对照组;低、高糖给药组 PDLF 中 Bax 蛋 白相对表达量分别低于低、高糖对照组,且低糖给药组均 低于高糖给药组;Bcl-2 蛋白相对表达量分别高于低、高糖 对照组,且低糖给药组均高于高糖给药组,差异均有统计 学意义(均P<0.05),见图 3、表 1.
2.4各组细胞培养液中炎症因子表达 低糖对照组细胞 中 TNF-α、IL-1β、IL-6、CRP 水平低于高糖对照组;低、高糖给药组细胞中炎症因子水平分别低于低、高糖对照组, 且低糖给药组低于高糖给药组,差异均有统计学意义(均 P<0.05),见表 2.
3 讨论
PDLF 是一种牙周组织中最具代表性的细胞,能够促 进胶原纤维、胞外基质的合成,参与牙周组织的病变、修 复及再生过程。糖尿病性牙周病变的发病机制复杂,本研 究从 PDLF 凋亡角度出发,分析不同环境下 PDLF 的生理 学活性,为糖尿病合并牙周病变的预防和治疗提供理论依 据。本研究结果显示, 与低糖对照组比, 高糖对照组 PDLF 凋亡率显著升高,提示高糖环境促进细胞的凋亡,从而促 进牙周疾病的发生及发展。究其原因,在高糖环境下,细 胞会产生过多的细胞内活性氧,能够诱导脂质过氧化,引 发细胞膜完整性丧失,线粒体膜去极化,凋亡信号通路激 活,最终导致细胞凋亡。
Bcl-2 基因是目前已知的与细胞凋亡存在密切关系的 重要基因,Bax 与 Bcl-2 蛋白共同参与细胞凋亡的调节过 程。 Bcl-2 是一种原癌基因,能在不影响细胞增殖的前提 下延长细胞凋亡时间,发挥抗细胞凋亡的作用。Bax 则属 于促凋亡因子,通过抑制 Bcl-2 活性,促进细胞的凋亡。 Bcl-2/Bax 比值与细胞凋亡速率有关, 其比值升高说明细胞凋亡减弱, 而Bcl-2/Bax 比值下降则表示细胞凋亡增强 [5] 。 本研究中, 高糖对照组细胞培养 48 h 后 Bax 蛋白相对表达 量高于低糖对照组,Bcl-2 蛋白相对表达量低于低糖对照组,说明高糖环境下 PDLF凋亡速度更快;而高糖给药组 细胞 Bax 蛋白相对表达量低于低糖对照组,Bcl-2 蛋白相 对表达量高于高糖对照组, 提示利拉鲁肽能调节 Bcl-2/Bax 的表达,抑制 PDLF 凋亡,促进牙周疾病的恢复。究其原 因,利拉鲁肽属于胰高血糖素样肽类似物, 通过与组织/ 细 胞上胰高血糖素样肽受体结合,刺激胰岛素的分泌,降低 血糖水平;另外,高糖环境下细胞活力、活性氧活性均降 低,而利拉鲁肽能够降低高糖诱导的肾小管上皮细胞的凋 亡,促进细胞活力,浓度越高,作用效果越明显 [6]。

糖尿病与牙周疾病属于双相促进关系,且均以炎症反 应为桥梁[7]。糖尿病患者机体处于亚临床炎症状态,TNF-α、 IL-1β、IL-6、CRP 等炎症因子表达升高, 导致牙周组织出现 炎症反应,加快牙槽骨及周围软组织病变,限制牙周组织的 修复,逐渐发展成为牙周疾病[8] ;另外,牙周疾病也会介导 局部炎症反应,炎症因子可通过血液循环到达远隔部位,激 发全身性炎症反应, 影响胰岛细胞功能, 造成代谢紊乱, 从 而加重糖尿病病情[9]。有研究表明,糖尿病合并牙周疾病患 者牙周组织中 IL-1β、IL-6 等炎症介质释放显著增加 [10],因 此抑制炎症反应对糖尿病及牙周疾病的治疗至关重要。本 研究中, 高糖对照组细胞培养液中炎症因子TNF-α、IL-1β、 IL-6、CRP 水平均显著高于低糖对照组,证实高糖环境能诱 导牙周细胞发生炎症反应,从而促进牙周疾患的发生及发 展。另外, 本研究发现, 高糖给药组细胞培养液中 TNF-α、 IL-1β 、IL-6、CRP 水平均低于高糖对照组, 说明利拉鲁肽 能降低糖尿病牙周微环境的炎症反应,抑制炎症因子的释 放,减轻局部炎症对牙周组织的破坏。分析原因可能为, 利拉鲁肽的干预能够明显抑制高糖所诱导的炎症单核细胞 亚群分化,且可减少炎症单核细胞内活性氧的生成,从而 抑制炎症反应 [11]。
综上, 利拉鲁肽能通过降低炎症反应和调节Bcl-2/Bax 的表达,抑制高糖环境下 PDLF 凋亡,促进牙周健康,为 糖尿病合并牙周疾病的治疗提供理论依据,这可能是一种 潜在的延缓糖尿病患者并发牙周疾病的防治策略。
参考文献
[1] 李银科 , 史琼枝 , 陈晨 , 等 . 利拉鲁肽对缺氧和高糖所致心肌细 胞钙超载和细胞凋亡的影响 [J]. 武警医学 , 2017. 28(7): 678-682.
[2] CHOI S E, SIMA C, PANDYA A. Impact of treating oral disease on preventing vascular diseases: a model-based cost-effectiveness analysis of periodontal treatment among patients with type 2 diabetes[J]. Diabetes Care, 2020. 43(3): 563-571.
[3] 俞梅 , 李娜 , 喻锦娴 , 等 . 牙龈卟啉单胞菌脂多糖通过 TXNIP/ Nlrp3 炎性通路对小鼠牙周膜成纤维细胞迁移的影响 [J].现代生 物医学进展 , 2022. 22(5): 832-836. 862.
[4] 杨泽麟 , 荣曦 , 刘红 . 基于 TLR4 信号通路研究利拉鲁肽对脂多 糖诱导的原代小胶质细胞炎症反应的作用机制 [J]. 广西医科大 学学报 , 2022. 39(4): 547-551.
[5] 毛拓华 , 刘丹 , 李竞 , 等 . 利拉鲁肽通过 p38 丝裂原活化蛋白激 酶和c-Jun 氨基末端激酶通路抑制高糖培养的H9c2 细胞凋亡 [J]. 临床内科杂志 , 2017. 34(10): 699-702.
[6] 刘惠莉, 王一丹, 岳阳丽, 等. 骨膜素通过p38 MAPK 信号通路抑 制缺氧诱导的人牙周膜成纤维细胞的氧化应激和细胞凋亡 [J]. 南方医科大学学报 , 2020. 40(7): 942-948.
[7] 袁瑛 , 王伦昌 . 正畸微型种植体对安氏Ⅱ类错颌畸形患者 MMP-2 MMP-9 及 Bcl-2/Bax 水平的影响 [J]. 河北医学 , 2020.26(12): 2053-2056.
[8] 苏征佳 , 潘晓茜 , 曹久妹 , 等 . 利拉鲁肽对高糖诱导内皮细胞 miRNA-146b-3p、炎症因子及环氧化酶 -2 表达的影响 [J].上海交 通大学学报 ( 医学版 ), 2018. 38(12): 1420-1424.
[9] 申亚丽 , 蒋昆 , 张敏丽 , 等 . 利拉鲁肽对高糖诱导的炎症单核细 胞亚群分化的影响 [J]. 中国医科大学学报 , 2017. 46(9): 773-778.
[10] 张哲 , 野战鹰 , 王杏 , 等 . 利拉鲁肽对高糖诱导的 H9c2 心肌细胞 焦亡的保护作用 [J]. 中国临床药理学杂志 , 2023. 39(5): 630-634.
[11] HAJISHENGALLIS G, CHAVAKIS T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities [J]. Nat Rev Immunol, 2021. 21(7): 426-440.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/71022.html