SCI论文(www.lunwensci.com):
摘要:目的研究TRAIL在低氧诱导的肺动脉高压(PAH)小鼠中的作用。方法选取8周龄C57BL/6野生型雄性小鼠40只,随机分为4组:对照组、肺动脉高压组、IgG-Ab组、TRAIL-Ab组。TRAIL-Ab组低氧(10%O2,90%N2)暴露3周后将TRAIL抑制剂以渗透式微型泵持续腹腔给药4周,而IgG组低氧暴露3周后将IgG-Ab以渗透式微型泵持续腹腔给药4周,肺动脉高压组低氧暴露3周,对照组常氧暴露3周。测量小鼠肺动脉压即右室收缩压(RVSP)、右室肥厚指数(RVH)=右心室/(左心室+心室隔)[RV/(LV+S)],用HE染色和免疫荧光染色观测各组形态学变化,Western Blotting实验方法测定肺组织平滑肌细胞(α-SMA)的表达水平,化学发光免疫法测定血清C-反应蛋白,酶联免疫吸附法测定血清IL-6。结果(1)与对照组相比,PAH组及IgG-Ab组的右室收缩压、右室肥厚指数均明显增高(P<0.05),与PAH组相比,TRAIL-Ab组的右室收缩压、右室肥厚指数均明显降低(P<0.05)。(2)病理组织学检查示TRAIL-Ab可减轻低氧诱导PAH模型小鼠肺小动脉内膜增生。(3)蛋白印迹法示TRAIL-Ab可减少肺组织平滑肌细胞的蛋白表达(P<0.05)。(4)血清学检查示TRAIL-Ab可减少炎症介质的表达(P<0.05)。结论TRAIL抑制剂可减轻肺血管重塑和炎症反应,进而干预小鼠PAH的进展。
关键词:肺动脉高压;TRAIL;肺平滑肌细胞;IL-6
本文引用格式:张晓贝,杨二丽,成强胜,等.TRAIL抑制剂减轻低氧诱导肺动脉高压小鼠的肺血管重塑和炎症反应[J].世界最新医学信息文摘,2019,19(42):1-3.
TRAIL Inhibitor Reduced the Pulmonary Vascular Remodeling and Inflammation in Hypoxia-Induced Pulmonary Arterial Hypertension Mice
ZHANG Xiao-bei,YANG Er-li,CHENG Qiang-sheng,DING Chan-dong*
(Dept of Cardiovascualr For Gerontism,The Second Hospital of Anhui Medical University,Hefei Anhui)
ABSTRACT:Objective To investigate the role of TRAIL in hypoxia-induced pulmonary arterial hypertension(PAH)in mice.Methods Forty 8-week-old C57BL/6 WT male mice were randomly divided into four groups:control group,PAH group,IgG-Ab group and TRAIL-Ab group.TRAIL-Ab group was treated with TRAIL-antibody intraperitoneally by osmotic micro-pumps for 4 weeks after 3 weeks of hypoxia(10%O2,90%N2),IgG-Ab group was administered into IgG-antibody intraperitoneally by osmotic micro-pumps for 4 weeks after 3 weeks of hypoxia,PAH group was exposed to hypoxia for 3 weeks and control group was exposed to normoxia for 3 weeks.The right ventricular systolic pressure(RVSP)and right ventricular hypertrophy index[RV/(LV+S)]were measured and compared among all groups,the morphological changes of each group were observed by HE staining and immunofluorescence staining,and the protein expression of pulmonary smooth muscle cells(a-SMA)was measured by Western Blotting techniques.Serum C-reactive protein was determined by Chemiluminescence immunoassay and serum IL-6 was determined by enzyme-linked immunosorbent assay.Results(1)Compared with the control group,RVSP and RVH in PAH group and IgG-Ab group increased significantly(P<0.05).while compared with PAH group,RVSP and RVH in TRAIL-Ab group decreased significantly(P<0.05).(2)Histopathological examination showed that TRAIL-antibody alleviate intimal hyperplasia of pulmonary arterioles in hypoxia-induced PAH mice obviously.(3)Western blotting techniques showed that TRAIL-antibody reduce the expression of smooth muscle cells in lung tissue significantly(P<0.05).(4)Serological examination showed that TRAIL-antiboy could reduce the expression of inflammatory mediators(P<0.05).Conclusion TRAIL-antibody can alleviate pulmonary vascular remodeling and inflammation,thereby alleviating the progress of PAH in mice.
KEY WORDS:Pulmonary Arterial Hypertension;Tumor Necrosis Factor-related Apoptosis Inducing Ligand;Pulmonary smooth muscle cells;IL-6
0引言
肺动脉高压(PAH)是一种进行性、难治性和极度恶性的肺血管疾病,以血管重塑和细胞增殖而致肺细小动脉狭窄和阻塞为病理特征,其发病机理包括血管收缩、血管重塑、血栓形成和炎症反应等。血管重塑主要表现为三层管壁细胞(内皮细胞、膜平滑肌细胞和外膜成纤维细胞)的增生和肥大以及管壁细胞外基质的沉积[1]。炎症介质IL-6在肺动脉高压的疾病进展中起重要作用[2-3]。肿瘤坏死因子相关的凋亡诱导配体(TRAIL)是肿瘤坏死因子(TNF)超家族成员之一,研究证实TRAIL的mRNA和蛋白在正常人肺动脉血管内皮细胞及平滑肌细胞均有丰富表达,人和小鼠体内TRAIL浓度与肺高压的严重程度成正相关[4]。TRAIL基因敲除及给予TRAIL抑制剂均可通过减少细胞外基质的表达和沉积减轻肺血管重塑从而阻碍哺乳动物肺高压的进展[5]。尽管有研究证明IL-6在PAH中显著增加,但TRAIL对PAH中IL-6的表达影响尚鲜见研究报道。2017年12月至2018年9月,本研究通过低氧诱导小鼠PAH模型,以观察TRAIL抑制剂对PAH产生的影响,旨在为PAH的治疗提供理论基础。
1材料与方法
1.1实验动物
购自安徽医科大学实验动物中心健康8周龄C57BL/6小鼠40只,于动物实验箱喂养。
1.2仪器与设计
DMI400B倒置相差显微镜(德国Leica Micro Systems公司);TE124S电子分析天平(Sartorius公司);Western blotting相关仪器设备(深圳市亚辉龙生物科技有限公司);动物实验箱(长沙华曦电子科技有限公司);电力实验室生理信号数据采集系统(澳大利亚AD Instruments公司);HE染色试剂盒(北京索莱宝科技有限公司);氮气(安徽悦达气体);氧气(安徽悦达气体);TRAIL抗体(美国R&D Systems公司);IgG抗体(美国R&D Systems公司);GAPDH抗体(德国Sigma-Aldrich公司);α-SMA兔抗单克隆抗体(美国Cell Signaling Technology公司);山羊抗兔二抗H&L Alexa Fluor 488(英国abcam公司);山羊抗兔二抗H&L HRP(英国abcam公司)。
1.3实验设计
本实验采用慢性低氧生存环境[6](10%O2,90%N2)造大鼠PAH模型;TRAIL-Ab抑制TRAIL的表达。小鼠分笼(5只/笼)常规饲料喂养,室温22~24℃,相对湿度60%左右,每天早上8点始持续自动照明12h。40只8周龄C57BL/6野生型雄性小鼠随机分为4组:对照组、肺动脉高压组、TRAIL-Ab组、IgG-Ab组。
TRAIL-Ab组低氧(10%O2,90%N2)暴露3周后TRAIL-Ab以渗透式微型泵持续腹腔给药4周(0.8ng/g/h)[5],而IgG组低氧(10%O2,90%N2)暴露3周后IgG-Ab以渗透式微型泵持续腹腔给药4周(0.8ng/g/h),肺动脉高压组低氧(10%O2,90%N2)暴露3周,对照组常氧暴露3周。
1.4检测方法
1.4.1小鼠肺动脉压的测量
上述实验动物在满足实验所需低氧/常氧/给药时间后,分别将其称重,用10%水合氯醛注射液(0.3mL/100g)腹腔注射麻醉,将PE10导管插入颈内静脉,经右心房送入右心室,用电力实验室生理信号数据采集系统在记录仪上观察右心室内压力波形,即为右室收缩压(RVSP)。
1.4.2小鼠RVH的测量
RVSP测量后迅速离体心脏及肺组织。用剪刀分离左心室(LV)、右心室(RV)和室间隔(S),然后分别于电子分析天平称重,右室肥厚指数RVH=RV/(LV+S)。
1.4.3HE染色方法
RVSP测量后迅速离体肺;肺组织标本用冰盐水冲洗,经4%多聚甲醛灌流、石蜡包埋,制成5um厚的连续切片,行HE染色,采用IPP6.0图像分析软件测量肺小动脉壁内径及外径,中膜厚度计算公式为:(外径−内径)/外径,每组随机抽取10-15支直径30-80m的血管进行统计分析。
1.4.4免疫荧光方法
RVSP测量后立即取出肺。肺组织标本用冰盐水冲洗,经4%多聚甲醛灌流、石蜡包埋,制成5um厚的连续切片,行免疫荧光染色,α-SMA(CST公司)与PBS按1:1000比例稀释,4°C孵育过夜,山羊抗兔二抗IgG(abcam公司)与PBS按1:500比例稀释,避光室温孵育50min。甘油封片后在倒置荧光显微镜下立即观察并采集图像。
1.4.5目的蛋白Western blotting实验方法检测
RVSP测量后立即取出肺。液氮迅速冰冻后研磨、冰上裂解,4℃下12000rpm离心30min后将上清分装,作为蛋白质样品放于-80℃保存,采用碧云天BCA蛋白浓度测定试剂盒制作标准曲线检测样品蛋白总量,配制分离胶和浓缩胶,单个加样孔上样量为含50ug总蛋白的溶液体积后进行电泳和转膜,α-SMA(CST公司)与TBST按1:1000比例稀释,4°C孵育过夜,山羊抗兔二抗IgG(abcam公司)与TBST按1:4000比例稀释,在暗室内配制ECL发光液,根据一抗α-SMA最适曝光时间调整自动显影仪参数,选择清晰图片保存;
1.4.6血清指标检测
RVSP测量后迅速经右心导管抽取血液1-2mL,经液氮冷冻后置于-80℃保存。用化学发光免疫法测定血清C-反应蛋白,酶联免疫吸附法测定血清IL-6的表达水平。
1.5统计学方法
采用SPSS 17.0统计学软件对实验结果进行统计学分析,实验组和对照组连续性变量结果计算为均数±标准误。t检验用于两组定量数据的分析,方差分析(ANOVA)用于两组以上定量数据的分析。所有实验数据均重复3次以上。P<0.05认为差异有统计学意义。
2结果
2.1各组小鼠肺动脉压力及右室肥厚指数对比
与对照组相比,PAH组与IgG-Ab组RVSP及RV/(LV+S)明显增大(P<0.05);而与PAH组相比,TRAIL-Ab组的右室收缩压、右室肥厚指数均明显降低(P<0.05)。见表1。
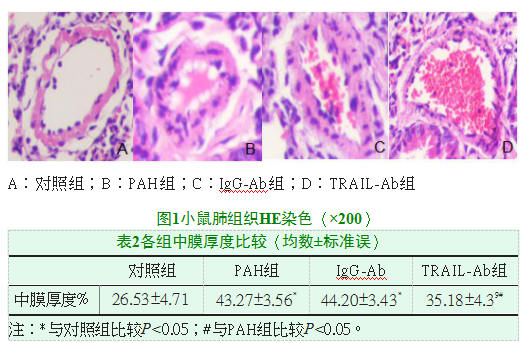
2.2肺组织HE染色比较
与对照组相比,PAH组与IgG-Ab组可见肺小动脉明显狭窄,中膜厚度显著增高(P<0.05);与PAH组相比,TRAIL-Ab组肺小动脉管壁部分增厚,(外径−内径)/外径比值明显降低(P<0.05),见图1及表2。
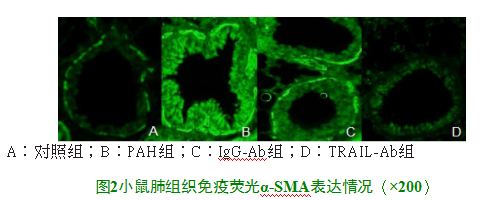
2.3肺组织免疫荧光结果
与对照组相比,PAH组与IgG-Ab组肺平滑肌细胞增殖显著;与PAH组相比,TRAIL-Ab组肺平滑肌细胞增殖明显降低,见图2。
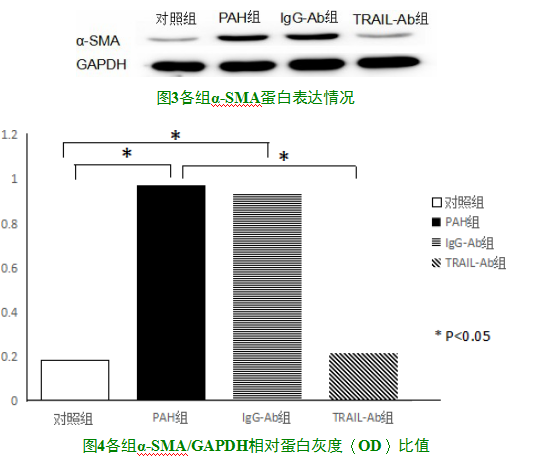
2.4α-SMA蛋白表达情况
与对照组相比,PAH组与IgG-Ab组α-SMA蛋白表达显著(P<0.05);与PAH组相比,TRAIL-Ab组α-SMA蛋白表达水平降低(P<0.05),见图3及图4。
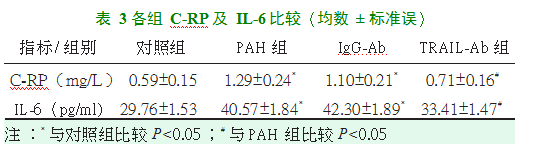
2.5血清炎症因子水平
与对照组相比,PAH组与IgG-Ab组C-RP及IL-6水平明显增高(P<0.05);而与PAH组相比,TRAIL-Ab组的C-RP及IL-6水平均明显降低(P<0.05)。见表3。
3讨论
肺动脉高压临床上以肺血管阻力增加和肺动脉压力升高为特征,可导致右心衰竭甚至死亡,其发病机理包括血管收缩、血管重塑、血栓形成和炎症反应等。目前针对肺高压的靶向药物主要是扩张肺血管,生存率未见明显改善。
TRAIL是TNF家族成员,在人体很多组织中尤其是肺、脾、前列腺等都有丰富的表达,在炎症、细胞凋亡等多方面起重要作用。本研究结果显示,TRAIL抑制剂可减轻低氧诱导的PAH小鼠肺小动脉内膜增生,减轻肺血管重塑,这与之前的报道一致[5]。在本研究中,TRAIL抑制剂可明显降低PAH小鼠的血清炎症因子水平。
TRAIL在糖尿病、高脂血症或动脉粥样硬化发病机制中可通过自分泌或旁分泌的方式促进血管平滑肌细胞的凋亡[7]。已有研究证实TRAIL的mRNA及蛋白主要位于肺动脉壁及主动脉的平滑肌细胞内层[7]。本研究结果显示,经TRAIL抑制剂治疗后的低氧PAH小鼠右心室肥厚指数及右室收缩压即肺动脉压力显著下降,病理组织学检查提示肺小动脉(外径−内径)/外径比值明显降低,内膜增厚较PAH组减轻,肺组织α-平滑肌细胞表达减少,这表明TRAIL抑制剂对肺动脉高压的血管重塑具有改善作用。这与Abdul G[5]的研究一致。Di Bartolo BA等人[8]指出TRAIL可通过NADPH氧化酶4(NOX4)和一氧化氮(NO)依赖的机制促进血管生成和缺血诱导的新生血管形成。在主动脉-冠状动脉大隐静脉旁路移植术中,TRAIL可以促进细胞核抗原增殖,以一种NF-κB依赖性方式增加胰岛素样生长因子1受体(IGF1R)的表达,从而促进动脉粥样硬化的疾病进展[9]。TRAIL可通过保护内皮细胞不被分裂来促进斑块的稳定,从而减少浸润巨噬细胞的数量,增加血管平滑肌细胞的数量。目前有研究指出,部分细胞因子及激素可调节TRAIL的表达,如成纤维细胞生长因子-2、Sp1磷酸化和NF-κB可调节TRAIL促进血管损伤后血管平滑肌细胞的增殖[10],雌二醇可通过抑制NF-kB通路和下调TRAIL表达进而抑制血管平滑肌细胞的增殖和迁移[11]。而抑制上述细胞因子及激素的表达,是否有利于改善肺高压的血管重塑尚需进一步的研究。
IL-6被认为是心血管风险的主要生物标志物,可刺激肝脏产生C反应蛋白,C反应蛋白已被广泛用作动脉粥样硬化的血清学指标[12]。本研究结果提示,经TRAIL抑制剂治疗后的低氧PAH小鼠血清IL-6及CRP水平显著下降,这表明TRAIL抑制剂对PAH的炎症反应有抑制作用。在一项对于慢性阻塞性肺病患者的研究中,肺动脉压与IL-6的循环水平呈正相关[13]。Savale L等人[3]指出低氧条件下IL-6缺陷型小鼠肺部炎症细胞募集和血管重塑减轻,但目前还不清楚IL-6是直接靶向血管壁细胞还是通过炎症细胞介导肺血管重塑。损伤、细胞因子、生长因子和激素等可诱导血管平滑肌细胞的增殖[14],TRAIL抑制剂抑制细胞因子的炎症反应同时可进一步减轻平滑肌细胞引起的血管重塑。现有研究表明IL-6/IL6R/GP130复合物的形成可导致JAK/STAT3信号通路的激活,也可以激活PI3K/AKT和MAPK/ERK其他信号通路[2],P.Secchiero等人[15]指出TRAIL能够同时激活促凋亡途径以及抗凋亡(Akt/eNOS)和增殖(MAPK/ERK)途径,TRAIL与IL-6之前是否存在信号通路机制需进一步探究。
虽然本实验研究的是低氧PAH动物模型的病理特征不能代表所有类型的肺动脉高压,且TRAIL是多种肿瘤细胞凋亡的重要诱导因子,使用TRAIL抑制剂可能增加肺癌的风险[16]。但本研究证明TRAIL抑制剂可减轻低氧PAH小鼠的肺动脉血管重塑、降低肺动脉压、减少炎症因子CRP及IL-6的表达,提示TRAIL抑制剂通过减轻肺动脉高压的血管重塑及炎症反应干预PAH的发展。
参考文献
[1]Burgstaller G,Oehrle B,Gerckens M,et al.The instructive extracellular matrix of the lung:basic composition and alterations in chronic lung disease[J].Eur Respir J,2017,50(1).
[2]Pullamsetti SS,Seeger W,Savai R.Classical IL-6 signaling:a promising therapeutic target for pulmonary arterial hypertension[J].J Clin Invest,2018 128(5):1720-1723.
[3]Savale L,Tu L,Rideau D,et al.Impact of interleukin-6 on hypoxia-induced pulmonary hypertension and lung inflammation in mice[J].Respir Res,2009,27(10):6.
[4]Liu H,Yang E,Lu X.Serum levels of tumor necrosis factor-related apoptosis-inducing ligand correlate with the severity of pulmonary hypertension[J].Pulm Pharmacol Ther,2015,33:39-46.
[5]Hameed AG,Arnold ND,Chamberlain J,et al.Inhibition of tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)reverses experimental pulmonary hypertension[J].J Exp Med,2012,209(11):1919-1935.
[6]Zhao L,Winter RJ,Krausz T,et al.Effects of continuous infusion of atrial natriuretic peptide on the pulmonary hypertension induced by chronic hypoxia in rats[J].Clin Sci(Lond),1991,81(3):379-385.
[7]Bernadette R,Gochuico,Jie Zhang,et al.TRAIL expression in vascular smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2000,(278):1045-1050.
[8]Di Bartolo BA,Cartland SP,Prado-Lourenco L,et al.Tumor Necrosis Factor-Related Apoptosis-Inducing Ligand(TRAIL)Promotes Angiogenesis and Ischemia-Induced Neovascularization Via NADPH Oxidase 4(NOX4)and Nitric Oxide-Dependent Mechanisms[J].J Am Heart Assoc,2015,4(11).
[9]Kavurma MM,Schoppet M,Bobryshev YV,et al.TRAIL Stimulates Proliferation of Vascular Smooth Muscle Cells via Activation of NF-B and Induction of Insulin-like Growth Factor-1 Receptor[J].J Biol Chem,2008,283(12):7754-62.
[10]Chan J,Prado-Lourenco L,Khachigian LM,et al.TRAIL Promotes VSMC Proliferation and Neointima Formation in a FGF-2-,Sp1 Phosphorylation-and NFB-Dependent Manner[J].Circ Res,2010,106:1061-1071.
[11]Li HC,ChengY,Simoncini T,et al.17b-Estradiol inhibits TNF-a-induced proliferation and migration of vascular smooth muscle cells via suppression of TRAIL[J].Gynecol Endocrinol,Early Online,1996:
[12]Tedgui A,Mallat Z.Cytokines in atherosclerosis:pathogenic and regulatory pathways[J].Physiol Rev,2006,86(2):515-581.
[13]Eddahibi S,Chaouat A,Tu L,et al.Interleukin-6 gene polymorphism confers susceptibility to pulmonary hypertension in chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2006,3(6):475-476.
[14]Isenovic ER,Soskic S,Trpkovic A,et al.Insulin,thrombine,ERK1/2 kinase and vascular smooth muscle cells proliferation[J].Curr Pharm Des,2010,16:3895-3902.
[15]P.Secchiero,A.Gonelli,E.Carnevale,et al.TRAIL promotes the survival and proliferation of primary human vascular endothelial cells by activating the Akt and ERK pathways[J].Circulation,2003,107,2250-2256.
[16]Yagita H,Takeda K,Hayakawa Y,et al.TRAIL and its receptors as targets for cancer therapy[J].Cancer Sci,2004,95:777-783.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/7423.html