SCI论文(www.lunwensci.com):
摘要:目的探究二氢丹参酮Ⅰ能否抑制脂磷壁酸(LTA)诱导的巨噬细胞炎症反应及其作用机制。方法以LTA为刺激剂,激活巨噬细胞,建立体外炎症模型,用Griees试剂法检测二氢丹参酮Ⅰ对LPS诱导的NO产生的影响,并用免疫蛋白印记法检测JNK、ERK、p-38、p65以及Akt磷酸化水平。结果二氢丹参酮Ⅰ能够抑制LTA诱导的NO产生,对JNK和ERK的活化无影响,但是可以抑制p38MAPK的活化,同时二氢丹参酮Ⅰ浓度依赖性地促进p65及Akt的活化。结论二氢丹参酮Ⅰ对LTA诱导的NO产生有显著抑制效果,其作用机制与抑制p38MAPK的活化有关。
关键词:二氢丹参酮Ⅰ;LTA;MAPK;RAW 264.7
本文引用格式:刘思蕊,钱峰.二氢丹参酮Ⅰ抑制脂磷壁酸(LTA)诱导的巨噬细胞炎症反应[J].世界最新医学信息文摘,2019,19(43):48-50.
DihydrotanshinoneⅠInhibit Lipoteichoic Acid(LTA)Induced Cellular Inflammatory Response
LIU Si-rui1,2,QIAN feng 2*
(1.College of Pharmacy and Chemestry,Dali University,Dali,Yunnan;2.School of Pharmacy,Engineering Research Center of Cell and Therapeutic Antibody,Shanghai Jiao Tong University,Shanghai)
ABSTRACT:Objective To determine whether DihydrotanshinoneⅠcan inhibit lipoteichoic acid(LTA)induced inflammation and explore the potential mechanism.Methods Macrophages were stimulated with LTA and NO production was measured by Griees reagent.In addition,the phospharylation of JNK,ERK,p-38,p65 and Akt were detected by Western blotting.Results DihydrotanshinoneⅠinhibited LTA-induced NO production.Although DihydrotanshinoneⅠdidn’t attenuate LTA-induced activation of JNK and ERK,DihydrotanshinoneⅠdecreased phospharylation of p38 MAPK.Moreover,DihydrotanshinoneⅠdose-dependently promoted activation of p65 and Akt.Conclusion DihydrotanshinoneⅠsignificantly inhibited LTA-induced NO production,which was associated with the reduction of phospharylation of p38 MAPK.
KEY WORDS:DihydrotanshinoneⅠ;LTA;MAPK;RAW 264.7
0引言
丹参首见于《神农本草经》,是常见的活血化瘀药,近年的药理学研究表明,丹参及其活性成分具有抗肿瘤、抗血栓、抗炎等作用[1]。丹参的有效成分主要分为水溶性和脂溶性两大类,Zhou xian等人的研究表明,丹参能够显著抑制LPS(脂多糖)诱导的NO产生及TNF-α的表达,从而抑制细胞炎症反应,而二氢丹参酮Ⅰ则是其发挥抗炎作用的重要活性成分之一[2]。
LTA是革兰氏阳性菌细胞壁的特殊成分,是革兰氏阳性菌的重要表面抗原。而对于二氢丹参酮Ⅰ能否抑制LTA(lipoteichoic acid,脂磷壁酸)诱导的细胞炎症反应这一问题,目前尚不清楚。LTA是目前公认的除LPS外另一重要的PAMP(病原相关分子模式),能够被机体内特定的PRRs(模式识别受体)所识别,为TLR2(Toll样受体2,为PRRs的一种)的配体[3]。TLR2被激活后,引起其下游多个适配蛋白的活化,如MyD88(髓样分化因子88)和TRAF6(肿瘤坏死因子受体相关因子6)[4]。TRAF6作为泛素连接酶,其自身被泛素化激活,随后,TRAF6激活MAPK(丝裂原活化蛋白激酶)和NF-κB(核因子κB)信号通路,产生TNF-α、IL-6、IL-12等促炎细胞因子[5]。研究表明,PI3K/Akt通路能够协调和参与巨噬细胞中不同的代谢及炎症信号的反应,同时也参与巨噬细胞存活、增殖和迁移的调控[6],它能够被多种信号激活。PI3K/Ak通路的活化对TLR激活的巨噬细胞的功能有十分关键的作用,包括限制促炎因子的释放、促进抗炎反应的发生等[7]。
本研究中我们以LTA作为刺激剂,刺激鼠源腹腔巨噬细胞RAW 264.7,构建革兰氏阳性菌所致的体外炎症模型,对二氢丹参酮Ⅰ的抗炎活性进行了检测,并进一步探究了其抗炎的作用机制,对二氢丹参酮Ⅰ今后在临床上的应用有一定指导意义,同时也为丹参相关抗炎药物的开发提供理论依据。
1材料与方法
1.1主要试剂
二氢丹参酮Ⅰ(C18H14O3,MW:278.3,纯度>98%)购自上海陶素生化技术有限科技公司。LTA购于美国Sigma公司,RPMI-1640培养基和100×青霉素/链霉素购自美国Life technologies公司,胎牛血清购自杭州天杭生物科技有限公司,一氧化氮检测试剂盒购于碧云天生物技术有限公司。抗体p-p38,Total-p38,p-ERK,Total-ERK,p-JNK,Total-JNK,NF-κB-p65,p-NF-κB-p65,IκBα,β-actin购自美国Cell Signaling公司。
1.2细胞培养
鼠源腹腔巨噬细胞RAW264.7细胞所用培养基为含10%胎牛血清、1%青霉素/链霉素的RPMI-1640培养基,细胞置于37℃,5%二氧化碳培养箱中培养。观察细胞生长状态,及时进行换液及传代,当细胞生长至对数生长期期时,即可进行传代、接种及冻存。
1.3Griees试剂法检测RAW 264.7细胞NO生成量
将状态良好的对数生长期RAW 264.7细胞以5×104/孔接种至96孔板,过夜培养。次日更换新的完全培养基,将不同浓度(3,10,30M)的二氢丹参酮Ⅰ加至对应的孔中,以1‰DMSO作为溶剂对照,10M的小白菊内脂作为阳性对照。药物孵育30分钟后,加入25 mg/mL的LTA刺激24小时,收集细胞上清,并按照一氧化氮检测试剂盒说明书对NO含量进行测定。
1.4Western Blot检测蛋白表达
将对数生长期的RAW 264.7细胞以1×106/mL的浓度接种至6孔板中,过夜培养。实验分组同1.3,药物孵育30分钟后,加入25 mg/mL的LTA刺激30分钟,用适量PBS洗涤两次,加入200L loading buffer(175 mM/L Tris-HCl,100 mM/L DTT,7.5%甘油,4.0%SDS和0.2%的溴酚蓝溶于蒸馏水中),细胞充分裂解后用细胞刮收集样品。样品于恒温混匀仪中,99℃下处理10分钟使蛋白变性。
取10L上样至SDS-PAGE胶样品孔中,电泳一定时间后转膜75分钟,接着用5%的脱脂奶粉室温下封闭2小时,加入一抗4℃孵育过夜,用1×TNET缓冲液洗膜3次,加入对应的二抗常温下孵育2小时,TNET缓冲液洗膜2次,加入ECL底物显影,显影后的胶片干燥后进行扫描,得到的目的条带用ImageJ软件进行灰度值分析和统计。
1.5统计学分析
实验中所得数据均为至少3次独立重复试验的结果,并用平均值±标准误(mean±SEM)来表示,用GraphPad Prim 5软件进行数据处理和分析,两组间比较采用t检验,P<0.05则认为结果有统计学意义。
2结果
化水平的显著增加(P<0.01),经不同浓度的二氢丹参酮Ⅰ处理
2.1二氢丹参酮Ⅰ抑制了LTA诱导的RAW264.7细胞NO的产生
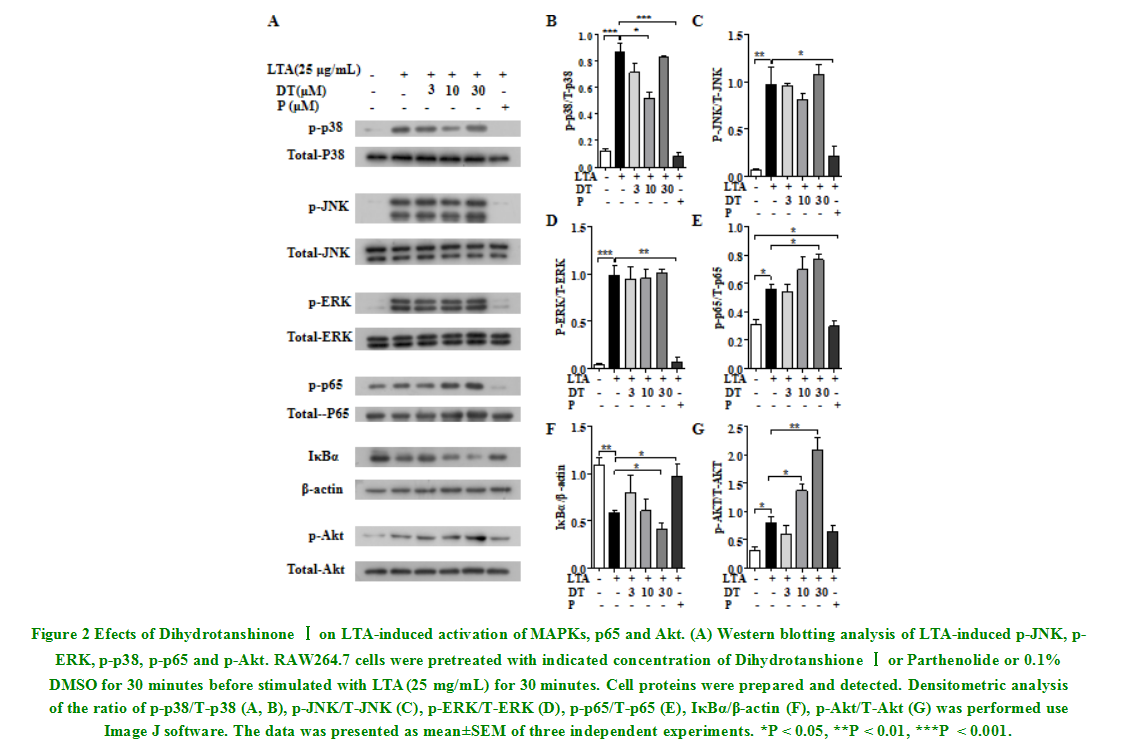
NO作为一种重要的细胞炎症介质,是评价炎症程度的重要指标。如图1 B所示,25 mg/mL的LTA可显著提高RAW 264.7细胞NO的产量(P<0.05)经过不同浓度的二氢丹参酮Ⅰ(3,10,30M)处理后,与LTA组相比,均剂量依赖性地显著减少了NO的生成。且在3M时即可产生53%的抑制效果,在30M时抑制率达81.8%,同阳性对照药小白菊内脂的抑制效果相当。2.2二氢丹参酮Ⅰ抑制LTA诱导的p38 MAPKs的磷酸化MAPKs的活化是LTA与TLR2受体结合所引发的下游信号激活的一经典途径,因此我们通过检测MAPKs蛋白水平的表达来探究二氢丹参酮Ⅰ发挥其抗炎作用的机制。结果如图2(A,B-D)所示,LTA刺激可引起RAW 264.7细胞p-38、JNK和ERK磷酸后,同LTA组相比较,JNK和ERK的磷酸化水平无明显变化;与之不同的是,p38的磷酸化水平在其浓度为10M时被显著抑制,但浓度为30M时其磷酸化水平与LTA组相当。
2.3二氢丹参酮Ⅰ促进NF-κB信号通路的活化
NF-κB信号通路是参与炎症反应的经典通路,TLR2被激活后,也会引起其下游的NF-κB信号的活化。LTA诱导的RAW 264.7细胞NF-κB信号通路的活化情况如图4(E、F)所示,LTA刺激使RAW64.7细胞NF-κB-p65的磷酸化水平明显增强,用不同浓度的二氢丹参酮Ⅰ处理后,其磷酸化水平随浓度的增加而升高,30M时显著高于LTA组(P<0.05)。IκBα(NF-κB抑制蛋白α)的变化正与p-NF-κB-p65的变化相反,LTA刺激后,其表达水平明显降低,用不同浓度的二氢丹参酮Ⅰ处理后,其表达水平随浓度的升高而降低,在30M时同LTA组有显著区别
(P<0.05)。
2.4二氢丹参酮Ⅰ促进Akt的磷酸化
当TLR2被LTA激活时,信号轴PI3K/Akt也会被激活,参与炎症反应的发生。因此,我们检测了LTA刺激后RAW 264.7细胞Akt的磷酸化水平的变化,结果如图2(G)所示,LTA刺激可引起RAW 264.7细胞Akt磷酸化水平显著增加,与之相比较,经不同浓度的二氢丹参酮Ⅰ处理后,Akt的磷酸化水平浓度依赖性地升高(P<0.05)。
3讨论
二氢丹参酮Ⅰ是丹参的脂溶性成分,从丹参的根中提取得到,它是二萜丹参酮类化合物的生物活性家族的一员,在中国传统医学实践中广为人知。丹参酮在临床上被用作心血管疾病治疗的抗炎药[8]。Meng Li等人发现丹参的脂溶性成分能够通过阻断NF-κB的活化从而调控LPS诱导的iNOS、TNF、IL-1β和IL-6的表达[9]。Xian Zhou等人发现二氢丹参酮Ⅰ是丹参抑制LPS诱导的NO、TNF产生最有效的成分[10]。而后Su Jin Jeon等发现二氢丹参酮Ⅰ具有抗炎活性,它能够抑制LPS刺激RAW 264.7的体外炎症模型中NO及PGE2产量的增加,其作用机制可能与其对转录因子NF-κB及AP-1的抑制有关[11]。LTA作为革兰氏阳性细菌的表面分子,在体内和体外对炎症反应的刺激中发挥重要作用[12-13]。本研究中,我们以LTA刺激鼠源腹腔巨噬细胞RAW 264.7,建立体外炎症模型,发现二氢丹参酮Ⅰ同样可抑制LTA诱导的NO产量的增加。LTA与TLR2的相互作用可激活细胞内信使,如MyD88和MAPKs,以及下游包括NF-κB在内的转录因子,从而刺激炎性细胞因子的表达[14]。因此,我们用蛋白免疫印迹法检测MAPKs(包括JNK、ERK、p38)及NF-κB通路相关蛋白(IκBα和NF-κB-p65)的表达来判断二氢丹参酮Ⅰ发挥其抗炎作用的机制。结果发现二氢丹参酮Ⅰ对JNK和ERK的磷酸化水平无影响,但在10M时显著抑制了p38的磷酸化,然而30M时却并无抑制作用。高浓度的二氢丹参酮Ⅰ未能抑制p38的磷酸化这一结果,可能与Su JinJeon等人的发现有关:25M的二氢丹参酮Ⅰ孵育RAW 264.7细胞20h会表现出一定的细胞毒性[9]。而本研究中在设置浓度时未考虑周全,在WesternBlot实验中药物虽只孵育30分钟,但也可能对细胞产生了一定影响,因此出现与10M时相矛盾的结果。此外,我们发现二氢丹参酮Ⅰ能够浓度依赖性地促进NF-κB通路的活化及Akt的磷酸化。LTA是TLR2的配体,但它同时能够部分激活TLR1和LTR6[15],因此我们推测二氢丹参酮Ⅰ发挥其抗炎作用的机制与其对p38 MAPK的抑制有关,此外,二氢丹参酮Ⅰ也可能通过影响TLR1和LTR6来发挥其抗炎作用,而这一点需要更进一步的研究来验证。
在本研究中,我们发现二氢丹参酮Ⅰ对LTA诱导的NO产生有显著的抑制效果,其作用机制与减少p38 MAPK的磷酸化有关。该发现对二氢丹参酮Ⅰ今后在临床上的应用有一定指导意义,同时也为丹参相关抗炎药物的开发提供理论依据。
参考文献
[1]王梦梦,吉兰芳,崔树娜.丹参功效的物质基础研究进展[J].中医学报,2019(05):944-949
[2]Xian Z,Razmovskinaumovski V,Chang D,et al.Synergistic Effects of Danshen(Salvia Miltiorrhiza Radix et Rhizoma)and Sanqi(Notoginseng Radix et Rhizoma)Combination in Inhibiting Inflammation Mediators in RAW264.7 Cells[J].Biomed Research International,2016,2016(6):5758195.
[3]Akira,S.,Uematsu,S.,Takeuchi,O.Pathogen recognition and innate immunity[J].Cell,2006(124):783-801.
[4]
Liew,F.Y.,Xu,D.M.,Brint,E.K.,O’Neill,L.A.J..Negative regulation of toll-like receptor-mediated immune responses[J].Nat.Rev.Immunol,2005,(5):446-458.
[5]Hacker H,Redecke V,Blagoev B,et al.Specificity in Toll-like receptor signalling through distinct effector functions of TRAF3 and TRAF6[J].Nature(London),2005,439(7073):204-207.
[6]Song G,Ouyang G,Bao S.The activation of Akt/PKB signaling pathway and cell survival[J].Journal of Cellular&Molecular Medicine,2010,9(1):59-71.
[7]Marta López-Peláez,Soria-Castro I,Lisardo Boscá,et al.Cot/tpl2 activity is required for TLR-induced activation of the Akt p70 S6k pathway in macrophages:Implications for NO synthase 2 expression[J].European journal of immunology,2011,41(6):1733-1741.
[8]Wang X,Morris-Natschke S L,Lee K H.New developments in the chemistry and biology of the bioactive constituents of tanshen[J].Medicinal Research Reviews,2010,27(1):133-148.
[9]Li M,Zhang L,Cai R L,et al.Lipid-soluble extracts from Salvia miltiorrhiza inhibit production of LPS-induced inflammatory mediators via NF-κB modulation in RAW 264.7 cells and perform antiinflammatory effects in vivo[J].Phytotherapy Research Ptr,2012,26(8):1195-1204.
[10]Xian Z,Valentina R N,Dennis C,et al.Synergistic Effects of Danshen(Salvia Miltiorrhiza Radix et Rhizoma)and Sanqi(Notoginseng Radix et Rhizoma)Combination in Inhibiting Inflammation Mediators in RAW264.7 Cells[J].BioMed Research International,2016,2016:1-12.
[11]Jeon S J,Son K H,Kim Y S,et al.Inhibition of prostaglandin and nitric oxide production in lipopolysaccharide-treated RAW 264.7 cells by tanshinones from the roots ofSalvia miltiorrhizabunge[J].Archives of Pharmacal Research,2008,31(6):758-763.
[12]Han Geun Kim),Seung Yeon Lee),Na Ra Kim),et al.Inhibitory Effects of Lactobacillus plantarum Lipoteichoic Acid(LTA)on Staphylococcus aureus LTA-Induced Tumor Necrosis Factor-Alpha Production[J].Journal of Microbiology&Biotechnology,2008,18(6):1191.
[13]Deininger S,Stadelmaier A,Von Aulock S,et al.Definition of Structural Prerequisites for Lipoteichoic Acid-Inducible Cytokine Induction by Synthetic Derivatives[J].The Journal of Immunology,2003,170(8):4134-4138.
[14]Ryu Y H,Baik J E,Yang J S,et al.Differential immunostimulatory effects of Gram-positive bacteria due to their lipoteichoic acids[J].International Immunopharmacology,2009,9(1):0-133.
[15]Cot Marlène,Ray Aurélie,Martine G,et al.Lipoteichoic Acid in Streptomyces hygroscopicus:Structural Model and Immunomodulatory Activities[J].PLoS ONE,2011,6(10):e26316-.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/9511.html