SCI论文(www.lunwensci.com)
摘要: 随着内窥镜检查技术的进步,诸如色素内镜、窄带成像内镜、细胞内窥镜、聚焦放大内镜、蓝激光放大内镜等多种内窥镜成像 系统通过对黏膜、血管等增强显示及对图像的处理, 在评估克罗恩病炎症活动性方面相较于传统白光检查表现出不同优势。目前可应用不同 的评分系统评估克罗恩病的临床活动性、内镜下活动性及组织学活动性,其中以克罗恩病活动指数( CDAI )用于克罗恩病临床活动性的判 断较常见, 主要依据患者 1 周内出现水样或稀便次数、腹痛、腹部包块等的天数, 乘以相应的倍增因子, 得到疾病活动指数总评分, 评分越 高,病情严重程度越高。将克罗恩病内镜严重层程度指数( CDEIS ) 及克罗恩病简单内镜评分( SES-CD ) 用于克罗恩病内镜下活动性的判 断, 结肠镜所能观察到的病变分为五个部分:直肠、乙状结肠、左半结肠、横结肠、回肠及右半结肠, 根据内镜检查时所观察到的黏膜、血 管病变进行评分,分值越高,病情越严重。在结肠镜检查期间,根据内窥镜医师对肠道黏膜病变的评估,在可疑病变黏膜区域钳取活检标 本, 送病理检查, 有经验的病理医师对标本进行处理分析, 评估疾病的组织学活动性。临床活动性、内镜下活动性、组织学活动性是评估克 罗恩病疾病活动性的三大重要因素,随着内窥镜技术及设备不断发展,使达到镜下评估的疾病活动性与组织学活动性保持一致成为可能。
关键词:炎症性肠病,克罗恩病,活动性分级,蓝激光放大内镜
炎症性肠病(inflammatory bowel disease,IBD)是肠黏 膜慢性非特异度炎症疾病, 包括克罗恩病( crohn’s disease,CD) 和溃疡性结肠炎( ulcerative colitis, UC )。 CD 是肠 道慢性非特异度肉芽肿性炎症疾病,主要累及末端回肠、 邻近结肠,可累及口腔至肛门消化道各段,主要临床表现 为腹痛、腹泻、体质量减轻。多数伴发热、乏力等全身症 状,可有关节痛、眼、口腔黏膜等肠外表现,主要并发症 为出血、穿孔、肠腔狭窄、肠梗阻。随病情持续,复发、 缓解交替,几乎所有 CD 最终均会出现狭窄、瘘管,瘘管 形成与黏膜溃疡密切相关,目前大多以诱导和维持临床缓 解作为 CD 治疗目标,然而即使达到临床缓解,肠黏膜炎 症仍继续进行。已有研究建议将黏膜愈合作为 CD 治疗另 一目标,尽管黏膜愈合并不能改变 CD 最终结果,但诱导 黏膜愈合,并使黏膜愈合期尽量延长,可延长无症状期,延缓疾病进展。目前多采用内窥镜检查,评估 CD 患者肠 黏膜愈合情况,然而普通白光内镜成像在显示组织炎症方 面存在很大局限性, WLI 检查发现黏膜愈合的病例中仍有 一部分患者经病理组织学检查发现炎症继续进展 [1] 。常规 病理检查不但延长了患者肠镜检查时间,而且增加患者检 查费用,甚至引起出血穿孔等并发症。随着内镜检查设备 及技术进展,为内窥镜下评估组织学炎症,减少病理活组 织检查提供可能。
1 克罗恩病概述
1.1 流行病学 亚洲地区克罗恩病共识指出,虽然亚洲 地区 IBD 的发病率还没有达到西方国家的水平,但 CD 患病人数日益增加,使得 CD 已成为一种全球性疾病 [2]。 出现这种现象的原因目前尚未明确,可能与经济社会因 素、饮食习惯改变等因素相关,而肺结核和病毒性肝炎等传染病高发,使糖皮质激素、免疫抑制剂的应用存在限 制。在发病部位均以回盲部最多见,且在高峰年龄组、肠 外表现发生率、并发症方面与西方国家无明显差异 [3] 。
1.2 发病机制 CD 是病因不明的慢性炎症疾病,发病机 制尚未明确。可能与环境相互作用、遗传易感性、肠道微 生态、抗生素滥用、吸烟等不良生活习惯有关。
1.3 WHO 诊断标准 ①非连续性性节段性改变;②鹅卵 石样改变和纵行溃疡;③全层炎症;④裂沟、瘘管;⑤肛 门周围病变;⑥非干酪性肉芽肿。出现①②③中症状或体 征为疑诊,在此基础上加上④⑤⑥中任意一项可确诊 CD。
2 多种内镜成像技术在克罗恩病检查中的应用价值及其 局限性
2.1 普通白光内镜成像技术 普通白光成像光谱由红、 绿、蓝三种光组成,是所有成像技术的基础,但不同白光 检查对一些微小病灶不能清晰显示,对黏膜下血管及黏膜 微细结构的显示具有一定局限性。
2.2 色素内镜成像技术 色素内镜通过对局部黏膜血管 进行增强显示弥补了传统白光内窥镜的不足,被推荐用于 IBD 发育不良的监测。按其染色原理不同可分为两大类, 即基于染料的色素内镜和基于光学成像及计算机的无色素 虚拟染色色素内镜。用于染料色素内镜的染色剂可分为吸 收剂、活体染色剂和造影剂,基于染料的色素内窥镜检查 有一定局限性,如检查时间延长、染料覆盖不均、无法对 上皮下毛细血管网络进行详细分析等,而血管变化是胃肠 道肿瘤的早期诊断的重要特征 [4] 。虚拟染色色素内镜进一 步细分为光学彩色内窥镜和数字彩色内窥镜,光学虚拟染 色色素内镜利用光学过滤器处理内窥镜光源,通过组织对 特定波长光的吸收来增强和促进局部黏膜血管的可视化。 相比之下,数字虚拟染色色素内镜使用计算机预处理器和 后处理器处理内窥镜图像,从而提高黏膜毛细血管图案的 对比度并增强黏膜表面图案形态 [4]。
2.3 窄带成像内镜技术 窄带成像内镜(NBI)使用光学 过滤器过滤掉宽带红光,保留窄带蓝光和绿光,通过血红 蛋白对其吸收提供黏膜血管增强图像。NBI 对黏膜血管具 有很强的显示性,可以通过观察局部黏膜血管形态及密度 改变,区分正常黏膜及病变黏膜 [5] 。但 NBI 成像视野较 暗,远距离观察病变时分辨率较低。
2.4 柔性光谱成像色彩增强内镜成像技术 柔性光谱成 像色彩增强内镜(FICE)也称多波段成像,是基于光谱图 像处理技术的成像系统,从视频处理器获取普通的内窥镜 图像,并对给定的专用波长的光进行算术处理,并产生图 像,FICE 可选择 400~700 nm 之间的波长。单波长图像是 随机选择的,并分配红色、绿色和蓝色以构建和显示虚拟 增强的彩色图像。FICE 适合远距离观察病变,提高病变黏膜与周围黏膜之间对比度, 提高检出率, 但 FICE 对血管 的显示优势不如 NBI 和蓝激光放大内镜(BLI)。
2.5 电子染色与光学增强内镜成像技术 i-scan 是一种电 子染色内镜,将后处理算法应用在使用 WLE 获得的图像上,增强黏膜表面和毛细血管图案的对比度 [6-7]。光学增 强内镜(OE)是一种新型电子染色内镜, 其 OE 模式可以 增强黏膜表面结构和血管的观察效果。i-scan OE 系统是最 近推出的光学和数字电子虚拟色素内窥镜的组合,可增强 黏膜和血管的细节使用数字预处理和后处理,观察胃肠道 黏膜及血管细微变化,评估病变肠段黏膜模式及血管模 式。与普通白光内窥镜相比较,在评估组织活动性应用方 面优于普通白光内窥镜。根据观察到的病变肠段黏膜及血 管,可使用放大内镜评分进行活动性评估 [8]。Arndt 等应用 i-scan OE 新型放大内镜评分对克罗恩病黏膜模式及血管 模式进行评分,表明放大内镜联合光学染色内镜所观察到 的 CD 内镜下活动性与 IBD 患者的组织学活动性有很强 的相关性 [9]。
2.6 聚焦放大内镜成像技术 聚焦放大内镜( CLE)可以 在亚细胞水平上可视化结构,自 2003 年推出以来,CLE 已 成为一种可用于各种疾病的精确组织学实时活体成像的先 进内窥镜检查技术。在局部或全身注射造影剂后,CLE 会向 组织发射低功率蓝色激光,然后从组织反射并通过相同的 检测系统重新聚焦在检测系统上。以放大 1 000 倍的显微成 像观察局部结构 [10] 。应用 CLE 可用于观察炎症性肠病肠道 黏膜的上皮细胞间隙。但 CLE 需要应用荧光剂,且价格昂 贵,对操作医师水平要求高,使其临床应用受到限制 [11] 。
2.7 细胞内窥镜成像技术 IBD 的炎症活动不仅在临床 上表现出一系列炎症症状、在内镜下显示炎症部位黏膜及 血管模式改变,还涉及细胞学改变,炎症细胞及免疫细胞 聚集,普通内窥镜检查无法有效区分各类细胞,而细胞内 窥镜(EC)可放大 1 400 倍,观察局部上皮结构,细胞特 征(大小、分布),血管形态及对局部黏膜进行细胞学分 析 ( 细胞形态、细胞核大小、形态及核浆比例 ),可动态 观察 IBD 病变黏膜中浸润的炎症细胞 [12] 。与普通内窥镜 检查相比,可更加有针对性地指导靶向活检,更加准确评 估病变活动性,提高可重复性,但同时 EC 诊断准确度对 操作者专业能力限制,在不同操作者之间存在一定差异。
2.8 蓝激光放大内镜成像技术 “LASEREO”是 2012 年 富士公司开发的一种新型内镜系统,它使用半导体激光作 为光源,具有窄带光观察功能,无需定制滤光片。其工作 原理是通过被血红蛋白选择性吸收的未经过滤的短波长 蓝光和黏膜对光线反射增强显示局部黏膜血管分布及黏膜 细微结构。LASEREO 系统由一个光源、一个处理器和一 系列特殊的示波器组成。光源有两种类型的激光器,波长分别为 410、450 nm 和峰值波长范围分别为(410±10)nm 和(450±10)nm 。此外,两个带宽都小于大约 2 nm 。强 激光与 450 nm 波长的激光和荧光灯的组合为白光成像提 供了足够的照明度。410 nm波长的激光用于 BLI 窄带观察 用激光。蓝激光放大内镜具有 4 种成像模式,白光成像模 式、联动成像模式、蓝激光成像模式、明亮 - 蓝激光成 像模式,在用于临床观察时,可根据病变情况由内镜医师 对四种成像模式进行自由切换,以达到对病变区域的最佳 观察效果 [13] 。联动成像运用不同波长的白光用激光和窄 带阈用激光,同时进行发射,反射在黏膜表明血管和黏膜 表面成像的图像处理功能,即在 BLI 基础上加入红色信 号进行病变观察,识别黏膜颜色微小色差。联动成像使略 发红的区域更红,发白的区域更白,使颜色的扩张和缩小 同时进行。所以通过联动成像可在获得黏膜表面血管、黏 膜表面构造强调信息同时,对发红的部位起重点强调作 用,从而协助临床进行诊断。蓝激光放大内镜使用窄带联 合白光成像,弥补 FICE 和 NBI 不足,以其对黏膜微血管 系统的清晰显示,首先用于消化道早期肿瘤筛查。Naohisa 等 [14] 应用 BLI 对 314 结直肠息肉病患者进行分析,结果 表明 BLI 对增生性息肉、腺瘤、黏膜内癌、黏膜下癌具 有较高诊断准确率,其中对增生性息肉检出率为 100%, 此外在未放大的肿瘤和非肿瘤直径 <10 mm息肉的诊断准 确率高于白光,为 95.2%。近年来蓝激光放大内镜应用逐 渐扩展到 IBD 领域,CD 累及的组织在固有层及黏膜下层 可见毛细血管、小静脉扩张、增殖、重塑,可伴黏膜内出 血或血管破裂伴管腔内出血,回肠末端黏膜绒毛改变,绒 毛变形肥大,形态不规则,严重时出现糜烂坏死溃疡改 变,绒毛内血管呈螺旋、锯齿状,绒毛内或绒毛间出血 等 [15] 。蓝激光放大内镜增强对黏膜血管微细结构的显示, 其比 WLI 更能易发现扩张、迂曲、增殖的血管和病变的 黏膜绒毛,蓝激光成像系统作为一种新型内窥镜成像系 统,目前在国内各大内镜诊治中心尚未得到普及,且 BLI 对内镜操作医师要求较高,对各种病变黏膜微细结构改变 及 BLI 内镜操作熟练掌握,使得二者结合受到挑战。
3 克罗恩病黏膜血管改变
肿瘤性病变及炎症性病变常表现为血管增殖,内皮细 胞激活使血管通透性增加,渗出增加,趋化因子细胞因子 表达,炎症细胞、免疫细胞募集,毛细血管增殖及毛细血 管、小静脉重塑,导致炎症组织微血管床扩张。有研究提 出,血管生成可作为炎症性肠病发病机制的新组成成分, 微循环在炎症过程的起始和持续中均发挥重要作用 [16- 17] 。 克罗恩病累及的组织在固有层及黏膜下层可见大量扩张的 血管,可伴黏膜内出血或血管破裂伴管腔内出血,回肠末 端黏膜绒毛改变,绒毛变形肥大,形态不规则,严重时出现糜烂坏死溃疡改变,绒毛内血管呈螺旋、锯齿状,绒毛 内或绒毛间出血等 [9] 。血管化、血管重塑与炎症是相互依 赖的过程 [16]。
4 克罗恩病临床、内镜、组织学活动性评估
目前常将临床缓解作为临床诊疗和试验研究的观察指 标及终点, 但有研究表明部分患者在达到临床缓解后, 体内 炎症过程仍然继续进展, 因此黏膜愈合逐渐得到重视, 有研 究者建议将黏膜愈合作为观察治疗进展的另一重要指标,然 而达到黏膜愈合的患者群体中,仍有一部分患者表现为持续 组织学炎症, 常需病理活检才能准确评估, 增加了患者检查 时间和经济负担 [18] 。以临床症状评估的临床缓解、以黏膜 愈合评估的内镜下缓解、以病理活检评估的组织学缓解, 是 评估 CD 缓解的三大重要方法, 随着内窥镜技术及设备不断 发展,使达到镜下评估的疾病活动性与组织学活动性保持一 致成为可能。下面将从 CD 的临床活动、内镜下活动度及组 织学活动度等三方面对 CD 活动性进行介绍。
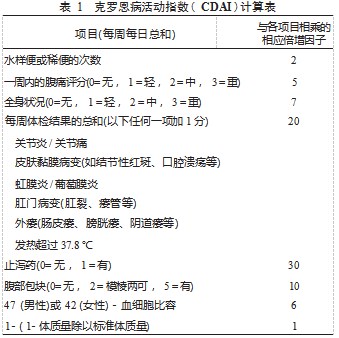
4.1 克罗恩病的临床活动性评估 对于 CD 临床活动 性的评定,目前尚无统一共识,包括克罗恩病活动指数 ( CDAI),哈维 ·布兰德指数(HBI ),Van Hees Index,肛周 疾病活动指数(PDAI)及针对瘘管的分级等,临床上应 用较多的是 CDAI。
4.1.1 克罗恩病活动指数评分系统 CDAI 是目前较为广 泛的被用于判断 CD 临床活动性的评分系统,主要依据患 者 1 周内出现水样或稀便次数、腹痛、腹部包块等的天 数,乘以相应的倍增因子,乘积加以总和,得到疾病活动 指数总评分。总分值 0~600.<150 为缓解期,150~219 为轻 度活动期,220~450 为中度活动期,>450 为严重期,分值越 高,病情越严重 [19]。
4.1.2 其他评分系统 其他评分系统如 HBI 是较 CDAI 更为简单的评分系统,还有用于肛周病变评分的 PDAI, 其根据分泌物、疼痛、性功能障碍、肛周病变、硬结程度 对肛门周围病变进行评分。除此之外,还有针对瘘管的评 分,目前尚无针对这些评分系统的共识。
4.2 克罗恩病的内镜下活动性评估 CD 内镜下活动性的 评估由医生在内窥镜检查期间根据观察到的消化道黏膜、 血管改变,依据 CD 的内窥镜下评分系统得到,该评分可 由进行内窥镜检查的医师进行,也可由另一位临床医师或 影像医师进行。常用的内窥镜评分系统有 CD 内镜严重程 度指数评分系统(CDEIS)和 CD 简单内镜评分系统( SES- CD )[20]。
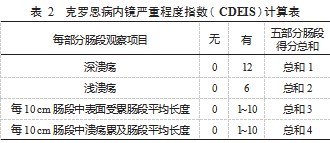
4.2.1 克罗恩病内镜严重程度指数 CDEIS 是 20 年前由 法国炎症消化指数组 (GETAID) 开发的唯一经过验证的 CD 内镜活动评分系统, 已被作为内镜下判断 CD 活动性 的金标准,它复杂且耗时,因此不适合常规使用。CDEIS 将结肠镜所能观察到的病变分为 5 个部分:直肠、乙状结 肠、左半结肠、横结肠、回肠及右半结肠,内镜检查时主 要描述 9 种病变:假息肉、溃疡愈合、明显红斑、明显黏 膜肿胀、阿弗他溃疡、浅溃疡、深溃疡、溃疡性狭窄、非 溃疡性狭窄(观察到以上项目即可作为该肠段受累)。主 要根据深 / 浅溃疡的有无、每 10 cm 肠段中表面受累肠段 平均长度、每 10 cm 肠段中溃疡累及肠段平均长度在肠段上述 5 部分依如下表格进行评分:
注: 在任何一部分肠段观察到深溃疡即为 12 分, 无深溃疡即为 0 分; 观察到浅溃疡即为 6 分, 无浅溃疡则为 0分; 观察每 10 cm 肠 段中表面受累肠段平均长度, 取值 0~10分;每 10 cm 肠段中溃疡累 及肠段平均长度, 取值 0~10 分, 取以上 4 项在各部分肠段的得分总 和, 记为总和 A,即 A= 总和 1 + 总和 2+ 总和 3+ 总和 4.受累肠段记 为 N ( 1~5 ); 总和 A 与受累肠段 N 的比值记为 B; 肠段有无溃疡记 为 C:有溃疡则 C= 3.无溃疡则 C= 0.肠段是否存在非溃疡性狭窄 记为 D:有则 D= 3.无则 D= 0; 最后计算克罗恩病严重程度指数总 分为 B+ C + D。总分值为 0~44. <3 为缓解期, 3~9 为轻度活动期, 9~12 为中度活动期, >12 为严重活动期 [21-22]。
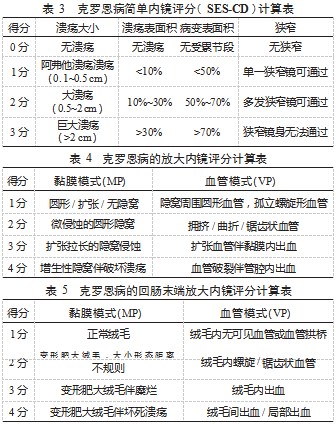
4.2.2 克罗恩病简单内镜评分 SES-CD 较 CDEIS 简单, 可重复。与 CD 内窥镜严重程度指数之间显示出很强的相 关性,目前应用较为广泛,SES-CD 主要评估 4 个内窥镜项目:溃疡大小、溃疡表面积及比例、病变肠段表面积比 例、狭窄, 每个项目 0~3 分, 最高为 56 分, 分值越高, 病情越严重 [23]。0~2 提示缓解期, 3~6 提示轻度活动期, 7~15 提示中度活动期,>16 提示严重活动期,见表 3 。
4.2.3 放大内镜评分 i-scan OE 放大内镜评分是一种关 注血管和黏膜模式的新型光学增强评分 [24] ,涉及黏膜 模式和血管模式评估,其将血管模式(VP)和黏膜模式 ( MP)分别分为 1~4 级, 对应 1~4 分。计算血管模式及 黏膜模式下得分总和,总分 2~8 分,MP+VP=2 为缓解期, 3~4 分为轻度活动期,5~6 分为中度活动期,7~8 分为重度 活动期 [9] ,见表 4、表 5.
4.3 克罗恩病组织学活动度评估 组织学评分指数是在 结肠镜检查期间,根据内窥镜医师对肠道黏膜病变的评 估,在可疑病变黏膜区域钳取活检标本,送病理检查。由 有经验的病理医师对标本进行处理分析,根据活检标本的 显微镜下表现,评估疾病的组织学活动性。
结直肠全球组织活动度评分(GGHAS/IGHAS): 评 分系统复杂,且尚未得到有效证实,较少应用于临床。
改良莱利指数(mRI) :在溃疡性结肠炎 Riley 评分 基础上,加入克罗恩病特征性病理改变。即针对急性炎症 细胞浸润、隐窝脓肿、黏蛋白耗竭、表面上皮完整性、慢 性炎症细胞浸润、隐窝结构不规则 6 个溃疡性结肠炎组织 学特征,以及淋巴细胞聚集体、肉芽肿、嗜酸性粒细胞数 量 3 个克罗恩病典型组织学特征对疾病组织学炎症进行分级。总评分≤4 为缓解期, ≥ 5 为活动期, 5~9 为轻度活动期, 10~18 为中度活动期, ≥ 19 为严重期 [9]。
5 展望
CD 的临床缓解、黏膜愈合内镜下缓解, 与组织学活动性之间尚未统一,随着内窥镜技术和设备的发展,有望使内窥镜下对 CD 活动性的判断与组织学活动性保持一致, 并开发验证疾病活动与缓解的内镜下炎症活动指数临界值,指导临床试验的观察终点。
参考文献
[1] RUTGEERTS P, VERMEIRE S, VAN ASSCHE G. Mucosal healingin inflammatory bowel disease: impossible ideal or therapeutic target?[J]. Gut, 2007. 56: 453–455.
[2] MOLODECKYING N A, SOON I S, RABI D M, et al. Increasingincidence and prevalence of the inflammatory bowel diseases withtime, based on systematic review[J]. Gastro, 2012. 142(1): 46-54.
[3] CHOON J O, GOVIND K M IDA H. Asia pacifific consensusstatements on crohn’s disease. part 1: Defifinition, diagnosis, andepidemiology (Asia pacifific crohn’s disease consensus-part 1) [J].Journal of Gastroenterology and Hepatology, 2016. 31: 45–55.
[4] NEUMANN H, NEURATH M F, MUDTER J. New endoscopicapproaches in IBD[J]. World J Gastroenterol, 2011. 17: 63–68.
[5] SILVIO D, GIONATA F, ERIKA A, et al. Narrow-band imagingendoscopy to assess mucosal angiogenesis in inflammatory boweldisease: A pilot study[J]. World Journal of Gastroenterology, 2010.16(19): 2396-400.
[6] SUBRAMANIAN V, RAGUNATH K . Advanced endoscopicimaging: A review of commercially available technologies[J]. ClinicalGastroenterology and Hepatology 2014. 12 (3): 368-376.
[7] NENMANNH, NEURATH M F, MUDTER J. New endoscopicapproaches in IBD[J]. World Journal of Gastroenterology, 2011.17(1): 63-68.
[8] MARIETTA I, RALF K, XIANYONG G. Beyond white light: opticalenhancement in conjunction with magnification colonoscopy for theassessment of mucosal healing in ulcerative colitis[J]. Endoscopy,2017. 49(6):553-559.
[9] ENTCHO K, RAJA A, ARNDT H. Magnification endoscopy withoptical chromoendoscopy shows strong correlation with histologicinflammation in patients with inflammatory bowel disease[J]. EndoscInt Open, 2019. 7(8): E1018-E1026.
[10] KIESSLICH R, BURG J, VIETH M, et al. Confocal laser endoscopyfor diagnosing intraepithelial neoplasias and colorectal cancer invivo[J]. Gastroenterology, 2004. 127: 706–713.
[11] NEUMANN H, VIETH M, RAITHEL M, et al. Confocal laserendomicroscopy for the in vivo detection of intraepithelial neoplasiain Peutz-Jeghers polyps[J]. Endoscopy, 2010. 42:E139–E140.
[12] HELMUT N M D, MICHAEL V M D, et al. Endocytoscopy AllowsAccurate In Vivo Differentiation of Mucosal Inflflammatory Cells inIBD: A Pilot Study[J]. Inflamm Bowel Dis, 2013. 19(2):356-362.
[13] TOGASHI K, NEMOTO D, UTANO K, et al. Blue laser imagingendoscopy system for the early detection and characterizationof colorectal lesions:a guilde for the endoscopist[J]. Therap Adv Gastrornterol, 2016. 9:50-56.
[14] NAOHISA Y, NOBUAKI Y, YUTAKA I, et al. Ability of a novelblue laser imaging system for the diagnosis of colorectal polyps[J].Digestive Endoscopy, 2014. 26: 250–258.
[15] PARAMBIR S . DULAI, WILLIAM J . Sandborn, and SamirGupta. Colorectal cancer and dysplasia in inflammatory boweldisease: a review of disease epidemiology, pathophysiology, andmanagement[J]. Cancer Prev Res (Phila), 2016. 9(12): 887–894.
[16] SILVIO D . Inflammation and the mucosal microcirculation ininflammatory bowel disease: the ebb and flow[J] . Curr OpinGastroenterol, 2007. 23(4):384-389.
[17] LIVIJA D, CARMEN C, STEFANIA V. Multiple pathogenic rolesof microvasculature in inflammatory bowel disease: a Jack of alltrades[J]. Am J Pathol, 2008. 172(6):1457- 1466.
[18] PAUL R, SEVERINE V, GERT V A . Mucosal healing ininflammatory bowel disease: impossible ideal or therapeutic target?[J]. Gut, 2007. 56(4): 453–455.
[19] HUGH J F. Use of the Crohn’s disease activity index in clinicaltrials of biological agent[J]. World J Gastroenterol, 2008. 14(26):4127–4130.
[20] NADIA M V, MARK S, MAHMOUD H M, et al. Endoscopic scoringindices for evaluation of disease activity in ulcerative colitis[J].Cochrane Database Syst Rev, 2018(1): CD011450.
[21] REENA K, SIGRID A N, BRIAN G F. Et al. Endoscopic scoringindices for evaluation of disease activity in Crohn’s disease[J].Cochrane Database Syst Rev, 2016(8): CD010642.
[22] SIPPONEN T, NUUTINEN H, TURUNEN U, et al. EndoscopicEvaluation of Crohn’s Disease Activity: Comparison of the CDEISand the SES-CD[J]. Inflflamm Bowel Dis, 2010. 16(12):2131-2136.
[23] DAPERNO M, D’HAENS G, ASSCHE G, et al. Development andvalidation of a new, simplified endoscopic activity score for Crohn’sdisease: the SES-CD[J]. Gastrointestinal Endoscopy, 2004. 60(4):505-512.
[24] IACUCCI M, KIESSLICH R, GUI X, et al. Beyond white light:optical enhancement in conjunction with magnification colonoscopyfor the assessment of mucosal healing in ulcerative colitis[J] .Endoscopy 2017. 49: 553–559
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/57111.html