SCI论文(www.lunwensci.com):
【摘要】 目的:观察阿帕替尼联合紫杉醇治疗老年晚期非小细胞肺癌(NSCLC)患者的效果。方法: 回顾性分析 2018 年 3 月至 2019 年 4 月该院收治的 84 例老年晚期 NSCLC 患者的临床资料,按照治疗方法不同将其分为观察组与对照组各 42 例。对照组采用紫杉醇 单药化疗, 观察组在对照组基础上联合阿帕替尼治疗, 比较两组疾病控制率、不良反应发生率、治疗前后血清肿瘤标志物[癌胚抗原(CEA)、 血管内皮生长因子(VEGF)、细胞角蛋白 19 片段(CYFRA21-1)] 水平、中位无疾病进展生存期(PFS) 和总生存期(OS)。 结果: 观 察组疾病控制率为 71.43%(30/42), 高于对照组的 47.62%(20/42), 差异有统计学意义(P<0.05) ;两组不良反应发生率比较,差异均 无统计学意义(P>0.05); 治疗后, 观察组血清 CEA、VEGF 和 CYFRA21-1 水平均低于对照组, 差异有统计学意义(P<0.05); 观察组 中位 PFS 和 OS 均长于对照组,差异有统计学意义(P<0.05)。 结论: 阿帕替尼联合紫杉醇治疗老年晚期 NSCLC 患者可提高疾病控制率, 降低血清肿瘤标志物指标水平,以及延长生存期,其效果优于单纯紫杉醇治疗。
【关键词】 阿帕替尼;紫杉醇;非小细胞肺癌;癌胚抗原;不良反应;生存期
Effects of Apatinib combined with Paclitaxel in treatment of elderly patients with advanced non-small cell lung cancer
LU Mingyue
(1st Department of Oncology of Jiamusi Tumor Tuberculosis Hospital, Jiamusi 154007 Heilongjiang, China)
【Abstract 】 Objective: To observe effects of Apatinib combined with Paclitaxel in treatment of elderly patients with advanced non-small cell lung cancer (NSCLC). Methods: The clinical data of 84 elderly patients with advanced NSCLC treated in this hospital from March 2018 to April 2019 were retrospectively analyzed, and they were divided into observation group and control group according to different treatment methods, 42 cases in each. The control group was treated with Paclitaxel single-agent chemotherapy, while the observation group was treated with Apatinib on the basis of that of the control group. The disease control rate, the incidence of adverse reactions, the serum tumor marker levels [carcinoembryonic antigen (CEA), vascular endothelial growth factor (VEGF) and cytokeratin- 19-fragment (CYFRA21- 1)], the median progression-free survival (PFS) and the overall survival (OS) were compared between the two groups before and after the treatment. Results: The disease control rate in the observation group was 71.43% (30/42), which was higher than the control group of 47.62% (20/42), and the difference was statistically significant (P<0.05). There was no significant difference in the incidence of adverse reactions between the two groups (P>0.05). After the treatment, the serum levels of CEA, VEGF and CYFRA21- 1 in the observation group were lower than those in the control group, and the differences were statistically significant (P<0.05). Further, the median PFS and OS of the observation group were longer than those of the control group, and the differences were statistically significant (P<0.05). Conclusions: Apatinib combined with Paclitaxel in the treatment of the elderly patients with advanced NSCLC can improve the disease control rate, reduce the serum tumor marker levels, and prolong the survival period. Moreover, it is superior to single Paclitaxel treatment.
【Keywords】 Apatinib; Paclitaxel; Non-small cell lung cancer; Carcinoembryonic antigen; Adverse reaction; Survival period
非小细胞肺癌(NSCLC)为临床常见的呼吸系 统恶性肿瘤, 占原发性肺癌(PLC) 的 80%~85%, 好发于老年人群 [1]。因早期缺乏特异性表现,多数 老年 NSCLC 患者确诊时已处于中晚期,此时癌灶 多会侵犯邻近组织器官, 直径较大或伴淋巴结转移, 不符合外科手术指征, 故主要采用化疗方式治疗 [2]。 含铂双药化疗为当前晚期 NSCLC 的常用手段,但老年患者因全身脏器机能和免疫功能衰退,且多数 合并基础疾病,难以耐受其带来的不良反应,故多 采用紫杉醇单药化疗,但有效率仅 16%~27%,整 体预后欠佳 [3-4]。阿帕替尼为酪氨酸激酶血管生长 因子受体 -2(VEGFR-2)生长抑制剂,可选择性 抑制肿瘤血管生成,促进肿瘤细胞凋亡 [5]。本文观 察阿帕替尼联合紫杉醇治疗老年晚期 NSCLC 患者 的效果。
1 资料与方法
1.1 一般资料 回顾性分析 2018 年 3 月至 2019年 4 月本院收治的 84 例老年晚期 NSCLC 患者的 临床资料。纳入标准:经病理学检查确诊,符合 《原发性肺癌诊疗规范(2018 年版) 》中 NSCLC 相关诊断标准 [6] ;临床分期为Ⅲ B~ Ⅳ期;卡氏评 分 >70 分;预计生存时间≥ 3 个月;有明确的可 测量病灶;入组前未接受相关治疗。排除标准:肿 瘤部位有结核;有出血倾向;有症状的脑转移或神 经系统疾病;严重营养不良、体质差不耐受化疗; 合并肝肾损伤不宜使用紫杉醇;中性粒细胞低于 1500 个 /mm3。按照治疗方法不同将其分为观察组 与对照组各 42 例。观察组男 26 例,女 16 例;年 龄 61~82 岁, 平均(63.87±6.37) 岁; 临床分期: Ⅲ B 期 27 例, Ⅳ 期 15 例; 腺癌 24 例, 鳞癌 17 例,腺鳞癌 1 例。对照组男 25 例,女 17 例;年 龄 61~82 岁, 平均(63.92±6.39) 岁; 临床分期: Ⅲ B 期 26 例, Ⅳ期 16 例;腺癌 24 例, 鳞癌 16 例, 腺鳞癌 2 例。两组一般资料比较,差异无统计学意 义(P>0.05),有可比性。
1.2 方法 对照组采用紫杉醇注射液(山西普德药 业有限公司, 国药准字 H20053005, 5 mL ∶ 30 mg) 治疗, 将 175 mg/m 紫杉醇溶于 5002 mL 0.9% 氯化 钠注射液中,静脉滴注 3 h,每隔 21 d 注射 1 次。
观察组在对照组基础上联合甲磺酸阿帕替 尼片(江苏恒瑞医药股份有限公司,国药准字H20140105, 0.425 g)口服治疗, 850 mg/次, 1次/d。 3 周为 1 个疗程,两组均治疗 3 个疗程。
1.3 观察指标 (1)比较两组疾病控制率。参考 《实体瘤疗效评价标准》评价 [7] ,完全缓解:靶 病灶均消失超过 4 周;部分缓解:靶病灶直径缩 小≥ 30% 超过 4 周;稳定:靶病灶直径缩小 <30% 超过 4 周;进展:靶病灶直径增大≥ 25%。疾病控 制率 =(完全缓解 + 部分缓解 + 稳定)例数 / 总例 数 ×100%。 (2) 比较两组不良反应发生率。(3) 比较两组治疗前后血清肿瘤标志物水平,包括癌胚 抗原(CEA)、血管内皮生长因子(VEGF) 和细 胞角蛋 白 19 片段(CYFRA21-1)。(4) 比较两 组生存期。以电话或复诊方式随访,记录中位无 疾病进展生存期(PFS,首次治疗至疾病进展或死 亡的时间)及总生存期(OS,首次治疗至死亡的 时间)。
1.4 统计学方法 应用 SPSS 21.0 软件进行统计学 分析,计量资料以( ±s )表示,采用 t 检验,计 数资料以率(%)表示,采用 χ2 检验,以 P<0.05 为差异有统计学意义。
2 结果
2.1 两组疾病控制率比较 观察组疾病控制率为 71.43%(30/42) ,高于对照组的 47.62%(20/42) , 差异有统计学意义(P<0.05)。见表 1。
2.2 两组不良反应发生率比较 两组不良反应发 生率比较,差异均无统计学意义(P>0.05)。见 表 2。
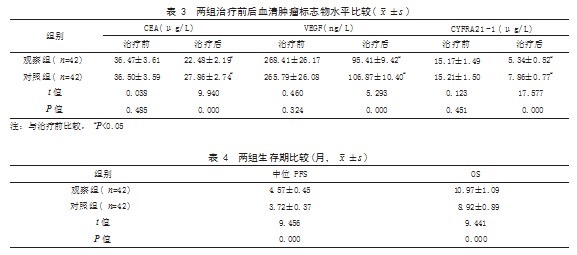
2.3 两组治疗前后血清肿瘤标志物水平比较 治 疗 前, 两 组 CEA、VEGF 和 CYFRA21-1 水 平 比 较,差异均无统计学意义(P>0.05); 治疗后, 两 组 CEA、VEGF 和 CYFRA21-1 水 平 均 低 于 治 疗前,且观察组低于对照组,差异有统计学意义 ( P<0.05)。见表 3。
2.4 两组生存期比较 观察组中位 PFS、OS 均长 于对照组,差异有统计学意义(P<0.05)。见表 4。
3 讨论
NSCLC 相较于小细胞肺癌, 恶性程度更高, 预 后更差 [8]。因 NSCLC 早期缺乏特异性表现,此时2/3 以上患者已处于Ⅲ B~ Ⅳ期, 5 年生存率 <10%[9]。 紫杉醇单药化疗是老年晚期 NSCLC 的主要化疗 方案,但存在耐药问题,整体预后欠佳 [10-11]。 阿帕替尼是 VEGFR-2 生长抑制剂,可高度选择性 竞争 VEGFR-2 的嘌呤三磷酸腺苷结合位点,使酪 氨酸激酶失活, 抑制下游信号通路传导及血管生成, 促使肿瘤细胞凋亡 [12]。
本研究结果显示,观察组疾病控制率高于对照 组, 这一结果与文献报道一致 [13]。分析原因在于阿 帕替尼与紫杉醇联合治疗可逆转癌细胞对化疗的耐 药性,协同抗肿瘤效应更佳,抑制肿瘤细胞生长、 增殖、侵袭的效果更强,故而疾病控制率更高。本 研究结果同时显示,两组不良反应发生率比较,差 异无统计学意义。提示联合阿帕替尼用药未增加安 全风险。
已知 CEA 是一种肿瘤相关抗原,恶性肿瘤患 者的血清 CEA 表达升高 [14] ;VEGF 可增加血管通 透性,为肿瘤细胞的不断增殖提供氧及养分,且 可促进肿瘤血管内皮细胞的增殖、迁移 [15-16]。 CYFRA21-1 是细胞重要的骨架蛋白成分,可提高 肿瘤细胞的骨架蛋白比例,促进其黏附、转移,并 抑制其凋亡 [17]。CYFRA21-1 可 由恶变后 的细胞 角蛋白 19 产生并释放入血循环系统,使血清中 含量升高。已知肺癌患者血清中 CEA、VEGF 和 CYFRA21-1 水平高于肺良性病变及健康者,并且 与肿瘤分期、淋巴结转移、浸润程度有关,监测其 水平有助于预测治疗效果和预后。本研究结果还显 示, 治疗后, 观察组 CEA、VEGF 和 CYFRA21-1 水平均低于对照组,中位 PFS 及 OS 均长于对照组。分析原因在于紫杉醇化疗可通过阻断肿瘤细胞 的合成而促进其凋亡,阿帕替尼可通过抑制肿瘤组 织血管生成而抑制肿瘤细胞合成、增殖,加速其凋 亡,因而两者联合可增强抗肿瘤活性,进一步减少 CEA、VEGF 和CYFRA21-1 的释放, 降低肿瘤负荷, 减少癌细胞扩散,进一步降低转移、复发风险,延 长晚期 NSCLC 患者的生存期。
综上所述,阿帕替尼联合紫杉醇治疗老年晚期 NSCLC 患者可提高疾病控制率,降低血清肿瘤标 志物水平,以及延长生存期,其效果优于单纯紫杉 醇治疗。
参考文献
[1] 王振兴,曲新栋,杨大伟,等 . 甲磺酸阿帕替尼治疗晚期非小细胞肺癌的疗效与生存分析 [J]. 国际呼吸杂志,2021,41 (14):1054-1058.
[2] Maleki P,Mowla SJ,Taheri M, et al. The role of long intergenic non-coding RNA for kinase activation (LINK-A) as an oncogene in non-small cell lung carcinoma[J]. Scientific Reports,2021,11 (1):4210.
[3] 陈汉锐,田华琴,陈志明,等 . 康艾注射液联合单药化疗治疗老年晚期非小细胞肺癌的有效性和安全性 [J]. 实用医学杂 志,2018,34(2):316-319.
[4] 况春丽,李明,郑泰浩 . 阿帕替尼治疗晚期非小细胞肺癌疗效与安全性的 Meta分析 [J]. 中国现代医学杂志, 2021,31(8):70-77.
[5] 陈萍,陈维永,张纪良 . 阿帕替尼联合多西他赛与多西他赛二线治疗晚期非鳞非小细胞肺癌的疗效、安全性及预后对 比 [J]. 现代肿瘤医学,2021,29(9):1513-1519.
[6] 中华人民共和国国家卫生健康委员会 . 原发性肺癌诊疗规范 (2018 年版)[J]. 肿瘤综合治疗 电子杂志,2019,5(3):100-120.
[7] Eisenhauer EA,Therasse P,Bogaerts J, et al. New response evaluation criteria in solid tumours:revised RECIST guideline (version 1. 1)[J]. Eur J Cancer,2009,45(2):228-247.
[8] Jonna S,Subramaniam DS. Molecular diagnostics and targeted therapies in non-small cell lung cancer (NSCLC):an update[J]. Discov Med,2019,27(148):167-170.
[9] Mohiuddin M,Kasahara K. The Mechanisms of the Growth Inhibitory Effects of Paclitaxel on Gefitinib-resistant Non-small Cell Lung Cancer Cells[J]. Cancer Genomics Proteomics,2021, 18(5):661-673.
[10] 文慧,彭彦才,艾葆春,等 . 阿帕替尼联合紫杉醇对非小 细胞肺癌患者的疗效及血清因子的影响 [J]. 药物评价研究, 2019,42(9):1810-1813.
[11] 李森,任敏,饶汕,等 . 甲磺酸阿帕替尼与吉西他滨联合化 疗治疗非小细胞肺癌的疗效分析 [J]. 国际呼吸杂志,2021, 41(20):1545-1550.
[12] 刘佳,潘雪峰,郑国宝 . 甲磺酸阿帕替尼联合紫杉醇对晚期 非小细胞肺癌疗效及对血清肿瘤标志物的影响 [J]. 山西医药 杂志,2021,50(5):784-786.
[13] 常文龙, 赵静, 蔡会欣, 等 . 血清 CEA、CYFRA21-1、TPS和 IL-33 在老年非小细胞肺癌病人中的表达水平及临床意 义 [J]. 实用老年医学,2020,34(3):241-245.
[14] 刘 文 楼, 王 红 梅, 秦 晓 冰, 等 . 血 清 HE4、VEGF、 CYFRA21-1 联合检测在非小细胞肺癌诊断中的意义及其与临床病理特征的关系 [J]. 徐州医科大学学报,2020,40(9):625-630.
[15] Eguchi R,Wakabayashi I. HDGF enhances VEGF-dependent angiogenesis and FGF-2 is a VEGF-independent angiogenic factor in non-small cell lung cancer[J]. Oncol Rep,2020,44(1):14-28.
[16] 朱超男,陆学荣,郑贸根,等 . 非小细胞肺癌患者中 SCCAg、ProGRP 及 CYFRA21-1 的表达水平及诊断价值分析 [J]. 癌症 进展,2019,17(15):1796-1799.
[17] 李玲, 谢明水, 邓涛, 等 . 血清 CEA、SCCA、CYFRA21-1对非小细胞肺癌和 5 年预后的联合诊断价值 [J]. 湖北医药学 院学报,2021,40(4):332-337.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/46613.html