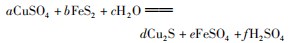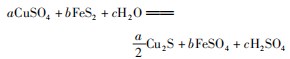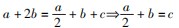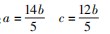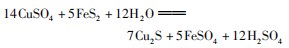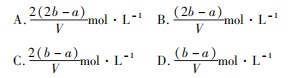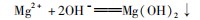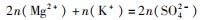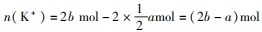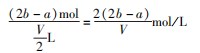SCI论文(www.lunwensci.com):
摘要:守恒法是高中化学经常采用的用于解决计算题的一种方法.它包括质量守恒、元素原子守恒、得失电子守恒和电荷守恒四个方向.在高中化学计算题的解题过程中,学生要根据题设条件,灵活变通,找准守恒关系,进而根据守恒关系准确列式求解,节约解题时间,提高解题效率.
关键词:守恒法;计算题;高中化学
“守恒法”是高中化学阶段常见的一种技巧性解题方法之一,也是高考中常用的解题方法和解题技巧.化学反应通常包括“变化”及“不变”的守恒思想,在实际解题过程中,可以通过学习把握化学中的“不变”思想,优化解题思路,提高解题效率.在高中化学阶段常接触到的守恒思想包括:质量守恒、元素原子守恒、得失电子守恒,以及电荷守恒四个方向.
1质量守恒
质量守恒是指在宏观意义上,各个元素质量反应前后相等.这一守恒关系常见与题目中给予质量关系较多,可以使用质量守恒定律去寻求守恒关系的题目.学生在实际解题过程中,首先需要明确求解量,其次根据提示条件找出守恒关系,进而列式求解.
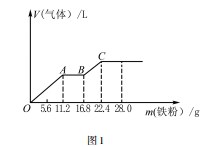
例1向200 mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图1所示(已知硝酸只被还原为NO气体).下列分析正确的是().
A.OA段、BC段产生的气体都是NO
B.A点溶液中的溶质为Fe(NO3)2和H2 SO4
C.原混合酸中H2 SO4的物质的量浓度为1 mol·L-1
D.向C点溶液中再加入足量的稀硝酸,仍然能生成NO
分析D正确.A选项,已知氧化能力:
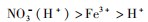 ,OA段发生反应:
,OA段发生反应:
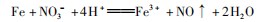
AB段发生反应:
BC段发生反应:
故OA段生成的气体为NO,BC段生成的气体为H2,故A错误;B选项,OA段发生反应:
A点溶液中NO3-恰好完全反应,硫酸有剩余,A点溶液中溶质为H2 SO4、Fe2(SO4)3,故B错误;C选项,最终消耗22.4 g Fe,此时溶液中溶质为FeSO4,
根据铁元素守恒可得
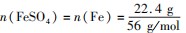 =0.4 mol,再根据硫酸根守恒,可知原溶液中n(H2 SO4)=n(FeSO4)=0.4mol,则原混合酸中H2 SO4的物质的量浓度为
=0.4 mol,再根据硫酸根守恒,可知原溶液中n(H2 SO4)=n(FeSO4)=0.4mol,则原混合酸中H2 SO4的物质的量浓度为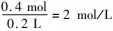 ,故C
,故C错误;D选项,C点溶液中溶质为FeSO4,加入足量的稀硝酸,酸性条件下硝酸根离子与亚铁离子反应,有NO生成,D正确.
题后反思本题是质量守恒的图像题.通过分析题目中的所给条件可以快速判断出可以通过质量守恒关系,列出等式,进而求解.通过分析图像所给出的条件,可以判断出在各个阶段会发生的化学反应,再根据酸和金属的化学反应特征找准等量关系,进而求解.在利用质量守恒关系有关的题目时,要把握质量不变和质量相等的守恒关系,理清m(A)=m(B),进而列式求解.
2元素原子守恒
元素原子守恒是指微观粒子个数,比如原子、离子等,在反应前后是相等的.在利用元素原子守恒求解的过程中,要把握反应前后,哪些微粒存在相等关系或个数不变的规律,进而找出对应关系式,求解原题.
例2将一定量铜粉与一定量的浓硫酸反应,当铜粉完全反应时,收集到3.36 L气体(标准状况),则消耗硫酸的物质的量是().
C.0.30mol
D.0.40mol
分析选C.分析题意可知收集的气体为SO2,
即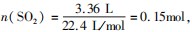 根据电子转移守恒可知
根据电子转移守恒可知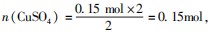 再根据硫原子守恒可知n(H2 SO4)=n(SO2)+n(CuSO4)=0.15 mol+0.15 mol=0.3 mol,C正确.
再根据硫原子守恒可知n(H2 SO4)=n(SO2)+n(CuSO4)=0.15 mol+0.15 mol=0.3 mol,C正确.
题后反思本题重点在于利用化学方程式和原子守恒定律求解所消耗硫酸的物质的量.本题除了利用硫原子反应前后守恒之外,还使用了电子转移守恒定律,需要学生灵活判断.提高自己的解题效率.3得失电子守恒得失电子数守恒主要应用于氧化还原反应,它是针对氧化还原反应中氧化剂得电子的总数等于还原剂失电子的总数.这一等量关系仅能用于氧化还原反应中,也是解决氧化还原反应问题的最佳思路,学生在面对此类型的化学反应时,要注意观察,着重使用,节约解题时间.
例3已知反应
每当有6 mol H2 O参加反应时,转移电子数为().
A.9.5NA B.10.5NA C.1 1.5NA D.12.5NA
分析选B.根据反应前后原子守恒,可将化学方程式改写为:
根据化学方程式可以列出以下等式:
①根据硫原子守恒:
②根据氧原子守恒:
4a+c=4b+4c⇒4a=4b+3 c
联立上述两式可得
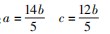
将a和c代入化学方程式可得:
再根据化合价变化规律:化合价下降的总数:反应前FeS2中的化合价为-1价,其中有7个变为-2价;反应前C u为+2价,反应后为+1价,所以下降总数为2 1.化合价上升的总数:反应前FeS2中的化合价为-1价,其中有3个变为+6价,所以上升总数也为2 1.从化学方程式可以看出当反应有1 2 mol H2 O参与反应时转移2 1 mol电子,所以当反应6 mol H2 O时转移电子数为1 0.5 mol,即1 0.5NA.
题后反思本题中的关键信息在于把握题设中的已知条件.通过常见元素的化合价以及氧化还原反应过程中的配平关系,以及氧化还原反应中得失电子守恒判断得出等量关系式,进而求解.学生在利用得失电子守恒关系求解氧化反应类型的题目时,首先需要把握氧化剂的得电子总数以及还原剂的失电子总数,进而列出得电子数等于失电子数的关系式,最后求解.在解决这类问题时,学生要明确求解量,方便找准关系式,提高解题正确率.
4电荷守恒
电荷关系守恒也是守恒关系中应用较广的一种,它主要是指在电解质溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等,这是根据溶液始终呈电中性所得出来的等量关系.这一守恒关系常见于求解溶液中,学生可以灵活把握.
例4某混合溶液中,含有K+、Mg2+、Al3+、Cl-和SO4 2-五种离子(不考虑溶液中少量的H+和OH-),其中c(K+)=3 mol/L、c(Mg2+)=2mol/L、c(Al3+)=2 mol/L、c(Cl-)=7 mol/L,则溶液中SO-的物质的量浓度是().
分析电解质溶液中存在电荷守恒,所以有c(K+)+2c(Mg2+)+3 c(Al3+)=c(Cl-)+2c(SO-),列出等量关系式得3 mol/L+2×2 mol/L+3×2mol/L=7 mol/L+2n,解之n=3 mol/L,故溶液中SO-的物质的量浓度是3 mol/L.
题后反思本题是电荷守恒的基础题,展示的守恒关系较为明显.根据混合溶液呈电中性的原则,我们可以较快地列出溶液中正电荷数量等于溶液中负电荷数量这一等量关系式,进而列式求解,难度较低,属于基础题型,学生需要重点掌握.
例5把V L含有MgSO4和K2 SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的物质的量浓度为().
分析A正确.分析题意可知,混合溶液分成两等份时,每份溶液浓度与原溶液浓度相同,一份加氢氧化钠溶液时发生反应:
另一份加BaCl2的溶液有反应:
根据电荷守恒每份中:
故每份中溶液
故原溶液中钾离子浓度为:
A正确.
题后反思本题主要考查离子反应中的混合溶液计算,需要根据电荷守恒计算出钾离子的物质的量.首先在分析题目时可以发现,两等份溶液中的浓度是相等的,并且根据反应物的不同、离子方程式的不同,所得出的生成物的物质的量也是不同的,但可以通过电荷守恒判断得出每份溶液中钾离子的物质的量,进而根据浓度等于物质的量除以体积计算得出钾离子的浓度.本题属于中档题,需要学生根据不同的化学反应灵活计算,学生要重点掌握.
参考文献:
[1]邹美灵.守恒法在高中化学解题中的应用分析[J].数理化学习(高中版),2014(9):2.
[2]刘霞.守恒法在高中化学解题中的应用分析[J].中学化学教学参考,2016(9X):1.
[3]张正民.浅析守恒法在高中化学解题中的应用[J].中学生数理化(高考理化),2014(12):1.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/44735.html

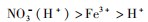 ,OA段发生反应:
,OA段发生反应: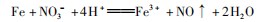
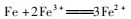
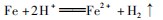
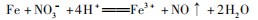
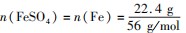 =0.4 mol,再根据硫酸根守恒,可知原溶液中n(H2 SO4)=n(FeSO4)=0.4mol,则原混合酸中H2 SO4的物质的量浓度为
=0.4 mol,再根据硫酸根守恒,可知原溶液中n(H2 SO4)=n(FeSO4)=0.4mol,则原混合酸中H2 SO4的物质的量浓度为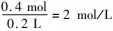 ,故C
,故C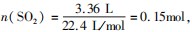 根据电子转移守恒可知
根据电子转移守恒可知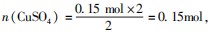 再根据硫原子守恒可知n(H2 SO4)=n(SO2)+n(CuSO4)=0.15 mol+0.15 mol=0.3 mol,C正确.
再根据硫原子守恒可知n(H2 SO4)=n(SO2)+n(CuSO4)=0.15 mol+0.15 mol=0.3 mol,C正确.