摘要:化学是高考中的一个重点学科,主要检测学生对化学知识的掌握运用能力与学科核心素养。在日常教学中,教师既要关注理论知识的讲授,还需开设解题训练,为他们提供更多运用所学知识处理化学问题的机会,使其整体学习效果得以改善。在高中化学解题教学中,教师除教给学生一些常用的解题方法以外,还要指导他们学会应用守恒法,使其解题效率更高。文章针对高中化学解题中如何应用守恒法作探讨,并分享部分解题实例。
关键词:高中化学解题,守恒法
在千变万化的自然界中,守恒可谓是无处不在,化学是一门以研究物质结构、性质、变化及用途的自然学科,守恒在化学学习中十分常见,一切化学反应都遵循守恒定律。高中化学教师在解题教学中应根据实际情况指导学生使用守恒法,无需纠缠化学反应过程与细节,不用考虑途径变化,只需考虑到反应中某些组分相互作用前后某些物理量或者化学量的形态变化,使其巧解、速解化学题目,帮助他们养成良好的化学思维,促进高考成绩的提高。
一、守恒法的优点与特点
守恒法的主要优点即为通过现象抓本质,由此把握好题目中不会发生变化的因素,将这些数据舍弃掉,删除部分较为繁杂的数字计算,把解题过程变得简单化,降低错误出现的概率,由此表明守恒法是一种优势多多的典型解题方法。守恒法并非对具象化知识点的描述,也不是一些化学式的组合,而是对化学知识核心概念及原理的具体体现。在高中化学解题教学中,教师可指导学生通过类比、概括与归纳相关化学知识,顺利得出各种物质之间的关系式,当他们学会采用守恒法解题以后,也会更加容易理解化学中的守恒观念。学生在解题中应用守恒法,可以延伸至整个化学课程学习当中,增强他们的化学认知。而且一旦守恒观念形式,学生就会深度理解化学知识,学会举一反三,提升他们归纳化学知识的能力,使其更好地理解化学原理,促进知识的学以致用。
通过对守恒法的分析、研究与实践可知,主要具有以下几个特点:首先,广泛性,质量、电荷、能量这三个守恒定律几乎涉及所有物质,具体到化学反应中来说,无论经历多么复杂的化学反应与物质变化,反应物与生成物均不会同这三个守恒定律相悖,而且在化学反应过程中,电荷、质量与能量总和均不会发生变化,这表明守恒法在高中化学解题中有着极为广泛的应用空间;其次,简便性,在高中化学解题中,解答过程往往具有复杂与严谨的特征,不同题目的解题思路与计算公式同样有所差异,学生应用守恒法时,只需精准把握好化学反应前后之间的守恒关系,就可以有效解决相关化学试题;最后,易于理解,在高中化学解题中采用守恒法,同其他解题方法相比较,内容上表现得更为简单,表达形式也较为简单,学生使用时理解起来更为容易,有助于他们解题准确度与速度的同步提升。
二、守恒法在高中化学解题中的具体应用
(一)应用元素守恒法解答高中化学试题
元素守恒又称之为物料守恒,指的是参加化学反应前后组成物质的元素种类不会发生变化,原子的总数量始终保持不变,能够简单地理解成元素动态变化或者不发生变化,在化学反应整个过程中,虽然某一元素会同其他元素相结合生成新的化学物质,不过元素本身的质量或者物质的量不会发生变化,改变的只是该元素表现而出的一种形式。高中化学教师可指引学生应用元素守恒法解答试题,让他们把握好元素种类不会发生变化的这一基本特征。
例1:这里有一包混合物,已知这包混合物是包含着氧化钙与碳酸钙两种成分,经过实验分析以后得到钙元素在这包混合物中所占的质量分数是80%,现在从中取出20克的样品,把样品放入高温炉中进行煅烧,煅烧以后把剩余的固体物质放到蒸馏水里面,如果这些固体物质最终都变成氢氧化钠,那么一共生成的氢氧化钙质量是多少?
解析:这是一道明显的有关元素守恒的试题,假如使用常规的解题方法,那么就需要写出整个化学反应中各个步骤的反应方程式,以至于把一道简单的化学试题变得复杂化与繁琐化,而运用元素守恒法重新分析题目内容则能够将解题过程变得简单化,只是需要把这个化学反应体系中钙元素的存在形式逐步列举出来,即为:氧化钙/碳酸钙——氧化钙——氢氧化钙。在解题过程中,教师可提示学生结合钙元素所存在的守恒关系,先结合钙元素所占的质量比重计算出相应的质量,使其通过质量计算出相应物质的量,让他们轻松计算出氢氧化钙这种物质的质量。
(二)采用电荷守恒法解答高中化学试题
在物理与化学变化当中,电荷是无法被创造而出的,当然也不会被消灭掉,通俗来讲,在化学反应中,反应物的电荷总数与生成物的电荷总数一样,在电解质溶液中,阴离子所携带的负电荷同阳离子所携带的正电荷总数保持一致。在高中化学解题教学中,教师指导学生采用电荷守恒法时需从整体视角把握好化学反应前后阴、阳离子的种类与数目变化情况,他们应仔细阅读题目,透彻理解题意,理清反应原理,使其掌握反应前后离子的变化情况。
例2:在常温环境下,将氨水滴入到盐酸当中,当c(NH4+)=c(cl-)时,该混合溶液的pH值是()
A、大于7 B、小于7
C、等于7 D、难以判断
解析:大部分学生读完题目内容以后,发现题干中提供的信息较少,一时之间无法下手,很难找到解题的切入点,他们认为这一混合溶液的pH值难以判断,容易把正确答案当作选项D,如果简单地认为只是把弱碱滴入到强酸当中,会选择B选项,这两个选项都是不正确的。这时教师可提示学生基于电荷守恒法视角切入,具体解答方式如下:
(三)用化合价守恒法解答高中化学试题
化合价守恒即在混合物或者化合物当中,物质的正负化合价绝对值是保持一致的,在电解过程中,各个电极上析出物质的总价数同样是守恒关系。任何化学物质都具有化合价,且同电荷一样都有正负之分,在一个化学反应中,正负化合价的物质数量是一样的,只有这样才可以让反应处于平衡状态。高中化学教师可指引学生用化合价守恒法解答部分试题,使其通过对化合价的正负相抵就能够轻松获得这些题目的结果,让他们学会简化解题过程。
例3:这里有30mL的碳酸钠溶液,现在把这些溶液同70mL的浓盐酸完全中和以后,再把溶液同多量的盐酸及氢氧化钠展开混合,其中能够判断出来的是,浓盐酸的物质的量浓度是1 mol/L,氢氧化钠的物质的量浓度为2 mol/L,当氢氧化钠的体积达到5mL时,溶液会由中性转变成酸性,假如把浓度一样的浓盐酸替换成浓硫酸溶液,且把氢氧化钠替换为氨水,溶液刚好可以达到平衡状态,那么题目中碳酸钠的物质的量为多少?
解析:本道题目内容比较冗长,不少学生读完以后都会觉得枯燥乏味,甚至部分同学会掉入到题设的陷阱当中,可能会被绕晕放弃这道题。其实处理这一题目时,只要逐步、逐步地展开分析,再配合化合价守恒法的使用就能很好地解决掉。具体来说,学生可先把题目中要求的碳酸钠的物质的量设成一个未知数x,分析题目中有关化合价的守恒之处,使其据此获得一个有关未知数x的方程,他们再通过解方程的方式求出未知数x的值,这样题目就迎刃而解,最终轻松求出准确的结果。
(四)使用质量守恒法解答高中化学试题
质量守恒属于化学反应中最为常见的一种守恒,指的是化学反应发生前后各种物质的质量总量保持守恒,参加反应前各种物质的质量与反应之后各种生成物的质量是相等关系,之所以会出现这种情况,主要原因在于化学反应发生前后原子种类、质量与数目均不会发生变化。高中化学教师指引学生使用质量守恒法解答试题时,既能够基于宏观视角上的质量不发生变化切入,还可以基于微观视角上的原子数目保持不变来解题,拓展他们的解题思路。
例4:把20.8g的铜与氧化铜混合物加入50mL 18.4mol/L的浓硫酸当中,加热后充分反应至所有固体物体都溶解掉,产生的气体则全部逸出,冷却后把溶液稀释至1000mL,测出c(H+)=0.84mol/L,假如全部沉淀稀释溶液中的Cu2+,要加入6mol/L的氢氧化钠溶液的体积是()
A、100mL B、160mL C、240mL D、307mL
(五)利用能量守恒法解答高中化学试题
在任何一个化学反应体系中,该体系的能量始终是守恒关系,能量既不会凭空产生,也不会凭空消失。任何化学反应都遵循能量守恒,不同的是化学反应能量变化是通过吸热与放热来体现而出的。在高中化学解题训练环节,教师带领学生处理同能量相关的题目时需要考虑到能量守恒问题,利用能量守恒法把解题程序作简化处理,使其结合所学知识准确计算出参加化学反应的反应物与生成物键能之和,促使他们结合差值得出吸收与放出的热量。
(六)借助电子守恒法解答高中化学试题
电荷守恒法通常在氧化还原类的题目中运用,主要原因在于在氧化还原反应中总是伴随着电子得失现象,当某种化学物质得到一些电子时,相应的就有另外一种物质失去数量相同的电子,双方的得失电子总数保持平衡,是对等的。在高中化学解题训练中,教师可引领学生借助电子守恒法分析与处理试题,无需考虑化学反应的具体过程,只要把侧重点放在反应的最终结果上面即可,找到哪些原子的数量发生变化,让他们列出相应的式子就能解决。
例5:现在有一定浓度的硝酸,硫化亚铁与硝酸会发生化学反应,生成的物质有水、硝酸铁与硫酸铁,而且生成的二氧化氮、四氧化二氮、一氧化氮的物质的量之比是1∶1∶1,那么在反应物中各物质的量的比是什么?
解析:读完题目内容以后,教师需启发学生深入思考,使其发现本道题目中发生的化学反应是一个典型的氧化还原反应,能够运用电子守恒法来解答,在氧化还原反应中,电子数量的得失情况是一样的,在这道题目中,硫化亚铁与硝酸这两种物质参与到得失电子反应当中,这时可以设硫化亚铁的物质的量是a,硝酸的物质的量是b,结合电子得失守恒规律,能够得到关系式a×(1+8)=(b÷4)×1+(b÷4)×2+(b÷4)×3,则b=6a,由于硝酸会发挥出自身酸性的作用,硝酸为硝酸铁物质的量的三倍,则3×
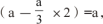
这样能够求出硝酸同硫化亚铁两者之间物质的量之比。
三、结语
在高中化学解题教学实践中,教师应充分意识到应用守恒法的必要性、便利性与实效性,指导学生根据具体题目有针对性地使用元素守恒法、电荷守恒法、化合价守恒法、质量守恒法、能量守恒法、得失电子守恒法等,使其在守恒法助力下快速找到题目中的关键信息,有效提升他们分析与处理化学问题的能力,继而以积极心态迎接未来高考。
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/80009.html



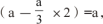 这样能够求出硝酸同硫化亚铁两者之间物质的量之比。
这样能够求出硝酸同硫化亚铁两者之间物质的量之比。