SCI论文(www.lunwensci.com):
摘要:目的用不同方式及剂量的TNF-α干预哮喘小鼠,研究其肺组织TNF-α受体(TNF-αR)、CysLTs受体1(Cysteinyl leukotriene receptor 1,CysLTR1)的表达。方法48只小鼠分为正常对照组(A组)、哮喘非干预组(B组)、TNF-α低剂量腹腔给药组(C1组),高剂量腹腔给药组(C2组),TNF-α低剂量雾化组(D1组),高剂量雾化组(D2组)。分别采用免疫组化法(IHC)检测TNF-αR,WB检测肺组织中CysLTR1表达情况。结果(1)IHC测TNF-αR阳性细胞计数分别为:20.1079±1.115、25.832±3.240、38.324±5.102、53.366±5.774、44.037±4.102、55.372±7.536。除C2组和D2组外,其余任意两组间差异均有统计学意义(P<0.05);(2)WB检测CysLTR1蛋白相对密度分别为0.797±0.081、1.422±0.97、1.784±0.210、2.448±0.096、2.023±0.058、2.933±0.034,除B组和C1组、C2组和D2组外,其余任意两组间差异均有统计学意义(P<0.05)。结论TNF-α使哮喘小鼠肺组织表达TNF-αR、CysLTR1增多,可能使抗TNF-α治疗受益于哮喘治疗。
关键词:哮喘;半胱氨酰白三烯受体1;肿瘤坏死因子-α
本文引用格式:宋晓丹,张世杰,欧维琳,等.TNF-α对哮喘小鼠肺组织表达TNF-αR、CysLTR1的影响[J].世界最新医学信息文摘,2019,19(42):170-172.
The Effect of Tumor Necrosis Factor Alpha on Expression of TNF-αR、CysLTR1 in Mouse Lung Tissue SONG Xiao-dan#,ZHANG Shi-jie#,OU Wei-lin*,ZHENG Wei-hua,WANG Chang-ying,WANG Dan,ZHANG Si-xuan(The Affiliated Hospital of Guilin Medical University,Guilin Guangxi)
ABSTRACT:Objective To investigate the expression of TNF-αreceptor(TNF-αR)、Cysteinyl leukotriene receptor 1(CysLTR1)in lungs in asthma mice model and to explore the role of TNF-αplayed in asthma pathogenesis.Methods 48 BALB/c mice were randomly assigned into normal control(A group),asthma group(B group),inhaled low dose TNF-αgroup(C1 group)、inhaled high dose TNF-αgroup(C2 group)、injected low dose TNF-αgroup(D1 group)and injected high dose TNF-αgroups(D2 group)(n=8 each).The mice were sensitized with ovalbumin to establish the asthmatic model.Immunohistochemistry(IHC)and western blotting(WB)were performed to detect the expression of TNF-αR、CysLTR1 receptively in all groups.Results(1).IHC TNF-αR positive cells count in different groups as follows:20.1079±1.115、25.832±3.240、38.324±5.102、53.366±5.774、44.037±4.102、55.372±7.536.The difference betweenC2 and D2 had no statistical differences,any differences between the rest of two groups were statistically significant(P<0.05).(2).The relative density of CycLTR1 detected by WB in each group are 0.797±0.081,1.422±0.97,1.784±0.210,2.448±0.096,2.023±0.058,2.933±0.034,The difference between B and C1,C2 and D2 had no statistical difference,any differences between the rest of two groups were statistically significant(P<0.05).Conclusions TNF-αescalates the expression of TNF-αR、CysLTR1 in lung tissue,and that positively related with the dosage of TNF-α,so anti-TNFαwould be a new research direction.
KEY WORDS:Asthma;Cysteinyl leukotriene receptor 1;TNF-α
0引言
支气管哮喘为多种细胞因子及介质参与,形成气道慢性炎症、气道高反应性甚至气道重塑等。已被研究的细胞因子较多,其中TNF-α和半胱氨酰白三烯(Cysteinyl leukotriene,CysLTs)是参与哮喘发生、发展的重要细胞因子,TNF-α作为一种前细胞炎性因子,可诱导细胞产生一系列细胞因子,从而趋化嗜酸性粒细胞释放CysLTs等炎性介质,引起上皮细胞脱落等改变,促进气道慢性炎症的产生,最近更有研究发现TNF-α与难治性哮喘有关。同时在炎性细胞释放的介质中,CysLTs能促进炎性细胞游走渗出、促进骨髓嗜酸性粒细胞增生,并参与气道重塑等,但CysLTs的生物活性均需与靶细胞膜表面的半胱氨酰白三烯受体1(Cysteinyl leukotriene receptor 1,CysLTR1)结合而完成。本实验观察TNF-α对哮喘小鼠肺组织CysLTR1表达的影响,探讨TNF-α除诱导炎性细胞释放CysLTs外,是否上调细胞表达CysLTR1,从而加剧CysLTs在哮喘气道炎症、气道高反应性以及气道重塑等方面的作用。
1材料与方法
1.1材料
1.1.1实验动物及分组
SPF级健康雌性Balb/c小鼠48只,4-6周龄,体质量18-25g。随机分为6组:正常对照组(A组)8只,哮喘模型非干预组(B组)8只,哮喘+TNF-α低剂量腹腔注射给药组8只(C1组,0.1g/kg),哮喘+TNF-α高剂量腹腔注射给药组8只(C2组,0.4g/kg,),哮喘+TNF-α低剂量雾化吸入给药组8只(D1组,0.2g/l),哮喘+TNF-α高剂量雾化吸入给药组8只(D2组,0.5g/l)。
1.1.2主要实验试剂
鸡卵白蛋白(OVA)(美国SIGMA公司,批号:00M7012V),重组人肿瘤坏死因子-α(Novoprotein公司,批号:0328985),高纯总RNA快速提取试剂盒(Generay公司),逆转录试剂盒(Fermentas公司)qPCR试剂IQ SYBR Green Supermix(Bio-Rad公司)。
1.2实验方法
1.2.1建立模型
除A组外,各组小鼠分别于第1天、第8天和第15天腹腔注射20gOVA和10%氢氧化铝凝胶0.2mL致敏,第22天至第28天将小鼠置于封闭容器中,超声雾化吸入2%OVA诱发哮喘,每天一次,每次30min。A组在第1天、第8天和第15天腹腔注射等量生理盐水作为对照,并在第22天至第28天超声雾化吸入等量生理盐水。
1.2.1.1各干预组TNF-α给药方式和给药剂量及给药时间
实验的22至28天,在2%OVA雾化诱发前,C1、C2组分别给予TNF-α0.1g/kg、0.4g/kg腹腔注射,每天1次;D1、D2组分别给予0.2g/l、0.5g/lTNF-α雾化吸入,每次雾化30min。
1.2.2免疫组织化学法(IHC)检测肺组织TNF-αR阳性细胞表达
各组小鼠于末次激发后24h内取左肺下叶组织固定包埋,通过免疫组化法检测小鼠肺组织中TNF-αR的表达。胞膜或者胞浆染色为棕黄色为阳性细胞。光镜400倍视野下每个切片随机选择5个高倍视野进行阳性细胞计数,以均数加减标准差代表该组阳性细胞数。
1.2.3WB检测肺组织CysLTR1蛋白相对密度
取小鼠右肺组织制备蛋白标本后,经WB检测肺组织CysLTR1蛋白表达情况,并测出其相对密度。
1.3统计学方法分析
应用SPSS 17.0软件,对所有计量资料行正态分布检验,若符合正态分布,以表示,任意2组间均数的比较采用单因素方差分析,方差齐者用LSD检验,不齐者用Dunnett’s T3检验,P<0.05差异有统计学意义。
2结果
2.1IHC法检测哮喘小鼠肺组织TNF-αR表达
高倍显微镜下(×400),观察褐色TNF-αR阳性细胞(TNF-αR+)的数量及分布情况,图7-12。
上述图片中褐色细胞为肺组织TNF-αR阳性细胞,哮喘组及干预组均较正常组增加明显,主要集中支气管上皮细胞及肺泡细胞周围。其中C组小鼠在所有组TNF-αR1阳性细胞增多最明显。经统计软件检验发现,C2组和D2组之间差异没有统计性,其余任意两组间差异均有统计学意义(P<0.05)。
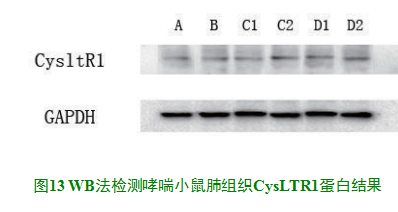
2.2WB法检测哮喘小鼠肺组织CysLTR1蛋白
如图13所示,A组、B组、C1组、C2组、D1组和D2组六组条带均可见,WB法检测各组的R1蛋白相对密度分别为0.797±0.081、1.422±0.97、1.784±0.210、2.448±0.096、2.023±0.058、2.933±0.034,统计软件分析B组和C1组之间、C2组和D2组之间CysLTR1蛋白表达无差异,D2组表达明显高于其他组。
3讨论
TNF-α作为重要的炎症介质,在炎症发生发展中起到重要作用,也被认为是一种前炎症因子,与肿瘤坏死因子受体1、2(TNF-αrecepter1、2,TNF-αR1、2)结合而发挥其生物作用。在哮喘的发病过程中,TNF-α同样参与了气道炎症的产生。Yang等人对16种细胞因子的研究发现其中TNF-α、CXCL8与哮喘病理改变最为密切[1]。由于哮喘患者TNF-αmRNA及蛋白水平明显升高[2],且吸入TNF-α后气道反应性增加,TNF-α同样也是中性粒细胞及嗜酸性粒细胞的趋化因子,促进中性粒细胞及嗜酸性粒细胞细胞分泌下游炎症因子,产生因子毒性;并使气道上皮细胞分泌细胞粘附因子-1及血管细胞粘附因子-1,这些上调的粘附因子直接趋化炎性细胞向肺部浸润,尤其在气道慢性炎症的启动及气道高反应性的产生初期均有作用,并且通过TNF-αR1延迟哮喘患者嗜酸性粒细胞凋亡,加重气道嗜酸性粒细胞炎症,甚至有研究发现TNF-α因可改变气道上皮细胞活性而影响气道屏障完整性相关,此外通过调节MAPK激酶等参与调控气道平滑肌细胞收缩,并加重气道平滑肌细胞经乙酰甲胆碱刺激而出现的收缩效应,而气道平滑肌肌束周围的肥大细胞等是TNF-α的重要来源。另外有研究发现,哮喘患者尤其是持续状态患者中,存在高凝状态及纤溶系统受损表现,该状态与IL-6及TNF-α导致的炎症反应相关[3]。
哮喘患者中有部分对吸入糖皮质激素疗效甚微,有研究发现在美国黑人儿童中难治性哮喘部分与高TNF-α表达有关,这部分人群不仅对哮喘常规治疗无效,且气道反应性升高明显[4]。这种非嗜酸性粒细胞炎症与激素治疗哮喘的不敏感性相关,主要表现为气道中性粒细胞活化与慢性中性粒细胞性炎症。慢性肺部感染、气道微生物菌落改变、中性粒细胞凋亡延迟可能导致病人非嗜酸性粒细胞性炎症、Th2辅助细胞功能低下、气道高反应性、气道重塑等[5];TNF-α由于对中性粒细胞的募集可能引起平滑肌细胞增殖、刺激纤维原细胞生长、促肌成纤维细胞成熟而参与气道重塑等,被认为与难治性哮喘发病机制有关。气道高反应性是哮喘的特征表现,早期主要由肺组织内肥大细胞释放炎症介质介导IgE途径发生,但研究发现经抗TNF-α预处理后,后期气道高反应的发生可被延迟或明显减缓[6]。此外在致敏阶段给予抗TNF-α微球蛋白处理后,小鼠血浆卵清蛋白特异性IgE水平明显降低,对乙酰甲胆碱引起的气道反应性也减轻,肺泡灌洗液中炎症介质水平降低,气道上皮黏膜细胞化生减少,细胞分泌被抑制[7]。部分观点认为对部分持续高表达TNF-α的儿童,抗TNF-α治疗可能是有益的[8]。此外,随着环境因素的恶化,有研究表明臭氧污染与哮喘气道炎症及气道高反应相关,实验证实臭氧可使嗜酸性粒细胞向肺组织浸润聚集,但该现象可被TNF-α受体拮抗剂阻断[9]。因此,TNF-α与难治性哮喘发生的具体分子机制仍需要更深层次的研究,这对于难治性哮喘抗TNF-α治疗的机制、有效性等研究的展开奠定了基础。
CysLTs是主要由活化的肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞分泌的炎症介质,包括LTC4,LTD4、LTE4。可引起明显的气道收缩,增加血管通透性,活化嗜酸性粒细胞,使气道上皮分泌增多,在血栓素A2及肺组织前列腺素T受体的参与下,CysLTs通过CysLTR2活化血小板,从而引起嗜酸性粒细胞致敏,并向肺组织聚集[10],形成嗜酸性粒细胞性炎症[11],同样也趋化中性粒细胞向肺组织游走,形成及非嗜酸性粒细胞性炎症,并通过G蛋白偶联受体影响上述细胞以及Th2型淋巴细胞、部分中性粒细胞及CD8+细胞,甚至一些结构细胞的自分泌[12]。先天淋巴细胞(innate lymphoid cells,ILC)近来被认为是哮喘早期炎症反应重要的启动因素,实验证实CysLTs1R可促进LTC4分泌,并增加先天淋巴细胞活性,从而参与哮喘肺部炎症的形成[13]。研究证实,在阿司匹林哮喘中CysLTs分泌明显增多,继而通过IL-33活化肥大粒细胞,可能是该种病的病理机制之一[14]。CysLTs中LTC4可致肥大细胞增殖,并释放细胞因子,LTE4因可趋化炎性细胞,促进气道上皮细胞粘液性分泌,推测可能与气道高反应及气道重塑有关[15]。此外有研究报道体外实验中CysLTs可使哮喘患者平滑肌细胞增殖[16],并通过5-脂氧化酶在体内外试验中均可上调骨髓嗜酸性粒细胞数量[17]。在气道重塑方面,白三烯受体拮抗剂可逆转杯状细胞化生、平滑肌细胞增厚、上皮细胞纤维化等表现,并可抑制气道过敏性疾病中嗜酸性粒细胞向肺部募集[18]。
目前TNF-α对于TNF-αR、CysLTR表达的影响尚未知,在本实验的前期研究中,已经证实经TNF-α可使CysLTs表达增加,肺组织病理改变较非干预组明显,这表明TNF-α、CysLTs在哮喘发病的病理机制中起到重要作用,这与上述研究在某些方面有共同发现。此外,本实验研究发现,将TNF-α通过不同剂量及不同方式干预小鼠后,TNF-αR、CysLTR1的表达也不同,因此,在部分高表达TNF-α的患者中,TNF-α可能通过该机制参与哮喘的发病,这提示抗TNF-α治疗在这部分患者中可能存在新的治疗机制。
4展望
支气管哮喘的发病机制仍在不断研究与探索中,尤其对于吸入激素治疗效果不佳的原因探讨尤为迫切,在已报到的研究中发现TNF-α与这部分患者的发病机制有关,这部分激素吸入治疗无效的哮喘患者提供了可能有益的治疗契机,但目前对于抗TNF-α治疗在部分难治性哮喘中的展开仍存有争议。目前部分观点认为抗TNF-α治疗对部分难治性哮喘患者的气道高反应性、肺功能及生活治疗有一定改善[19],但是可能引起一些不良反应,例如严重感染、致癌性等,故应继续研究,权衡治疗利弊。
参考文献
[1]Ting Y,Yan L,Zhe L,et al.Characteristics of Proinflammatory Cytokines and Chemokines in Airways of Asthmatics:Relationships with Disease Severity and Infiltration of Inflammatory Cells[J].Chinese Medical Journal,2017,130(17):2033-2040.
[2]Ai-Xia H,Li-Wen L,Wen-Juan L,et al.Plasma Inflammatory Cytokine IL-4,IL-8,IL-10,and TNF-αLevels Correlate with Pulmonary Function in Patients with Asthma-Chronic Obstructive Pulmonary Disease(COPD)Overlap Syndrome[J].Med Sci Monit,2016,22:2800-2808.
[3]Stanislawa BS,Lucyna M,Agnieszka C,et al.Prothrombotic State in Asthma Is Related to Increased Levels of Inflammatory Cytokines,IL-6 and TNFα,in Peripheral Blood[J].Inflammation,2017,40(4):1223-1235.
[4]Sonia C,Luisa NB,Celeste E,et al.Self-reported racial/ethnic discrimination and bronchodilator response in African American youth with asthma[J].PLoS ONE,2017,12(6):e0179091.
[5]Neil CT.Novel approaches to the management of noneosinophilic asthma[J].Therapeutic Advances in Respiratory Disease,2016,10(3):211-234.
[6]Catala F,Metea M,Taymana,C,Topalb E,et al.A human monoclonal anti-TNF alpha antibody(adalimumab)reduces airway inflammation and ameliorates lung histology in a murine model of acute asthma[J].Allergol Immunopathol(Madr),2015,43(1):111-118.
[7]Lee HS,Park HW,Song WJ,et al.TNF-αenhance Th2 and Th17 immune responses regulating by IL23 during sensitization in asthma model[J].Cytokine,2016,3:79:23-30.
[8]Sheena DB,Lou AB,Susan S,et al.Characterization of a“high”TNF-αphenotype in moderate-to-severe asthmatic children[J].Allergy ClinImmunol,2015,135(6):1651-1654.
[9]Sarah A W,Katy LL,David BJ,et al.Ozone-induced eosinophil recruitment to airways is altered by antigen sensitization and tumor necrosis factor-a blockade[J].Physiol Rep,2017,5(24):e13538.
[10]Tao L,Denise G,Chunli F,et al.Platelet-driven leukotriene C4-mediated airway inflammation in mice is aspirin-sensitive and depends on T prostanoid receptors[J].Immunol,2015,194(11):5061-5068.
[11]Hideaki S,Etsuko K,Tetsuo H,et al.LeukotrieneD4 induces chemotaxisinhuman eosinophilccellline,EoL-1cells via CysLTs1receptoractivation[J].Heliyon,2017,(3):e00464.
[12]Teal SH,Ying L,Kathryn AH,et al.Endogenous secreted phospholipase A2 group X regulates cysteinyl leukotrienes sy nthesis by human eosinophils[J].Allergy Clin Immunol,2016,137(1):268-277.
[13]Sean JL,Alex P,Kellen C,et al.Leukotriene C4 potentiates IL-33 induced ILC2 activation and lung inflammation[J].Immunol,2017,199(3):1096-1104.
[14]Tao L,Yoshihide K,Nora AB,et al.spirin-exacerbated respiratory disease involves a cysteinyl leukotriene-driven IL-33-mediated mast cell activation pathway[J].Immunol,2015,195(8):3537-3545.
[15]Lora GB,Juying L,Eri Y,et al.Leukotriene E4 elicits respiratory epithelial cell mucin release through the G-protein-coupled receptor,GPR99[J].PNAS,2016,5(113):6242-6247.
[16]Joshua AB,Cysteinyl Leukotrienes:An Innate System for Epithelial Control of Airway Smooth Muscle Proliferation?[J].American Journal of Respiratory and Critical Care Medicine,2015,3(191):496-497.
[17]Pedro XE,Daniela MB,Bruno MV,et al.Odd couple:The unexpected partnership of glucocorticoid hormones and cysteinyl-leukotrienes in the extrinsic regulation of murine bone-marrow eosinopoiesis[J].World J Exp Med,2017,2017(1):11-24;
[18]Glaucia AT,Isabella G,Josiane SN,et al.Cysteinyl Leukotrienes in eosinophil Biology:Functional Roles and Therapeutic Perspectives in eosinophilic Disorders[J].Front.Med,2017,4:106.
[19]Magnus S,Susanna KG,Sven ED,et al.TNFα-blockade stabilizes local airway hyperresponsiveness during TLR-induced exacerbations in murine model of asthma[J].Respiratory Research,2015,16:129.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/7422.html