SCI论文(www.lunwensci.com):
摘要:目的分析同步放化疗对鼻咽癌患者营养状况的影响,探讨鼻咽癌患者营养不良的监测指标。方法选择2016年5月至2018年1月宜宾市第一人民医院肿瘤科收治的鼻咽癌患者70例为研究对象。患者予以同步放化疗。比较治疗前(T0)、放疗4周后(T1)、放疗结束时(T2)体重、BMI、营养生化指标(血清总蛋白(TP)、清蛋白(ALB)、前清蛋白(PA)、血红蛋白(Hb))及患者主观整体评估(PG-SGA)评分;采用Spearman秩相关分析患者PG-SGA评分定级与体重、BMI、营养相关生化指标的相关性。结果患者在T2、T1时体重、BMI、TP、ALB、PA、Hb低于T0时(P<0.05);患者在T2时体重、BMI、TP、ALB、PA、Hb低于T1时(P<0.05);患者在T2、T1时PG-SGA-定性B、C级比率高于T0时(P<0.05);患者在T0时PG-SGA评分等级与BMI、ALB、PA、Hb呈负相关(P<0.05);患者在T1、T2时PG-SGA评分等级与体重、BMI、TP、ALB、PA、Hb呈负相关(P<0.05)。结论鼻咽癌患者在同步放化疗治疗过程中体重、BMI及营养生化指标表现为持续恶化。BMI、ALB、PA、Hb与PG-SGA评分等级具有较好的相关性,因此PG-SGA评分及BMI、ALB、PA、Hb测定对评估鼻咽癌患者的营养状况具有重要临床意义。
关键词:鼻咽癌;放化疗;营养状态;PG-SGA
本文引用格式:徐茜.鼻咽癌患者同步放化疗过程中营养状态变化的临床研究[J].世界最新医学信息文摘,2019,19(76):193-194,196.
0引言
鼻咽癌是头颈部常见的恶性肿瘤,在我国南方地区高发,目前同步放化疗是鼻咽癌的标准治疗模式,治疗5年总生存率约80%[1]。随着放疗技术快速发展,目前已达到能准确地照射肿瘤靶区的水平,但由于病灶邻近解剖结构较为复杂及特殊,上消化道和唾液腺均位于放射野区内,放射线在杀伤肿瘤细胞的同时,对口腔、咽喉、腮腺等器官和组织也造成不可避免的损伤,引起口腔黏膜炎、食管炎、味觉改变等毒副反应,对患者进食造成严重影响[2]。而化疗引起的消化道反应,会进一步导致患者进食减少,加之肿瘤本身大量消耗患者体内的营养物质,在消耗增多和摄入减少的双重影响下,患者往往发生营养不良[3]。营养不良可导致贫血、低蛋白血症、免疫低下等,不仅会对患者治疗的耐受性以及生存质量产生影响,还会导致其预后不良[4]。接受同步放化疗的鼻咽癌患者在治疗过程中若予以科学的方法进行及时准确评估,并采取合理措施进行干预,可提高疗效,改善预后。本研究通过观察接受同步放化疗的鼻咽癌患者治疗过程中营养状态的变化,寻找有效的监测因子,为预防及纠正营养不良提供理论基础。
1资料和方法
1.1一般资料
选取2016年5月至2018年1月宜宾市第一人民医院肿瘤科收治的鼻咽癌患者70例为研究对象。入选标准:病理组织学确诊为非角化性鼻咽癌;未接受过手术、放疗、化疗或其他抗肿瘤治疗;卡式评分(Karnofsky performance status,KPS)≥70;临床分期为Ⅰ-Ⅳa期;无严重的消化系统疾病及营养代谢疾病病史;无严重心、肺、肝、肾疾病。排除标准:有远处转移者;有严重的慢性消耗性疾病者;妊娠、哺乳期女性;同时接受其他慢性系统性免疫治疗者。70例鼻咽癌患者中男50例,女20例;年龄18~65岁;病理分化性类型:未分化癌41例,分化性癌29例;TNM分期的分布:T1期15例,T2期17例,T3期21例,T4期17例;N分期:N0期6例,N1期26例,N2期29例,N3期9例;I期3例,II期16例,III期30例,Ⅳa期21例。本研究经宜宾市第一人民医院伦理学委员会批准,且患者签署知情同意书。
1.2治疗方法
1.2.1调强放射治疗
患者予以调强适形根治性放射治疗。采用头颈肩热塑面罩进行治疗体固定,予以CT模拟定位及扫描。从头顶扫描至锁骨头下3cm,扫描层厚为3mm。扫描完后在CT图像上逐层勾画靶区和危及器官。靶区及周围重要器官(OAR)勾画参照国际辐射单位与测量委员会(International Commission on Radiation Units and Measurements,ICRU)50号和62号报告原则。靶区处方剂量:PTVnx:66~72Gy;PTVnd:66~72Gy;PTV1:66~64Gy;PTV2:50~54Gy;照射5次/周,照射总次数为30~33次。
1.2.2化疗
同步放化疗药物:单药顺铂(DDP)。给药方式和剂量:DDP100mg/m2分1-3d给药,iv drip;分别于d1,d22和/或d43给药,共2-3程。根据化疗前一疗程中的毒性调整化疗的剂量。
1.2.3营养及支持治疗
所有患者均未予以营养支持治疗,患者自行进食,放射反应重时予以氨基酸、脂肪乳及水溶性维生素等静滴,连续使用时间≤3d。
1.3观察指标
比较治疗前(T0)、放疗4周后(T1)、放疗结束时(T2)体重、体重指数(Body Mass Index,BMI)、营养相关生化指标水平及异常率(血清总蛋白(Total Protei,TP)、清蛋白(Albumin,ALB)、前清蛋白(Prealbumin,PA)、血红蛋白(Hemoglobin,Hb))、患者主观整体评估(PG-SGA)评分。BMI<18.5为低体重营养不良者;3个月内丢失>5%的体重存在营养风险;营养相关生化指标异常定义:TP<65g/L;ALB<35g/L;PA<280mg/L;男性Hb<131g/L,女性Hb<113g/L,营养相关生化指标异常表明存在营养风险;PG-SGA量表分为由患者独立完成和医师检查完成两部分。患者独立完成内容包括以往症状,体重及以往和现在活动能力,食物摄入情况。医师检查完成内容包括体格检查、代谢、疾病及其与营养需求的关系4个部分。4部分得分相加得出总分。根据总分判断是否需要营养治疗,同时也对收集的数据进行量化,其结果可以不断测定,动态观察,总分越高提示患者的营养状况越差。结果分为3个等级,A级(总分0~3分),为营养正常;B级(总分4~8分),为中度营养不良;C级(总分≥9分),为严重营养不良,急需进行症状改善及同时进行营养干预[4]。
1.4统计学方法
应用SPSS 19.0软件进行统计学分析,计量资料以±s表示,不同时间点之间的计量资料采用方差分析,时间点之间采用t检验,计数资料采用2检验;采用Spearman秩相关分析患者PG-SGA评分定级与体重、BMI、营养相关生化指标的相关性。P<0.05有统计学意义。
2结果
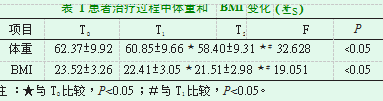
2.1患者治疗过程中体重和BMI变化
患者在T2、T1时体重和BMI低于T0时(P<0.05);患者在T2时体重和BMI低于T1时(P<0.05);T0时,BMI<18.5的患者(低体重营养不良)有5例(7.14%),有21例(30.00%)患者在过去3个月内丢失>5%的体重;T1时BMI<18.5的患者有10例(14.29%),有59例(84.29%)患者体重减轻,18例(25.71%)体重减少在5%~10%,6例(8.57%)体重减少>10%;T2时BMI<18.5的患者有15例(21.43%),有65例(92.86%)患者体重减轻,25例(37.14%)体重减少在5%~10%,21例(30.00%)体重减少>10%,见表1。
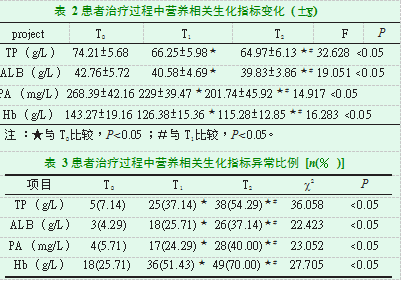
2.2患者治疗过程中营养相关生化指标变化
患者在T2、T1时TP、ALB、PA、Hb低于T0时(P<0.05);患者在T2时TP、ALB、PA、Hb低于T1时(P<0.05);患者在T2、T1时TP、ALB、PA、Hb异常比例高于T0时(P<0.05);患者在T2时TP、ALB、PA、Hb异常比例高于T1时(P<0.05),见表2、表3。
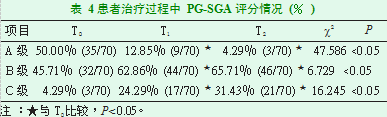
2.3患者治疗过程中PG-SGA评分变化
患者在T 2、T 1时PG-SGA-定性B、C级比率高于T 0时,PG-SGA-定性A级比率低于T 0时(P<0.05);患者在T 2和T 1时PG-SGA-定性A、B、C级比率比较差异无统计学意义(P>0.05),见表4。
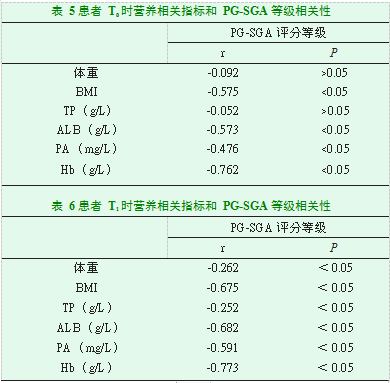
2.4患者营养相关指标和PG-SGA评分等级的相关性分析
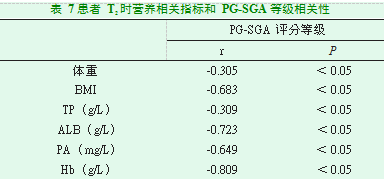
患者在T0时PG-SGA评分等级与BMI、ALB、PA、Hb呈负相关(P<0.05);患者在T1时PG-SGA评分等级与体重、BMI、TP、ALB、PA、Hb呈负相关(P<0.05);患者在T1时PG-SGA评分等级与体重、TP呈低度负相关(P<0.05);患者在T2时PG-SGA评分等级与体重、BMI、TP、ALB、PA、Hb呈负相关(P<0.05);患者在T2时PG-SGA评分等级与体重、TP呈低度负相关(P<0.05),见表5、6、7。
3讨论
营养不良是指机体蛋白质和(或)能量摄入不足、丢失过多或吸收障碍造成的营养缺乏症。研究报道,约50%的鼻咽癌患者在确诊时已存在营养不良[5],而同步放化疗造成的胃肠道反应、黏膜炎、吞咽困难等副反应及患者焦虑、抑郁等不良情绪会使营养不良加重 。营养不良会造成免疫功能受损、放疗耐受性及化疗缓解率降低、生活质量下降及预后不良[6]。美国癌症中心报道约40%的癌症患者因营养不良死亡,而并非死于肿瘤本身及治疗并发症[7]。因此,深入了解患者同步放化疗过程中的营养状况,对预防其营养不良具有重要价值。
体重是反应鼻咽癌患者营养状况的便捷的观察指标,患者体重下降体现营养状况恶化。BMI由身高及体重两个因素决定,可反应体内脂肪总量,较单用体重评估患者营养状况准确度更高[8]。临床上,营养相关生化指标(TP、ALB、PA、Hb)常作为评价患者营养状况的指标,可从多方面反映患者营养状况。PG-SGA是一种专门为肿瘤患者制订的营养评价工具,它是从患者体重改变、摄入量变化、胃肠道症状、疾病史及体格检查等方面获得的综合评估结果[9]。本研究结果显示,在T0时,BMI<18.5的患者占7.14%,30.00%的患者在过去3m内丢失>5%的体重;患者贫血发生率占
25.71%;PG-SGA-定性B、C级为50%。结果提示,对于还没予以放化疗的鼻咽癌患者营养不良发生率较高。营养不良的发生与肿瘤本身造成机体代谢异常有关,与正常人相比鼻咽癌患者肝脏蛋白质合成和分解更快,骨骼肌蛋白质合成更慢,导致骨骼肌大量被消耗;肿瘤代谢形成的毒性物质会导致患者在疾病早期食欲下降、摄入减少;此外患者存在焦虑、抑郁等负性情绪会使其食欲下降,导致营养不良发生。因此一旦确诊为鼻咽癌的患者应及时予以营养评估,对体重显著下降或营养不良风险明显者予以营养干预及针对症状治疗。
鼻咽癌患者同步放化疗过程中营养状态的准确有效监测和评估,是对患者营养不良及时干预的前提。本研究结果显示,在T1时,BMI<18.5的患者占14.29%,有84.29%的患者体重减轻,25.71%的患者体重减少在5%~10%,8.57%的患者体重减少>10%;患者在T1时TP、ALB、PA、Hb水平低于T0时,异常比例高于T0时(P<0.05);患者在T1时PG-SGA-定性B、C级比率高于T0时(P<0.05);PG-SGA-定性B、C级占87.14%。结果提示鼻咽癌患者同步放化疗中期已出现明显的营养不良的风险和状况,需及时予以营养干预。本研究结果显示,在T2时BMI<18.5的患者占21.43%,有92.86%的患者体重减轻,37.14%的患者体重减少在5%~10%,30.00%的患者体重减少>10%;患者在T2时TP、ALB、PA、Hb低于T1、T0时,异常比例高于T0、T1时(P<0.05);患者在T2时PG-SGA-定性B、C级比率高于T0时(P<0.05);PG-SGA-定性B、C级占95.71%。结果提示,鼻咽癌患者在同步放化疗过程中体重、BMI、营养学相关生化指标及PG-SGA评分表现为持续恶化。
PG-SGA量表被我国肿瘤营养治疗专家委员会推荐作为恶性肿瘤患者的营养评估工具[10]。临床上对同步放化疗的鼻咽癌患者采用PG-SGA量表能准确进行营养不良程度分级。但PG-SGA量表需由接受过专业培训的医务人员来完成,内容繁杂,需较多的时间来完成。而体重、BMI和营养学相关生化指标客观准确,方便直接。因此,本研究通过观察鼻咽癌患者在放疗期间营养状况的变化,对治疗过程中的体重、BMI、营养学相关生化指标与PG-SGA评分间进行相关性分析,找到血液指标中评价营养不良敏感、可操作性的指标,以便及时预防和纠正鼻咽癌患者放化疗过程中的营养不良。本研究结果显示,患者在T0时PG-SGA评分等级与BMI、ALB、PA、Hb呈负相关(P<0.05);患者在T1时PG-SGA评分等级与体重、BMI、TP、ALB、PA、Hb呈负相关(P<0.05);患者在T1时PG-SGA评分等级与体重、TP呈低度负相关(P<0.05);患者在T2时PG-SGA评分等级与体重、BMI、TP、ALB、PA、Hb呈负相关(P<0.05);患者在T2时PG-SGA评分等级与体重、TP呈低度负相关(P<0.05)。结果提示,鼻咽癌患者在同步放化疗治疗过程中PG-SGA评分等级与BMI、ALB、PA、Hb有显著相关性,PG-SGA评分、BMI、ALB、PA、Hb可作为患者营养状况监测因子。在鼻咽癌患者同步放化疗过程中,密切监测BMI、ALB、PA、Hb变化,及时采取有效的措施来进行营养干预,才有可能更好的提高患者的营养状况。
综上所述,鼻咽癌患者在同步放化疗治疗过程中体重、BMI及营养生化指标表现为持续恶化。BMI、ALB、PA、Hb与PG-SGA评分等级具有较好的相关性,因此PG-SGA评分及BMI、ALB、PA、Hb测定对评估鼻咽癌患者的营养状况具有重要临床意义。
参考文献
[1]梁雪霞,谢方云,张允,等.诱导化疗联合同期放化疗与同期放化疗治疗局部晚期鼻咽癌的对比研究[J].中国肿瘤临床,2013,40(8):202-207.
[2]黄素宁,王仁生,梁菲菲,等.局部晚期鼻咽癌诱导化疗联合同期放化疗的临床观察[J].中华肿瘤防治杂志,2013,20(8):614-617.
[3]刘兵兵,杜红珍,李增宁,等.食欲素功能研究及在肿瘤治疗方面应用的前景[J].肿瘤代谢与营养电子杂志,2015(3):64-67.
[4]姚倩,冯长艳,杨祖安.营养风险筛查和患者主观整体评估在非手术肿瘤患者中的临床运用及意义[J].重庆医学,2016,45(11):1567-1568.
[5]张海荣,洪金省,苏丽,等.鼻咽癌患者放疗期间营养指数模型构建及营养状况下降影响因素分析[J].中国卫生统计,2015,32(6):959-962.
[6]Qu Y,Chen Y,Yu H,et al.Survival and Prognostic Analysis of Primary Nasopharyngeal Carcinoma in North China[J].Clinical Laboratory,2015,61(7):699-708.
[7]Silander E,Nyman J,Hammerlid H.An exploration of factors predicting malnutrition in patients with advanced head and neck cancer[J].Laryngoscope,2013,123(10):2428-2434.
[8]孙晓红,胡芳.患者自评-主观全面评定量表在胃肠恶性肿瘤患者营养筛查中的应用调查[J].中国全科医学,2014,(14):1643-1645.
[9]杨家君,黄学军,邓俊晖,等.PG-SGA在常见消化道恶性肿瘤患者中的应用研究[J].肿瘤代谢与营养电子杂志,2017,4(2):189-192.
[10]CSCO肿瘤营养治疗专家委员会.恶性肿瘤患者的营养治疗专家共识[J].临床肿瘤学杂志,2012,17(1):59-73.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/21497.html