SCI论文(www.lunwensci.com):
摘要:软脑膜转移瘤(LM)是指为肿瘤细胞在软脑膜和蛛网膜下腔的扩散,又称癌性脑膜炎。乳腺癌,肺癌和黑色素瘤是导致LM 的最常见的实体瘤。随着各种抗癌疗法的提出,极大的提高了上述肿瘤病人的生存期,以及外科手术的介入,都是 LM 发病率增加的部分原因。神经系统缺陷一旦出现,大多是不可逆转的,并且通常会对患者的生活质量产生极大的影响。 基于定向性地对 LM 进行症状的缓解,局限性地使用在神经外科手术,放射治疗,脑脊液内治疗和全身性的治疗。检测LM 的新方法包括检测 CSF 循环内的肿瘤细胞和肿瘤细胞游离 DNA。越来越多的回顾性研究表明,分子靶向治疗,如在肺癌患者中应用EGFR 和 ALK 抑制剂,HER2 + 乳腺癌患者中使用曲妥珠单抗及对黑素瘤患者应用BRAF 抑制剂,可能是LM 多学科管理的一部分。但目前仍需要进行标准化反应评估的前瞻性随机试验,以进一步验证上述药物治疗的疗效。
关键词 :软脑膜转移瘤;乳腺癌;肺癌;黑色素瘤;靶向治疗;化疗;放疗;疗效评估
本文引用格式:周磊 , 詹仁雅 . 软脑膜转移瘤的治疗研究进展 [J]. 世界最新医学信息文摘 ,2019,19(59):115-118.
流行病学和风险因素
根据已有文献,LM在实体瘤中的诊断率大约在4-15%之间[1]。有尸检中,这一比例更高,约19%有神经系统症状和功能受损的癌症患者中有脑膜受累的证据[2]。乳腺癌(12%-34%),肺癌(10%-26%)黑色素瘤(17%-25%),消化道肿瘤(4%-14%)是转移至脑膜的最常见原发实体肿瘤[3,4]。其他常见的原发恶性肿瘤还包括前列腺癌,肉瘤和卵巢癌等。LM的中位生存期极差,若无肿瘤特异性治疗其生存期常局限于6-8周内,而针对LM进行的积极治疗(如:靶向治疗和免疫治疗)可延长生存期至几个月。多因素分析显示,诊断LM时患者的临床表现状态(KPS评分)是其最重要的预后因素。其他常见的影响预后的因素包括原发肿瘤类型(研究认为乳腺癌患者的预后要优于肺癌和黑色素瘤患者),脑脊液蛋白水平,是否行联合治疗,全身治疗及CSF内治疗,以及初始临床及CSF变化对治疗的反应。相比之下,全脑放疗(WBRT)与总生存期的关联并未得到一致报道。
导致LM的最常见的实体肿瘤癌是乳腺癌(BC),其次是非小细胞肺癌(NSCLC)和黑色素瘤[4]。在超过70%的患者中,LM与晚期和不受控制的全身性疾病共存,其中约有5%的患者因非原发病灶而首次就诊。LM可能在20%的长期无病患者中表现,或在偶然中被发现[5]。
在乳腺癌患者中,已认为几种易发生LM的危险因素:出现实质性脑转移瘤(BM),年龄小于40岁,全身性疾病未控制,BM的手术治疗,出现肺转移灶,三阴性状态,雌激素受体状态阴性(ER),孕激素受体状态阴性(PR)和浸润性小叶组织学[5]。在HER2阳性患者中,与已明确的易发生BM相反,LM相对罕见,发病率为3-5%[6]。
在一项回顾性研究表明,在NSCLC中,LM在腺癌组织病理学和表皮生长因子受体(EGFR)突变肿瘤患者中更为常见[7]。EGFR L858R突变的患者比外显子19缺失的患者更容易发生LM[8]。
NSCLC中的间变性淋巴瘤激酶(ALK)突变可能是LM的危险因素之一,但这种假设尚未被研究所明确[9]。在大约8%的NSCLC患者中观察到了ALK基因的重组,并且在腺癌患者中有更高的患病率,以及年轻,非吸烟或轻度吸烟患者[10]。尽管ALK酪氨酸激酶抑制剂(TKIs)有良好的全身控制和对中枢神经系统也有良好的应答反应[11],但仍有大约60%的患者在用第一代ALK抑制剂克唑替尼治疗时发生了CNS转移[12],且CNS最易发生转移的位点>30%。这可能源于克唑替尼的CNS渗透性较差导致了CNS和CSF中的药物浓度[13]。
在发生LM的危险因素中,选择对BM进行手术治疗可能会增加LM的风险[14]。在零碎切除小脑和幕上BM破坏脑室系统的情况下,癌细胞可能直接接触并传播到CSF中。癌症细胞的逃逸确实可能比临床上所认为的更容易发生,并会且导致LM不同的发展结局[15]。
目前已经确定CNS穿透差性的全身药物治疗是导致LM增加的潜在原因[16]。中枢神经系统或许是许多药物的“避难所”,包括靶向药物治疗和单克隆抗体治疗。在长期控制颅外疾病病灶中反映的患者生存率提高似乎有助于控制LM的发生,如使用抗细胞毒性T淋巴细胞抗原-4,PD-1抗体和BRAF抑制剂[17]。
最近治疗与新型靶向治疗和生物制剂如检查点抑制剂和免疫调节剂相关的转移性BC,NSCLC和黑素瘤的改善也可能使LM患者受益。为了实现这一目标,该群体需要进行新的临床试验,部分原因是肿瘤特异性治疗以及定义可获得的生物学靶标的分子生物标志物[13]。
2病理
已知肿瘤细胞主要通过几种方式转移到软脑膜:(1)动脉或静脉;(2)软脑膜与肿瘤的紧密接触;(3)沿神经周围或血管周围空间的向心性进展[18,19]。一旦进入蛛网膜下腔,肿瘤细胞就可以在中枢神经系统的多个区域与CSF循环相接。受影响最大的区域是大脑底部(基底池)和脊髓背侧(马尾)的基部。在这些地区,CSF流通相对缓慢,LM可能通过形成阻塞性室管膜结节或阻碍CSF流动的肿瘤粘连而导致脑积水。
3诊断
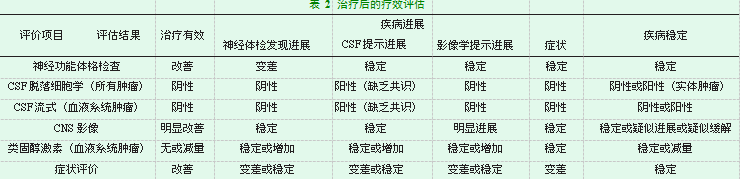
对于LM的完整诊断应包含患者的临床症状,CSF分析,影像学检查,软脑膜活检等,其中只有在CSF或软脑膜活检中检出恶性细胞才能确诊LM,这也是目前工人诊断LM的金标准[20]。但CSF细胞学研究的结果通常是定性的,尽管特异性很高,但灵敏度很低[21]。据文献报道,大约在66%-90%的LM患者中,CSF细胞学可为阳性。因此,对于有神经症状或体征的乳腺癌、肺癌或黑色素瘤患者,出现LM的典型临床症状,如头痛,恶心呕吐,精神变化,步态困难,伴有复视的颅神经麻痹,视力障碍,听力丧失,四肢感觉运动障碍和马尾综合征,根性,颈背部疼痛时[17],临床医生应考虑到LM的可能,并行增强MRI检查,其序列应包括脑:轴位T1加权,轴位FLAIR,轴位扩散,轴位T2加权,钆增强后3D T1加权和钆增强3D FLAIR序列。脊髓:钆增强后矢状T1加权序列,还可考虑无增强的矢状T1加权,矢状脂肪抑制T2加权序列,结合目标区域的增强后的轴位T1加权图像[22,23]。同时,在条件允许的情况下,腰椎穿刺行CSF检查在诊断过程中是必须进行的。对于疑似LM和初次CSF检查阴性或可疑的患者,应进行一次重复腰椎穿刺取样并优化分析。每当LM无法诊断并且排除了慢性脑膜炎的常见原因时,可以进行针对MRI上的症状和/或对比增强区域的脑膜活检,其中颅底和马尾神经是最常见的活检部位[24]。
4治疗
LM的治疗应考虑以下因素个体化治疗:患者的一般健康状况和神经功能状态,原发肿瘤的组织学类型及分子亚型,脑脊髓外疾病的进展程度及可用治疗的选择,LM的临床和影像学表现以及有无伴随脑转移的存在[25]。
LM的治疗包括全身治疗,CSF内化疗,放疗以及姑息治疗。
4.1全身治疗
最常见的三类原发灶肿瘤的全身治疗方案:乳腺癌,常规化疗包括卡培他滨,环磷酰胺,5-氟尿嘧啶(5-FU),甲氨蝶呤(MTX),长春新碱,顺铂,依托泊苷,长春瑞滨和吉西他滨;有报道HER2阳性患者使用曲妥珠单抗治疗可在临床获益;拉帕替尼联合卡培他滨治疗时获益更多。对患有LM的HER2阳性患者,应考虑抗HER2治疗与化疗联合治疗[26,27]。
肺癌,常规化疗基于铂类组合,包括培美曲塞,吉西他滨,紫杉醇或长春瑞滨;加入贝伐单抗的化疗方案可能有利于NSCLC的脑转移[28];EGFR突变患者可从第一代(吉非替尼,厄洛替尼,埃克替尼)和第二代(阿法替尼)EGFR酪氨酸激酶抑制剂(TKIs)中获益,当出现TKI耐药时应考虑第三代抑制剂奥斯替尼;ALK,ROS及MET突变患者可选择克唑替尼,若仍出现进展可使用色瑞替尼,艾乐替尼,劳拉替尼或布加替尼。有研究显示抗程序性细胞凋亡(PD-1)药物如单抗或派姆单抗以及抗PD配体1药物如阿特朱单抗在NSCLC患者中有效[26,29-31]。
黑色素瘤,经典药物如替莫唑胺,达卡巴嗪或福莫司汀的全身化疗证实疗效有限,易普利姆玛可在脑转移患者中发挥作用,同时抗PD-1抗体显示出对抗脑外疾病的活性;BRAF抑制剂如维莫非尼或达拉菲尼对出现脑转移或LM患者有效。在控制颅外肿瘤方面,少数报道MAPK/ERK激酶(MEK)抑制剂(曲美替尼,司美替尼,pimarsertib)或BRAF和MEK抑制剂联合使用(达拉菲尼+曲美替尼,维莫非尼+考比替尼)在CNS转移患者,特别是来自黑色素瘤的LM患者中有效[26,32,33]。
4.2CSF内化疗
CSF内化疗包括腰椎鞘内注射给药或脑室内给药途径。相比较于腰椎鞘内注射给药,脑室内给药对患者来说痛苦较小,并且对临床医生来说更高效省时,并且腰椎鞘内注射给药会有10%的可能性注射至硬膜外,但该种方式的侵袭性较前者小[34]。据药代动力学研究证实:腰椎内给药后脑室内的药物浓度仅为直接给予脑室后的等效剂量的10%。因此,脑室内给药允许更频繁地给予较小剂量的药物并导致较低的药物浓度峰值,较少的总剂量累积和较低的神经毒性[35]。
关于药物的选择,甲氨蝶呤[36],阿糖胞苷[37],阿糖胞苷脂质体[38],噻替哌[39]是最常用于CSF内化疗的几类药物。由研究证实,对于罹患实体肿瘤伴LM的患者,CSF内多种药物组合治疗并没有发现增加治疗优势,反而会增加药物毒性作用[40]。除了上述四种常用药物之外,目前仍有许多新型药物作为LM患者的CSF内治疗正在研发当中。包括二喹吖嗪,马司氟胺,盐酸尼莫司汀,4-氢过氧环磷酰胺,6-巯基嘌呤,达卡巴嗪和吉西他滨,白消安和替莫唑胺的微晶制剂在内等[41-43]。
4.3放疗
区域放疗或立体定向放疗可用于治疗脑膜结节性疾病和出现临床神经症状的局部脑组织或脊髓节段;在排除其他原因后,可以对马尾综合征或颅神经麻痹患者进行局部放疗;30%脊髓段堵塞以及50%颅内段CSF堵塞的患者也可通过局部放疗缓解[44]。
全脑放疗可考虑用于广泛的结节性或症状性线性LM或同时存在脑转移病灶,尽管已有的回顾性研究并未显示其与生存期延长之间存在相关性[45]。
CSF内放射性同位素治疗及CSF内给与放射性物质标记的单克隆抗体药物治疗仍在探索之中。
4.4姑息治疗
但并非所有LM患者都是适合积极治疗的[46]。LM会导致患者伴有固定的神经功能缺损或脑病,严重影响生活质量,尽管采取了积极的LM指导治疗,预后仍然不佳。对于这类患者应考虑姑息治疗方法,以减轻神经系统症状给病人带来的痛苦。伴有头痛,背部和根性疼痛需要缓解疼痛,可基于使用从对乙酰氨基酚到阿片类药物逐渐增加疗效的镇痛药。神经性疼痛的治疗常依赖于三环类抗抑郁药(如阿米替林或去甲替林)或抗癫痫类药物(如加巴喷丁,普瑞巴林,卡马西平和拉莫三嗪)。根性疼痛可能对激素敏感。有症状的疾病部位的局灶性放射也可以有效地控制继发于软脑膜转移的疼痛。在临床上,有时可以使用5-羟色胺再摄取抑制剂或兴奋剂药物(如莫达非尼,哌醋甲酯)来控制抑郁或疲劳。
若LM患者癫痫发作需抗癫痫治疗,但对从既往未发生癫痫发作的LM患者是非必须的。与脑水肿或颅内压增高相关导致的头痛,特别是伴有BM时,可以用类固醇激素治疗[47]。继发于CSF阻塞的脑积水通常需要行手术治疗,如侧脑室腹腔分流手术以减轻脑积水带来的神经功能缺陷[48]。若没有威胁性的BM时,迭代性的腰椎穿刺可能是患有CSF转移的患者的临时选择。
5生存与预后
如果未行积极治疗,LM患者的中位生存期约为6周左右[49]。然而,即使采用积极措施,LM的预后仍然不容乐观[50]。考虑到所有的组织学类型和治疗方式的组合,总生存期大多不到6个月,中位数大约为2至3个月。偶尔存在长期幸存者,1年生存率约为15%左右[51]。LM导向治疗的目标是改善或稳定神经功能状态,维持神经系统生活质量,延长生存期。既往研究总结出,预后不良的患者(高风险组)特征为:KPS<60分;存在主要神经功能缺损;广泛的全身性疾病;未行任何有效的治疗;广泛的中枢神经系统疾病;出现LM相关脑病。而那些KPS≥60分;无重大的神经缺陷;通过有效治疗可以控制的全身性疾病;没有CSF循环障碍的患者(低风险组)相比会有更好的预后[52]。
通过多因素分析证实,原发性肿瘤类型组织学是LM患者的主要预后因素。与乳腺癌相关的LM具有比肺癌或黑色素瘤更好的预后,大多数报告的乳腺癌相关的LM中位总生存期在3到5个月之间[53]。并且由于靶向治疗等治疗方式的引入似乎提高了患者的中位生存期。例如,在接受CSF曲妥珠单抗治疗的HER2+BC患者中报告了13.5-20个月的中位生存率,然而相关LM生存期改善的结果报道来自于回顾性试验研究,暂未有随机对照研究来证实[54]。患有NSCLC的LM患者的中位生存期的改善可能与EGFR和ALK抑制剂等靶向药物的使用增加有关[55]。在患有LM的NSCLC患者中,报告的存活率通常在3至5.5个月之间,但在口服EGFR-TKIs治疗的EGFR突变的LM患者中,其生存期可能高达11个月[56]。黑色素瘤相关性LM在所有实体肿瘤相关LM的患者中预后最差,中位生存期在仅10周至4个月之间[57]。
除了上述原发性肿瘤类型组织学是主要因素之外,LM的其他预后因素也有许多回顾性研究来证实,包括临床的功能状态,诊断LM时患者的年龄,有无LM相关脑病,从确诊原发肿瘤到诊断LM的间隔时间,CSF蛋白水平和初始量化用流式细胞术免疫表型分析获得CSF上皮细胞粘附分子+细胞[58,59]。治疗方式(全身治疗与放射治疗)和早期治疗的反应也被报道作为生存期的预测因素之一。只有在一项研究的多因素分析中,男女之间的生存周期存在差异,可能是由于性别和肿瘤类型之间存在一定的联系[60]。在出现LM的BC患者中,多因素分析显示总体生存时间与临床表现状态以及临床状态与治疗(既往化疗的次数,联合治疗的方式,全身治疗与放射治疗,全身化疗联合给药或CSF内联合治疗)之间是存在相关性的[61,62]。组织学特征(组织学分级,激素受体状态,三阴性状态),初始的CSF蛋白水平,既往化疗的次数,全身性疾病的控制状态,早期和/或结合细胞学和神经对治疗的疗效反应和初始CSF细胞角蛋白21-1的水平也与生存期相关[63]。
在近期的NSCLC患者发生LM的回顾性系列研究中显示,良好的临床状态,初始CSF内低蛋白水平,初始CSF内低白细胞计数都与更好的生存预后显著相关。全身治疗,CSF内化疗和对CSF内化疗的临床反应都是提高生存率的重要预测指标。WBRT在LM治疗中的作用仍存在一定的争议[64]。
关于肺癌伴LM患者的回顾性研究数据显示,EGFR TKIs是最佳治疗方法,其能显著改善总体存活率及肿瘤控制率。但单独WBRT治疗,或者WBRT联合EGFR TKIs治疗的疗效尚未被证实[65]。在某些病例分析中,CSF内的循环肿瘤cfDNA的分析也是一种有用的预测工具。例如,在NSCLC患者中,KRAS突变与预后不良有关,因此,它们在LM患者的CSFcfDNA中的鉴定也可以提供一定的预后信息[66]。
在黑色素瘤的患者中,多因素分析研究表明,起源于躯干的原发性黑色素瘤病变的预测总生存期较短,应用CSF内化疗可预示较长的总生存期[67,68]。同时有报道指出,诊断LM时血清乳酸脱氢酶和S100B的升高与较短的存活率相关[68]。
6结论
肿瘤患者行系统的全身治疗常伴随着较长的生存周期,但同时由于药物的CNS穿透受限,导致肿瘤出现CNS转移的发生率增加,包括LM。目前的研究对于LM的治疗选择仍然十分有限。然而,具有可操作的肿瘤突变及可用于穿透CNS的靶向药物治疗的亚组患者已经显示出对于治疗LM的可能性,而无需行CSF内化疗。关于诊断LM,新的诊断方法正在不断发展中,这些新颖的诊断方法包括流式细胞术,免疫表型分析,检测循环肿瘤细胞的技术
(circulating tumor cells,CTCs)和cfDNA[69],在临床上应用这些技术前需要进行进一步的验证,但已有不少研究已经显示出这些技术可更准确地明确诊断并评估治疗后的LM患者的治疗疗效。
在转移性BC、NSCLC和黑色素瘤治疗方面的进展,基于新的靶向治疗和生物制剂(如检查点抑制剂和免疫调节剂)[70],也可能使发生LM的患者受益。但仍需要在这一人群中进行更多的临床试验以明确这些治疗方案的疗效。
参考文献
[1]Chamberlain,M.C.Leptomeningeal metastasis[J].Curr Opin Oncol,2010,22(6):627-35.
[2]Glass,J.P.,et al.Malignant cells in cerebrospinal fluid(CSF):the meaning of a positive CSF cytology[J].Neurology,1979,29(10):1369-75.
[3]Kaplan,J.G.,et al.Leptomeningeal metastases:comparison of clinical features and laboratory data of solid tumors,lymphomas and leukemias[J].J Neurooncol,1990,9(3):225-9.
[4]Wasserstrom,W.R.,J.P.Glass and J.B.Posner,Diagnosis and treatment of leptomeningeal metastases from solid tumors:experience with 90 patients[J].Cancer,1982,49(4):759-72.
[5]van Oostenbrugge,R.J.and A.Twijnstra,Presenting features and value of diagnostic procedures in leptomeningeal metastases[J].Neurology,1999,53(2):382-5.
[6]Scott,B.J.and S.Kesari,Leptomeningeal metastases in breast cancer[J].Am J Cancer Res,2013,3(2):117-26.
[7]Lee,S.J.,et al.Leptomeningeal carcinomatosis in non-small-cell lung cancer patients:impact on survival and correlated prognostic factors[J].J Thorac Oncol,2013,8(2):185-91.
[8]Chamberlain,M.,et al.Leptomeningeal metastases:a RANO proposal for response criteria[J].Neuro Oncol,2017,19(4):484-492.
[9]Riess,J.W.,et al.Prolonged survival of patients with non-small-cell lung cancer with leptomeningeal carcinomatosis in the modern treatment era[J].Clin Lung Cancer,2014,15(3):202-6.
[10]Solomon,B.,M.Varella-Garcia and D.R.Camidge,ALK gene rearrangements:a new therapeutic target in a molecularly defined subset of non-small cell lung cancer[J].J Thorac Oncol,2009,4(12):1450-4.
[11]Xu,Y.,L.Li and M.Wang.Diagnosis and Treatment of Leptomeningeal Metastasis in Non-small Cell Lung Cancer[J].Zhongguo Fei Ai Za Zhi,2015,18(10):626-32.
[12]Solomon,B.J.,et al.First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J].N Engl J Med,2014,371(23):2167-77.
[13]Costa,D.B.,et al.Clinical Experience With Crizotinib in Patients With Advanced ALK-Rearranged Non-Small-Cell Lung Cancer and BrainMetastases[J].J Clin Oncol,2015,33(17):1881-8.
[14]van der Ree,T.C.,et al.Leptomeningeal metastasis after surgical resection of brain metastases[J].J Neurol Neurosurg Psychiatry,1999,66(2):225-7.
[15]Jung,J.M.,et al.Incidence and risk factors for leptomeningeal carcinomatosis in breast cancer patients with parenchymal brain metastases[J].J Korean Neurosurg Soc,2012,52(3):193-9.
[16]Corbin,Z.A.and S.Nagpal,Leptomeningeal Metastases[J].JAMA Oncol,2016,2(6):839.
[17]Balm,M.and J.Hammack,Leptomeningeal carcinomatosis.Presenting features and prognostic factors[J].Arch Neurol,1996,53(7):626-32.
[18]Chamberlain,M.C.,Radioisotope CSF flow studies in leptomeningeal metastases[J].J Neurooncol,1998,38(2-3):135-40.
[19]Le Rhun,E.and E.Galanis,Leptomeningeal metastases of solid cancer[J].Curr Opin Neurol,2016,29(6):797-805.
[20]Weston,C.L.,M.J.Glantz and J.R.Connor,Detection of cancer cells in the cerebrospinal fluid:current methods and future directions[J].Fluids Barriers CNS,2011,8(1):14.
[21]Nayak,L.,et al.Rare cell capture technology for the diagnosis of leptomeningeal metastasis in solid tumors[J].Neurology,2013,80(17):1598-605;discussion 1603.
[22]Dietemann,J.L.,et al.Normal and abnormal meningeal enhancement:MRI features[J].J Radiol,2005,86(11):1659-83.
[23]Niwinska,A.,et al.Determinants of prolonged survival for breast cancer patient groups with leptomeningeal metastasis(LM)[J].J Neurooncol,2018,138(1):191-198.
[24]Posner,J.B.and N.L.Chernik,Intracranial metastases from systemic cancer[J].Adv Neurol,1978,19:579-92.
[25]Kwon,J.,et al.Impact of multimodality approach for patients with leptomeningeal metastases from solid tumors[J].J Korean Med Sci,2014,29(8):1094-101.
[26]Chamberlain,M.C.,et al.Systemic therapy of brain metastases:non-small cell lung cancer,breast cancer,and melanoma[J].Neuro Oncol,2017,19(1):1-i24.
[27]Pircher,M.,et al.Lapatinib-plus-pegylated liposomal doxorubicin in advanced HER2-positive breast cancer following trastuzumab:a phase II trial[J].Anticancer Res,2015,35(1):517-21.
[28]Riess,J.W.,et al.Prolonged survival of patients with non-small-cell lung cancer with leptomeningeal carcinomatosis in the modern treatment era[J].Clin Lung Cancer,2014,15(3):202-6.
[29]Tanaka,T.,et al.Frequency of and variables associated with the EGFR mutation and its subtypes[J].Int J Cancer,2010,126(3):651-5.
[30]Xu,Q.,et al.Treatment and prognostic analysis of patients with leptomeningeal metastases from non-small cell lung cancer[J].Thorac Cancer,2015,6(4):407-12.
[31]Chan,O.S.,W.K.Leung and R.M.Yeung,Sustained response to standard dose osimertinib in a patient with plasma T790M-positive leptomeningeal metastases from primary lung adenocarcinoma[J].Asia Pac J Clin Oncol,2017,13(6):428-430.
[32]Bot,I.,C.U.Blank and D.Brandsma,Clinical and radiological response of leptomeningeal melanoma after whole brain radiotherapy and ipilimumab[J].J Neurol,2012,259(9):1976-8.
[33]Robert,C.,et al.Improved overall survival in melanoma with combined dabrafenib and trametinib[J].N Engl J Med,2015,372(1):30-9.
[34]Glantz,M.J.,et al.Route of intracerebrospinal fluid chemotherapy administration and efficacy of therapy in neoplastic meningitis[J].Cancer,2010,116(8):1947-52.
[35]Berg,S.L.and M.C.Chamberlain,Systemic chemotherapy,intrathecal chemotherapy,and symptom management in the treatment of leptomeningeal metastasis[J].Curr Oncol Rep,2003,5(1):29-40.
[36]Kramer,K.,et al.Targeted radioimmunotherapy for leptomeningeal cancer using(131)I-3F8[J].Med Pediatr Oncol,2000,35(6):716-8.
[37]Zimm,S.,et al.Cytosine arabinoside cerebrospinal fluid kinetics[J].Clin Pharmacol Ther,1984,35(6):826-30.
[38]Schaefer,N.,et al.Leptomeningeal melanomatosis:stabilization of disease due to radiation,temozolomide and intrathecal liposomal cytarabine[J].Acta Oncol,2011,50(8):1260-2.
[39]Le Rhun,E.,et al.Salvage intracerebrospinal fluid thiotepa in breast cancer-related leptomeningeal metastases:a retrospective case series[J].Anticancer Drugs,2013,24(10):1093-7.
[40]Scott,B.J.,et al.Concurrent intrathecal methotrexate and liposomal cytarabine for leptomeningeal metastasis from solid tumors:a retrospective cohort study[J].J Neurooncol,2014,119(2):361-8.
[41]Gururangan,S.,et al.Phase I trial of intrathecal spartaject busulfan in children with neoplastic meningitis:a Pediatric Brain Tumor Consortium Study(PBTC-004)[J].Clin Cancer Res,2006,12(5):1540-6.
[42]Chen,Y.M.,et al.Intrathecal gemcitabine chemotherapy for non-small cell lung cancer patients with meningeal carcinomatosis--a case report[J].Lung Cancer,2003,40(1):99-101.
[43]Cokgor,I.,A.H.Friedman and H.S.Friedman,Current options for the treatment of neoplastic meningitis[J].J Neurooncol,2002,60(1):79-88.
[44]Morris,P.G.,et al.Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy[J].J Thorac Oncol,2012,7(2):382-5.
[45]Schaefer,N.,et al.Leptomeningeal melanomatosis:stabilization of disease due to radiation,temozolomide and intrathecal liposomal cytarabine[J].Acta Oncol,2011,50(8):1260-2.
[46]Grewal,J.,M.G.Saria and S.Kesari,Novel approaches to treating leptomeningeal metastases[J].J Neurooncol,2012,106(2):225-34.
[47]Soffietti,R.,A.Pellerino and R.Ruda,Neuro-oncology perspective of treatment options in metastatic breast cancer[J].Future Oncol,2018,14(17):1765-1774.
[48]Jung,T.Y.,W.K.Chung and I.J.Oh,The prognostic significance of surgically treated hydrocephalus in leptomeningeal metastases[J].Clin Neurol Neurosurg,2014,119:80-3.
[49]Passarin,M.G.,et al.Leptomeningeal metastasis from solid tumors:a diagnostic and therapeutic challenge[J].Neurol Sci,2015,36(1):117-23.
[50]Shaw,A.and E.A.Chiocca,Neoplastic meningitis[J].J Neurosurg,2011,115(4):728-9;discussion 729.
[51]Soffietti,R.,A.Pellerino and R.Ruda,Neuro-oncology perspective of treatment options in metastatic breast cancer[J].Future Oncol,2018,14(17):1765-1774.
[52]Nabors,L.B.,et al.NCCN Guidelines Insights:Central Nervous System Cancers,Version 1.2017[J].J Natl Compr Canc Netw,2017,15(11):1331-1345.
[53]Herrlinger,U.,et al.Leptomeningeal metastasis:survival and prognostic factors in 155 patients[J].J Neurol Sci,2004,223(2):167-78.
[54]Soffietti,R.,A.Pellerino and R.Ruda,Neuro-oncology perspective of treatment options in metastatic breast cancer[J].Future Oncol,2018,14(17):1765-1774.
[55]Morris,P.G.,et al.Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy[J].J Thorac Oncol,2012,7(2):382-5.
[56]Clatot,F.,et al.Clinical improvement and survival in breast cancer leptomeningeal metastasis correlate with the cytologic response to intrathecal chemotherapy[J].J Neurooncol,2009,95(3):421-426.
[57]Morris,P.G.,et al.Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy[J].J Thorac Oncol,2012,7(2):382-5.
[58]Subira,D.,et al.Diagnostic and prognostic significance of flow cytometry immunophenotyping in patients with leptomeningeal carcinomatosis[J].Clin Exp Metastasis,2015,32(4):383-91.
[59]Palma,J.A.,et al.Leptomeningeal carcinomatosis:prognostic value of clinical,cerebrospinal fluid,and neuroimaging features[J].Clin Neurol Neurosurg,2013,115(1):19-25.
[60]Chamberlain,M.C.,Leptomeningeal metastases in the MRI era[J].Neurology,2011,76(2):200;author reply 200-1.
[61]Soffietti,R.,A.Pellerino and R.Ruda,Neuro-oncology perspective of treatment options in metastatic breast cancer[J].Future Oncol,2018,14(17):1765-1774.
[62]Li,N.,et al.Clinical features and prognostic factors in patients with leptomeningeal metastases[J].Zhonghua Zhong Liu Za Zhi,2013,35(11):867-70.
[63]Zhang,Z.,et al.Diagnostic Value of CYFRA 21-1 in the Cerebrospinal Fluid for Leptomeningeal Metastasis[J].Dis Markers,2017,2017:2467870.
[64]Riess,J.W.,et al.Prolonged survival of patients with non-small-cell lung cancer with leptomeningeal carcinomatosis in the modern treatment era[J].Clin Lung Cancer,2014,15(3):202-6.
[65]Nakamichi,S.,et al.Successful EGFR-TKI rechallenge of leptomeningeal carcinomatosis after gefitinib-induced interstitial lung disease[J].Jpn J Clin Oncol,2013,43(4):422-5.
[66]Pan,W.,et al.KRAS mutation is a weak,but valid predictor for poor prognosis and treatment outcomes in NSCLC:A meta-analysis of 41 studies[J].Oncotarget,2016,7(7):8373-88.
[67]Harstad,L.,K.R.Hess and M.D.Groves,Prognostic factors and outcomes in patients with leptomeningeal melanomatosis[J].Neuro Oncol,2008,10(6):1010-8.
[68]Geukes,F.M.,et al.Targeted treatment and immunotherapy in leptomeningeal metastases from melanoma[J].Ann Oncol,2016,27(6):1138-42.
[69]De Mattos-Arruda,L.,et al.Cerebrospinal fluid-derived circulating tumour DNA better represents the genomic alterations of brain tumours than plasma[J].Nat Commun,2015,6:8839.
[70]Renbarger,J.,et al.Plasma and cerebrospinal fluid pharmacokinetics of SU5416 after intravenous administration in nonhuman primates[J].Cancer Chemother Pharmacol,2004,53(1):39-42.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/17181.html