SCI论文(www.lunwensci.com):
摘要:目的评估血清肿瘤标志物CEA和CA19-9在接受5-氟尿嘧啶为基础化疗联合贝伐单抗治疗的转移性结直肠癌患者疾病进展中的早期预测作用。方法选取2016年1月至2019年1月我院收治的72例血清CEA或CA19-9基线水平较高的患者,评估血清CEA和CA19-9在治疗过程中的变化在早期预测疾病进展中的作用,通过ROC分析计算不同临界值的敏感性、特异性和预测值,以区分PD与SD/PR/CR。评估有肿瘤标志物缓解的患者和有肿瘤标志物缓解的SD或PD患者之间PFS和OS的差异。采用Kaplan-Meier法测定PFS和OS,采用对数秩检验对各组进行比较。结果通过计算得到ROC曲线下面积,CEA临界值0.83CA19-9临界值0.80以及可作为用于区分疾病进展(PD)与疾病稳定(SD)、部分缓解(PR)和完全缓解(CR)。结论血清肿瘤标志物CEA和CA19-9升高可能预示着接受5-氟尿嘧啶为主的化疗和贝伐单抗治疗的转移性结直肠癌患者疾病发生进展。
关键词:卡培他滨;CEA;CA19-9;结直肠癌;贝伐单抗;5-氟尿嘧啶;肿瘤标志物
本文引用格式:姚丽君.CEA和CA19-9早期预测接受5-氟尿嘧啶化疗联合贝伐单抗治疗的转移性结直肠癌患者疾病进展的应用研究[J].世界最新医学信息文摘,2019,19(59):179-181,184.
Early Application of CEA and CA19-9 in Predicting Disease Progression in Patients with Metastatic Colorectal Cancer Treated with 5-fluorouracil Plus Bevacizumab
YAO Li-jun
(Department of Oncology,Ninth People’s Hospital,Suzhou Jiangsu)
ABSTRACT:Objective To evaluate the early predictive role of serum tumor markers CEA and CA19-9 in the progression of disease in patients with metastatic colorectal cancer treated with 5-fluorouracil-based chemotherapy combined with bevacizumab.Methods Seventy-two patients with high serum CEA or CA19-9 baseline levels were enrolled in our hospital from January 2016 to January 2019.The changes in serum CEA and CA19-9 during treatment were evaluated in early prediction of disease progression.The role of the sensitivity,specificity and predictive value of different thresholds by ROC analysis to distinguish between PD and SD/PR/CR.Differences in PFS and OS between patients with tumor marker response and SD or PD patients with tumor marker response were assessed.PFS and OS were determined by Kaplan-Meier method,and each group was compared by log-rank test.Results The area under the ROC curve was calculated by calculation.The critical value of CEA was 0.83 CA19-9 with a critical value of 0.80 and was used to distinguish disease progression(PD)from disease stabilization(SD),partial remission(PR),and complete remission(CR).Conclusions Elevated serum tumor markers CEA and CA19-9 may be predictive of disease progression in patients with metastatic colorectal cancer treated with 5-fluorouracil-based chemotherapy and bevacizumab.
KEY WORDS:Capecitabine;CEA;CA19-9;Colorectal cancer;Bevacizumab;5-fluorouracil;Tumor markers
0引言
贝伐单抗(BEV)是抗血管内皮生长因子(VEGF)的重组人源化单克隆抗体,是一种新的抗血管生成剂,常用于联合化疗治疗多种实体肿瘤[1]。治疗转移性结直肠癌(CRC)的方法通常是以5-氟尿嘧啶为基础的化疗,主要是XELOX、FOLFOX、FOLFIRI方案联合Bev。XELOX方案是奥沙利铂和卡培他滨的组合,与FOLFOX方案相比实现了相似的缓解率、无进展生存期(PFS)和总生存期(OS)。FOLFOX方案是奥沙利铂、氟尿嘧啶和亚叶酸钙的组合[2],FOLFIRI方案是伊立替康、氟尿嘧啶和亚叶酸钙的组合。这些化疗方案经常与抗血管生成剂Bev联合使用,可提高缓解率并延长PFS和OS[3]。对化疗的反应通过一系列的医学影像检查进行评估,通常是用CT检查并根据实体肿瘤评估标准(RECIST)[4]进行确定。监测反应的一种潜在简单且廉价的方法是重复测量肿瘤标志物,如癌胚抗原(CEA)和碳水化合物抗原19-9(CA19-9),这些肿瘤标志物通常在CRC中升高[5]。围手术期CEA水平升高的预后意义,以及在治疗期间监测CRC患者反应的实用性已得到充分证实[6]。CA19-9的预后价值特别适用于不能手术或手术切除的胰腺癌,而其在监测CRC患者中的临床应用尚未得到确切证实[7]。对这些肿瘤标志物的频繁监测可能有助于早期识别对治疗有反应的患者以及因疾病进展而应停止和改变治疗的患者。此外由于影像学检查研究的反应评估费时且在肿瘤临床实践中不具成本效益,因此使用肿瘤标志物可减少频繁CT扫描的需要,因此也可降低成本。尽管已经有研究报道了CEA和CA19-9的变化与常规化疗的反应之间的相关性,但没有详尽的数据来评估这些肿瘤标志物在监测接受化疗和抗血管生成剂Bev联合治疗的患者中的作用[8]。目前关于在CRC患者中使用肿瘤标志物的建议是基于已发表的研究数据,这些数据并没有特别关注使用Bev治疗的患者。然而Bev和化疗药物的作用机制完全不同,化疗联合Bev患者的CEA和CA19-9变化可能不同于常规化疗。本研究目的是评估血清肿瘤标志物CEA和CA19-9在接受5-氟尿嘧啶为主化疗和贝伐单抗治疗的转移性结直肠癌患者疾病进展中的早期预测作用,现报道如下。
1资料与方法
1.1一般资料
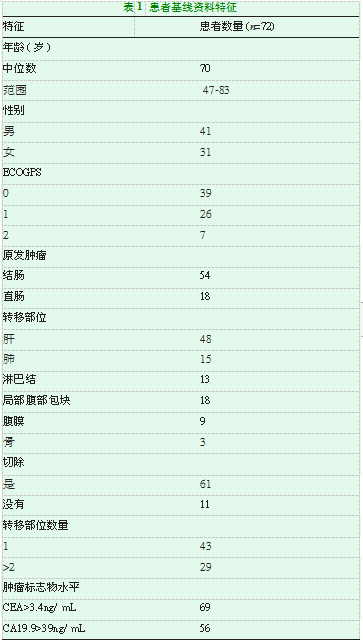
选取2016年1月至2019年1月我院收治的经病理活检证实的CRC患者,纳入标准:①年龄超过18岁;②ECOG评分标准为0~2级;③至少3个月的预期寿命;④充分的血检数据(中性粒细胞计数≥1.5×109/L,血小板计数≥100×109/L);⑤肌酐和总胆红素水平低于正常上限的1.25倍;⑥天冬氨酸和丙氨酸转氨酶低于正常上限的3倍;⑦无黑色素瘤、皮肤癌、宫颈原位癌或其他原发肿瘤;有92例CRC患者被转诊至我院肿瘤内科,并接受了5-氟尿嘧啶化疗和Bev联合治疗,筛选出符合研究标准的患者,87例患者因肿瘤标志物CEA和CA19-9的检测结果而被纳入本研究。监测完肿瘤标志物的87例患者中有72例具有高基线血清CEA或CA19-9水平,69例(79.3%)最初CEA水平升高,56例(64.3%)最初CA19-9水平升高。3例CA19-9水平升高,CEA正常。根据RECIST标准,4例达到CR、44例达到PR、22例达到SD、2例达到PD,见表1。本研究得到了本院伦理会员会的批准,所有患者都签署知情同意书接受治疗并匿名收集数据。
1.2方法
1.2.1患者评估
研究开始前2周内对患者进行预评估,包括详细的病史采集和体格检查、血常规及生化检查、胸腹部CT或MRI检查。在治疗过程中,每2周对患者进行完整的血常规及生化检查以及临床评估。在化疗前后每8周进行影像学评估,同时根据RECIST标准评估缓解率。此外还考虑了目标病变最大直径总和小于30%的轻微缓解标准,以便区分有缓解趋势的SD和有进展趋势的SD。
1.2.2肿瘤标志物
血清CEA和CA19-9水平通过酶免疫分析试剂盒测定,分别为3.4ng/mL和39ng/mL。化疗前和靶向治疗开始后每4周测定血清CEA和CA19-9水平。在我院肿瘤内科,肿瘤标志物监测是常规应用,以确定哪些患者的治疗可能是有益的。在这种情况下,如果在治疗开始后1个月内,以及根据影像检查记录的PD发生前4~6周内收集到CEA和CA19-9的数据,则认为这些数据是可评估的。肿瘤标志物CEA和CA19-9监测每4周检测一次,直到出现第一次有记录的疾病进展。往后每3个月测量一次CEA和CA19-9,直到死亡或失访。
1.2.3评估标准
对于肿瘤标志物降低的所有情况,敏感性定义为真阳性/(真阳性+假阴性),特异性定义为真阴性/(真阴性+假阳性),阳性预测值定义为真阳性/(真阳性+假阳性),阴性预测值定义为真阴性/(真阴性+假阴性)。
1.2.4统计学方法
本研究的主要终止点是评估血清CEA和CA19-9在治疗过程中的变化在早期预测疾病进展中的作用,治疗期间CEA和CA19-9的所有首次升高均与CT扫描根据RECIST标准确定的治疗缓解相关。确定与先前读数(4~6周前)相比的百分比上升,通过ROC分析计算不同临界值的敏感性、特异性和预测值,以区分PD与SD/PR/CR[9]。
第二个终止点是评估有肿瘤标志物缓解的患者和有肿瘤标志物缓解的SD或PD患者之间PFS和OS的差异。为了进行生存率分析,所有患者的肿瘤标志物缓解测定采用相同的时间点(治疗第2个月)。因此将治疗第2个月时有肿瘤标志物缓解的患者(即第一次影像学评价的时间点)的生存率与治疗第2个月时没有显示肿瘤标志物缓解的患者的生存率进行比较。
采用Kaplan-Meier法测定PFS和OS,采用对数秩检验对各组进行比较,所有数据均使用Med-Calc15.6.1版本统计软件进行分析。
2结果
2.1血清CEA和CA19-9在治疗过程中早期预测疾病进展中的作用评估
分别在在71例和56例患者中发现了CEA和CA19-9水平首次升高,图1(a)显示了区分PD与SD/PR/CR的CEA临界值的ROC分析,曲线下面积为0.83,95%置信区间为0.73~0.91。在计算的临界水平超过28%时,CEA升高识别PD敏感性为85.4%,特异性为71.4%。CEA升高50%以上时,可识别PD的特异性为96.4%。图1(b)显示了区分PD与SD/PR/CR的CA19-9临界值的ROC分析,曲线下的面积为0.80,95%置信区间为0.69~0.89。在估算的临界水平超过22%时,CA19-9升高识别PD敏感性89.7%,特异性为59.3%。CA19-9升高超过50%时可识别PD的特异性为92.6%。还分析了联合肿瘤标志物的使用,同时升高至少25%的CEA和CA19.9水平用以区分PD与SD/PR/CR的敏感性84.8%,特异性98.6%,阳性预测值93.3%,阴性预测值96.6%。
2.2血清CEA和CA19-9检测对区分CR/PR与SD/PD的作用
表2显示了区分CR/PR与SD/PD的敏感性、特异性以及阳性和阴性预测值,CEA和CA19-9下降至少25%以区分CR/PR和无缓解(SD+PD)的阳性预测值分别为96.6%和90.1%。
表2连续检测CEA和CA19-9的敏感性、特异性和阳性和阴性预测值(临界水平:降低≥25%)用于区分缓解(CR+PR)和无缓解(SD+PD),参照影像学检查(RECIST标准)。
2.3有肿瘤标志物缓解的患者以及SD或PD患者之间PFS和OS的差异评估
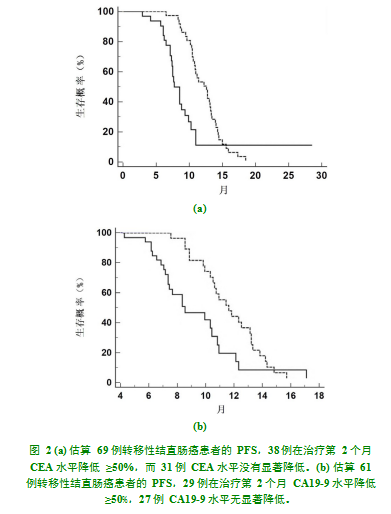
随访时间中位数16.7个月,范围(6.4~42.3)月。PFS中位数10.6个月(95%置信区间:8.4~11.7),38例患者治疗第2个月时CEA水平至少降低50%,与治疗前水平相比其PFS中位数12.2个月明显长于其余31例没有显著降低甚至增加CEA水平[中位数:7.6个月;P=0.002;图2(a)]的患者。29例患者在治疗第2个月时与治疗前水平相比,CA19-9水平至少降低50%,其PFS中位数11.6个月明显长于其余27名患者,而CA19-9水平没有显著降低甚至增加[中位数:8.2个月;P=0.009;图2(b)]。截止2019年1月1日有27名患者死亡,未达到OS中位数。
3讨论
肿瘤标志物CEA和CA19-9常被用于监测全身治疗期间转移性结直肠癌患者,本研究探讨了这些肿瘤标志物的监测是否能准确预测化疗联合抗血管生成剂Bev的缓解。尽管样本量相对较小,但所有患者均接受了均匀的抗肿瘤治疗,肿瘤标志物的测量和缓解评估均以恒定的时间间隔进行。CEA阳性和CA19-9阳性患者的比例与其他研究通常报告的比例相似,缓解率(66.6%)和中位PFS(10.6个月)与其他大型试验中通常报告的一致[10]。
本研究中CEA的临界值为0.83,ROC分析的CA19-9的临界值为0.80,见图1和图2。这两个肿瘤标志物在早期区分PD和SD/PR/CR方面的准确率很好,如RECIST标准所述。尽管CEA和CA19-9在治疗过程中的作用仍存在争议,但这些发现表明,在5-氟尿嘧啶化疗联合Bev治疗期间这些标志物的增加可能会早期提示PD的发生,随后可通过影像学检查证实。所以频繁测量CEA和CA19-9在XELOX、FOLFOX、FOLFIRI方案联合BEV治疗期间有助于早期确定患者是否可以继续治疗,或患者是否因为疾病进展的高风险而必须进行CT检查。在没有标志物增加的情况下,治疗可以继续进行而疾病不会立即有进展的风险,这可以降低频繁和重复的影像学检查的需要。由于治疗期间癌细胞的大量破坏,可能会在某些实体肿瘤中出现血清肿瘤标志物水平的短暂升高,并且可能被解释为无效的化疗[11]。这种情况在本研究中,CEA或CA19-9水平的所有增加总是与PD或甚至SD相关,但从不与CR/PR相关。
美国临床肿瘤学会推荐CEA作为全身治疗期间监测转移性结直肠癌患者的首选标志物,而认为CA19-9的数据不足以为该标志物提供重要参考[12]。有研究报道CEA减少特别是CEA动力学,是监测接受新化疗方案的转移性结直肠癌患者疗效的准确方法[6]。本研究的数据证实CEA是评估疗效的最有用的标志物,与CA19-9相比在区分CR/PR与无缓解的鉴别方面,它在约80%的患者中升高,具有更好的敏感性和更好的阳性预测价值,见表2。但是CEA和CA19-9的联合应用有助于区分PD和非PD,因为它实现了高阳性预测值(93.3%),即最小化假阳性事件的数量。有回顾性研究报道了CA19-9(而非CEA)在监测转移性结直肠癌新化疗方案治疗期间的疗效方面具有重要的预测价值[13]。
需要考虑的是,大多数关于转移性结直肠癌肿瘤标志物的报告数据都是指旧的治疗方法,如氟尿嘧啶和亚叶酸钙[14]。所以有研究表明CEA和CA19-9也可用于监测由卡培他滨与奥沙利铂和抗血管生成剂Bev组合的治疗方法中的疾病。
很明显CEA和CA19-9不能取代影像学检查在评估全身化疗治疗的转移性结直肠癌患者的疗效中的应用,尤其是在旨在证明新药物抗肿瘤疗效的随机临床试验中。但是在日常临床实践中,如其他研究报告所述[15],检测CEA和CA19-9可减少患者重复进行CT检查的需要,从而显著降低这些肿瘤标志物的含量。在本研究中估计CEA下降至少可以让25%的患者节省35%的CT检查,CA19-9下降至少可以让25%的患者可以节省30%的CT检查。同时出现CEA和CA19-9下降至少可以让25%的患者可以节省23%的CT检查。另外当用常规影像学检查难以评估疗效时,血清CEA和CA19-9的测量可以用作监测腹膜扩散患者的Bev联合XELOX、FOLFOX、FOLFIRI方案治疗的有效方法。
治疗第2个月CEA和CA19-9水平显著降低,不仅可以预测Bev联合XELOX、FOLFOX、FOLFIRI方案的疗效,而且可预测更好PFS的预后因素[图2(a)和(b)]。与本研究结果一致,其他研究报道了化疗期间这些肿瘤标志物的减少与得到CR或PR的概率显著增加以及得到更好的PFS之间的紧密相关[16]。所以尽管这些发现需要在对新型靶向药物进行的大型试验中得到证实,但CEA和CA19-9的显著降低也可用作为化疗和Bev治疗的转移性结直肠癌中PFS的替代终点。
综上所述,在转移性结直肠癌患者中反复测量CEA和CA19-9对于监测5-氟尿嘧啶化疗联合抗血管生成剂Bev的疗效是有用的。这些肿瘤标志物的升高可能预示着疾病的进展,随后通过影像学检查结果证实。
参考文献
[1]Braghiroli MI,Sabbaga J,Hoff PM.Bevacizumab:overview of the literature[J].Expert Rev Anticancer Ther,2012,12(5):567-80.
[2]Maroun J,Marginean H,Jonker D,et al.A Phase I Study of Irinotecan,Capecitabine(Xeloda),and Oxaliplatin in Patients With Advanced Colorectal Cancer[J].Clin Colorectal Cancer,2018,17(2):e257-e268.
[3]Saltz LB,Clarke S,Díaz-Rubio E,et al.Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer:a randomized phase III study[J].J Clin Oncol,2008,26(12):2013-9.
[4]Litière S,Collette S,de Vries EG,et al.RECIST-learning from the past to build the future[J].Nat Rev Clin Oncol,2017,14(3):187-192.
[5]Jia J,Zhang P,Gou M,et al.The Role of Serum CEA and CA19-9 in Efficacy Evaluations and Progression-Free Survival Predictions for Patients Treated with Cetuximab Combined with FOLFOX4 or FOLFIRI as a First-Line Treatment for Advanced Colorectal Cancer[J].Dis Markers,2019,2019:6812045.
[6]Yu P,Zhou M,Qu J,et al.The dynamic monitoring of CEA in response to chemotherapy and prognosis of mCRC patients[J].BMC Cancer,2018,18(1):1076.
[7]Usón Junior P,Callegaro-Filho D,Bugano D,et al.Predictive Value of Serum Carbohydrate Antigen 19-9(CA19-9)for Early Mortality in Advanced Pancreatic Cancer[J].J Gastrointest Cancer,2018,49(4):481-486.
[8]Kim IH,Lee JE,Yang JH,et al.Clinical significance of changes in systemic inflammatory markers and carcinoembryonic antigen levels in predicting metastatic colorectal cancer prognosis and chemotherapy response[J].Asia Pac J Clin Oncol,2018,14(3):239-246.
[9]Bossuyt PM.Interpreting diagnostic test accuracy studies[J].Semin Hematol,2008,45(3):189-95.
[10]Cremolini C,Moretto R,Masi G,et al.Safety profile of capecitabine as maintenance treatment after induction with XELOX or FOLFOX in metastatic colorectal cancer patients[J].Ann Oncol,2016,27(9):1810.
[11]Colloca GA,Venturino A,Guarneri D.Carcinoembryonic antigen reduction after medical treatment in patients with metastatic colorectal cancer:a systematic review and meta-analysis[J].Int J Colorectal Dis,2019,34(4):657-666.
[12]Berger AW,Schwerdel D,Reinacher-Schick A,et al.A Blood-Based Multi Marker Assay Supports the Differential Diagnosis of Early-Stage Pancreatic Cancer[J].Theranostics,2019,9(5):1280-1287.
[13]Holch JW,Ricard I,Stintzing S,et al.Relevance of baseline carcinoembryonic antigen for first-line treatment against metastatic colorectal cancer with
FOLFIRI plus cetuximab or bevacizumab(FIRE-3 trial)[J].Eur J Cancer,2019,106:115-125.
[14]Wein A,Siebler J,Wolff K,et al.Weekly High-dose 5-Fluorouracil as 24-hour Infusion Combined with Sodium Folinic Acid(AIO regimen)Plus Irinotecan in Second-line and Sequential Therapy of Metastatic Colorectal Cancer(CRC)[J].Anticancer Res,2017,37(7):3771-3779.
[15]Hanke B,Riedel C,Lampert S,et al.CEA and CA 19-9 measurement as a monitoring parameter in metastatic colorectal cancer(CRC)under palliative first-line chemotherapy with weekly 24-hour infusion of high-dose 5-fluorouracil(5-FU)and folinic acid(FA)[J].Ann Oncol,2001,12(2):221-6.
[16]Kurematsu N,Yoshino M,Sasaki N,et al.Survey of Cholinergic Symptoms in Patients with Colorectal Cancer Who Were Receiving Irinotecan Hydrochloride Combination Chemotherapy[J].Gan To Kagaku Ryoho,2018,45(11):1619-1623.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/16614.html