【摘要】目的:分析胃癌组织1-磷酸神经鞘氨醇受体(S1PR1)、干扰素基因刺激因子(STING)、扣针蛋白5(FBLN5)表达水平与病理特征的相关性。方法:回顾性分析2019年6月至2022年6月该院收治的102例胃癌患者的临床资料,采集患者胃癌组织及癌旁组织标本切片,检测S1PR1、STING、FBLN5的阳性率。比较胃癌组织、癌旁组织和不同临床病理特征胃癌患者S1PR1、STING、FBLN5的阳性率。结果:胃癌组织S1PR1、FBLN5阳性率高于癌旁组织,STING阳性率低于癌旁组织,差异均有统计学意义(P<0.05);临床分期Ⅲ~Ⅳ期、低分化程度、淋巴结转移等胃癌患者S1PR1、FBLN5阳性率均高于临床分期Ⅰ~Ⅱ期、中高分化程度、无淋巴结转移胃癌患者,差异有统计学意义(P<0.05);临床分期Ⅲ~Ⅳ期、低分化程度、淋巴结转移胃癌患者STING阳性率均低于临床分期Ⅰ~Ⅱ期、中高分化程度、无淋巴结转移胃癌患者,差异有统计学意义(P<0.05)。结论:胃癌组织S1PR1、FBLN5阳性率高于癌旁组织,STING阳性率低于癌旁组织,三者表达水平均与病理特征密切相关。
【关键词】胃癌,1-磷酸神经鞘氨醇受体,干扰素基因刺激因子,扣针蛋白5,病理特征,相关性
胃癌为临床常见的消化系统恶性肿瘤之一,根治性切除手术是目前临床常用的胃癌治疗手段,因此,寻找可评估胃癌患者病情及预后转归的标志物意义重大[1-2]。1-磷酸神经鞘氨醇受体(S1PR1)可间接介导肿瘤的发生、发展[3]。干扰素基因刺激因子(STING)信号通路可间接参与肿瘤细胞的凋亡过程[4]。扣针蛋白5(FBLN5)在多种恶性肿瘤发生、发展过程中起至关重要的作用[5]。本文分析胃癌组织S1PR1、STING、FBLN5表达水平与病理特征的相关性。
1资料与方法
1.1一般资料回顾性分析2019年6月至2022年6月本院收治的102例胃癌患者的临床资料。纳入标准:符合《胃癌规范化诊疗指南(试行)》中胃癌诊断标准[6];经病理检查确诊;入院前无任何抗肿瘤治疗史;临床资料完整。排除标准:合并其他恶性肿瘤;预计生存期<6个月;神志异常或伴有精神系统疾病;既往有脑血管意外和(或)血液系统疾病史;合并肝、肾、肺等脏器重大病变。其中男61例,女41例;年龄34~79岁,平均(60.23±6.87)岁;肿瘤直径1.5~9.4 cm,平均(5.13±1.40)cm;临床分期:Ⅰ~Ⅱ期42例,Ⅲ~Ⅳ期60例;分化程度:低分化53例,中高分化49例;淋巴结转移56例;合并基础疾病:高血压27例,糖尿病25例,冠心病19例。
1.2方法采集患者胃癌组织及癌旁组织标本切片,采用组织脱水机进行脱水,随后进行组织透明、浸蜡,包埋切片,烤片脱蜡,实施时长10 min的抗原修复处理,置于室温条件下孵育15 min。随后滴加一抗,置于4℃条件下孵育过夜,磷酸缓冲盐溶液(PBS)重复洗涤之后滴加二抗孵育过夜,再以PBS重复洗涤之后滴加显色剂,选用苏木素复染色,脱水后行中性树胶封片,光镜下观察。
结果判定:所有标本均选用400倍视野,随机选取3个区域进行拍照留存,检测蛋白表达情况。以PBS代替一抗作为阴性对照,以已知阳性切片作为阳性对照。其中S1PR1表达于细胞膜或细胞质;STING表达于细胞质;FBLN5表达于细胞膜。根据细胞染色程度与阳性细胞占比积分进行判定,由2名经验丰富的病理科医师以双盲法完成。染色程度积分0~3分,分别对应无色、淡黄色、棕黄色及棕褐色。阳性细胞占比积分0~4分,分别对应阳性细胞占比≤5%、6%~25%、26%~50%、51%~75%、>75%。将以上两项积分的乘积视作最终结果,≤1分即阴性,≥2分即阳性。
1.3观察指标(1)比较胃癌组织、癌旁组织中S1PR1、STING、FBLN5阳性率。(2)比较不同临床病理特征胃癌患者的S1PR1、STING、FBLN5阳性率。
1.4统计学方法应用SPSS 21.0软件进行统计学分析,计量资料以(x—±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
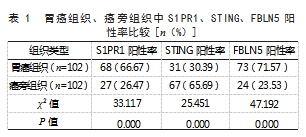
2.1胃癌组织、癌旁组织中S1PR1、STING、FBLN5阳性率比较胃癌组织S1PR1、FBLN5阳性率高于癌旁组织,STING阳性率低于癌旁组织,差异均有统计学意义(P<0.05)。见表1。
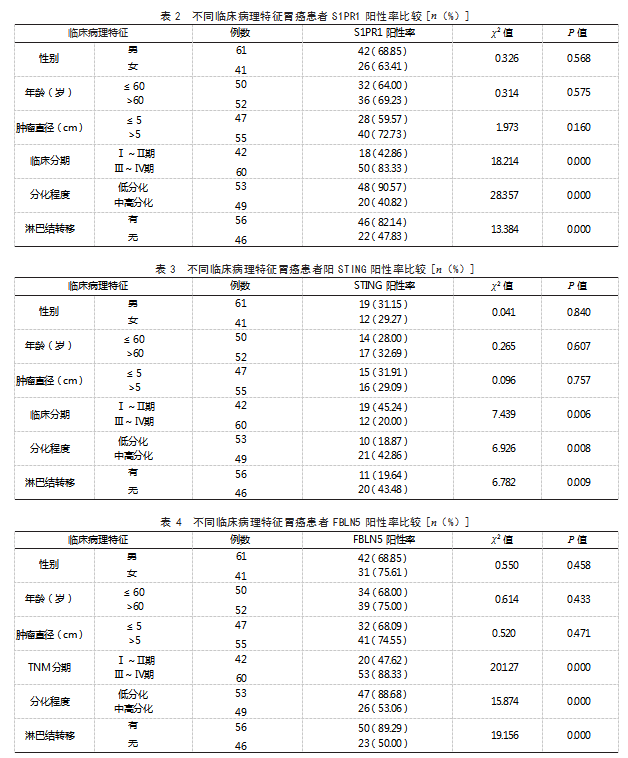
2.2不同临床病理特征胃癌患者S1PR1阳性率比较不同性别、年龄、肿瘤直径胃癌患者S1PR1阳性率比较,差异均无统计学意义(P>0.05);临床分期Ⅲ~Ⅳ期、低分化程度、淋巴结转移胃癌患者S1PR1阳性率均高于临床分期Ⅰ~Ⅱ期、中高分化程度、无淋巴结转移患者,差异有统计学意义(P<0.05)。见表2。
2.3不同临床病理特征胃癌患者STING阳性率比较不同性别、年龄、肿瘤直径胃癌患者STING阳性率比较,差异均无统计学意义(P>0.05);临床分期Ⅲ~Ⅳ期、低分化程度、淋巴结转移胃癌患者STING阳性率均低于临床分期Ⅰ~Ⅱ期、中高分化程度、无淋巴结转移患者,差异有统计学意义(P<0.05)。见表3。
2.4不同临床病理特征胃癌患者FBLN5阳性率比较不同性别、年龄、肿瘤直径胃癌患者FBLN5阳性率比较,差异均无统计学意义(P>0.05);临床分期Ⅲ~Ⅳ期、低分化程度、淋巴结转移胃癌患者FBLN5阳性率均高于临床分期Ⅰ~Ⅱ期、中高分化程度、无淋巴结转移患者,差异有统计学意义(P<0.05)。见表4。
3讨论
胃癌的发生、发展与幽门螺杆菌感染、生活方式、家族史等有关[7-8]。随着人们对胃癌分子生物学特点的认知持续加深,单克隆抗体靶向治疗以及免疫治疗等逐渐应用于临床[9-10]。1-磷酸神经鞘氨醇(S1P)是关键性细胞膜鞘磷脂代谢产物之一,可调控细胞生长、分化及免疫应答等,而S1PR1为S1P的G蛋白偶联受体,二者结合之后可促进肿瘤细胞增殖与侵袭[11-12]。STING为免疫反应的重要分子之一,可抑制肿瘤细胞的侵袭、转移[13]。FBLN5属于FBLN家族重要成员之一,在肿瘤疾病的发生、发展过程中扮演重要角色[14]。
本研究结果显示,胃癌组织S1PR1、FBLN5阳性率均高于癌旁组织,STING阳性率低于癌旁组织。分析原因为S1PR1可通过与S1P特异性结合,进而激活SPHK1/S1P/S1PR1信号通路,促进肿瘤生长、增殖[15]。STING蛋白在肿瘤环境中存活及增殖,扮演抑癌基因的角色[16]。FBLN5属于纤维蛋白,在胃癌中起着促癌基因的作用[17]。
本研究结果同时显示,临床分期Ⅲ~Ⅳ期、低分化程度、淋巴结转移胃癌患者S1PR1、FBLN5阳性率均高于临床分期Ⅰ~Ⅱ期、中高分化程度、无淋巴结转移患者,STING阳性率低于临床分期Ⅰ~Ⅱ期、中高分化程度、无淋巴结转移患者。分析原因为高水平S1PR1可激活ERK1/2及PI3K/AKT通路,间接增强了肿瘤细胞的增殖及侵袭能力。STING具有免疫监视功能,其水平降低有利于肿瘤细胞的转移、浸润。高水平FBLN5可通过调节氧化应激、血管生成等途径,促进肿瘤细胞的增殖、迁移以及侵袭。
综上所述,胃癌组织S1PR1、FBLN5阳性率均高于癌旁组织,STING阳性率低于癌旁组织,三者表达水平均与病理特征密切相关。
参考文献
[1]法良玲,孙伟,黄臻,等.长链非编码RNA 00941、微小RNA-145表达及转化生长因子β1/Smad通路相关因子在胃癌组织中的表达及意义[J].陕西医学杂志,2024,53(10):1416-1421.
[2]戴艳环,陈莉,张伟,等.胃癌血清学中癌胚抗原(CEA)、糖类抗原199(CA199)、糖类抗原724(CA724)、胃蛋白酶原Ⅰ(PGI)和胃蛋白酶原Ⅱ(PGⅡ)的表达及意义探讨[J].系统医学,2024,9(7):19-22.
[3]范学亮,王中山,王春锋.三阴性乳腺癌患者中S1PR1、Caspase-3的表达及其与病理特征的关系分析[J].临床医学工程,2023,30(6):867-868.
[4]李正,方钱,杨明金,等.在肺腺癌组织中低表达的STING可通过抑制内质网应激促进肺腺癌进展[J].中国肿瘤生物治疗杂志,2023,30(4):309-317.
[5]杨晔,党荣广,张静,等.扣针蛋白5(FBLN5)在肺癌组织中表达及对肺癌细胞增殖、迁移及侵袭的影响[J].广西医科大学学报,2022,39(7):1093-1099.
[6]中华人民共和国国家卫生和计划生育委员会.胃癌规范化诊疗指南(试行)[J].中国医学前沿杂志(电子版),2013(8):56-63.
[7]Guo X,Peng Y,Song Q,et al.A Liquid Biopsy Signature for the Early Detection of Gastric Cancer in Patients[J].Gastroenterology,2023,165(2):402-413.
[8]夏天红,曹小萌,袁绍斌,等.Ca2+依赖的膜结合蛋白7在胃癌中的表达及临床意义[J].中国肿瘤临床,2023,50(4):179-185.
[9]耿志军,黄菊,李晴晴,等.丝氨酸/苏氨酸磷酸蛋白磷酸酶4C在胃癌中的表达水平及其与预后的相关性[J].中国医学科学院学报,2023,45(5):721-729.
[10]张磊,孙晓娜,张丽,等.胃癌组织中E-cadherin、Vimentin和错配修复相关蛋白的表达及与患者预后的关系[J].现代肿瘤医学,2023,31(18):3420-3427.
[11]Liu S,Ni C,Zhang D,et al.S1PR1 regulates the switch of two angiogenic modes by VE-cadherin phosphorylation in breast cancer[J].Cell Death&Disease,2019,10(3):200.
[12]刘加蒙,李明.S1PR1在胃癌组织中的表达及其临床意义[J].现代肿瘤医学,2024,32(1):93-95.
[13]杨督,田同德,张成辉,等.p-STAT3和STING蛋白在胃癌组织中的表达及相关性[J].现代肿瘤医学,2024,32(1):79-86.
[14]周谦,孟宁,刘晟楠,等.胃癌组织中ARHGAP4、FBLN5的表达及与病人预后的关系[J].临床外科杂志,2023,31(11):1057-1060.
[15]高振远,王雅萍,石默晗,等.SRPX2蛋白表达对晚期胃癌S-1联合奥沙利铂化疗疗效和预后的影响[J].齐齐哈尔医学院学报,2019,40(20):2509-2512.
[16]王芳,胡洁琼,冯彦虎,等.次乌头碱通过cGAS/STING通路调节胃癌细胞增殖、迁移、侵袭和免疫逃逸[J].中国免疫学杂志,2023,39(10):2178-2183.
[17]景娈恋,刘倩.FBLN5在前列腺癌组织中的表达及对前列腺癌细胞增殖、侵袭的影响[J].中国男科学杂志,2023,37(3):59-63.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/82377.html