【摘要】目的:探讨青年胃腺癌患者术前中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)及单核细胞/淋巴细胞比值(MLR)与青年胃腺癌的临床特征的关系。方法:回顾性分析2013年1月—2022年12月苏州大学附属第一医院收治的130例青年(18~35岁)胃腺癌患者的临床资料,另选取同期1 348例本院正常体检者(18~35岁)作为对照组。比较两组患者NLR、PLR、MLR水平。采用Spearman分析NLR、PLR、MLR的相关性。按照PLR、MLR、NLR中位数将病例组患者分为高、低组。比分析高、低PLR、MLR、NLR与临床病理特征、性别、临床症状的关系,并评估其对胃腺癌的诊断价值。结果:NLR与MLR、PLR与MLR、NLR与PLR均呈正相关(rs=0.738、0.630、0.665,P<0.001)。不同NLR水平患者T分期、N分期、M分期及TNM分期比较,差异无统计学意义(P>0.05)。不同PLR水平患者T分期、N分期及TNM分期比较,差异有统计学意义(P<0.05)。不同PLR水平患者M分期比较,差异无统计学意义(P>0.05)。不同MLR水平患者M分期比较,差异有统计学意义(P<0.05)。不同MLR水平患者T分期、N分期及TNM分期比较,差异无统计学意义(P>0.05)。不同NLR、PLR患者性别比较,差异有统计学意义(P<0.05)。不同MLR水平患者性别比较,差异无统计学意义(P>0.05)。不同PLR、MLR、NLR水平患者临床症状比较,差异无统计学意义(P>0.05)。经受试者工作特征(ROC)曲线分析,NLR、PLR、MLR对青年胃腺癌有一定的诊断效能。结论:术前NLR、PLR、MLR水平与青年胃腺癌的临床特征有着密切联系,可作为青年胃癌早期诊断的参考指标。
【关键词】中性粒细胞/淋巴细胞比值,血小板/淋巴细胞比值,单核细胞/淋巴细胞比值,青年胃腺癌
胃癌是影响当代人类生命健康及生活质量的重要疾病,是全球第五大常见肿瘤,也在癌症所致死亡率中排第3位[1],发病率一般随年龄增长逐渐增加,青年患者少见,但其预后较老年人差,生存率更低[2]。但是随着社会发展,生活作息习惯改变等因素,青年胃癌发病率的持续升高引起人们的重视[3]。中性粒细胞/淋巴细胞比值(NLR),血小板/淋巴细胞比值(PLR)及单核细胞/淋巴细胞比值(MLR)作为易获得的全身炎症标志物指标,广泛应用于早期肿瘤及多种疾病的评估[4-5]。术前PLR对胃癌近期和远期预后的预测价值也早已被证实,且在临床实践中相关数据具有快捷,经济,简便等优点,具有重要临床价值[6-7]。青年患者作为胃癌病例中的少见人群,需要更多的临床证据对其进行评估,由于多种因素的影响,青年与老年人相比其全身炎症免疫系统也具有明显差异[8]。据此,本研究通过探讨PLR、MLR、NLR与青年胃腺癌患者临床特征的联系,为临床诊治与评估提供更多的证据,现报告如下。
1资料与方法
1.1一般资料
回顾性分析2013年1月—2022年12月苏州大学附属第一医院收治的161例青年胃腺癌患者的临床资料。(1)纳入标准:①年龄18~35岁;②于本院择期行根治性胃切除术;③经本院病理科确诊为腺癌。(2)排除标准:①术前已行新辅助化疗;②既往已行胃部手术;③合并其他恶性肿瘤或全身性重大疾病等。依照纳排标准,共纳入130例患者作为病例组。收集同期1 348例本院正常体检者(年龄18~35岁)作为对照组。1 348例正常体检者中男542例,女806例;年龄31(28,33)岁。
130例青年胃腺癌患者中男52例,女78例;年龄31(28,33)岁,最小19岁,最大35岁;T分期:1期29例(22.3%),2期5例(3.8%),3期5例(3.8%),4期91例(70.0%);N分期:0期39例(30.0%),1期18例(13.8%),2期17例(13.1%),3期56例(43.1%);M分期:0期93例(71.5%),1期37例(28.5%);TNM分期:Ⅰ期26例(20.0%),Ⅱ期18例(13.8%),Ⅲ期49例(37.7%),Ⅳ期37例(28.5%)。两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经苏州大学附属第一医院医学伦理委员会审核批准,入组人员签署知情同意书。
1.2方法
收集性别、年龄、临床症状,青年胃腺癌分期标准按照第8版美国癌症联合委员会(AJCC)指南[9]进行TNM分期,根据术前血常规检查分别计算NLR、PLR、MLR等指标。比较两组患者NLR、PLR、MLR水平。采用Spearman分析NLR、PLR、MLR的相关性。按照PLR、MLR、NLR中位数将病例组患者分为高、低组。比较高、低PLR、MLR、NLR与临床病理特征、性别、临床症状的关系,并评估其对胃腺癌的诊断价值。本研究中临床病理资料来源于病例中患者的基本信息、病史及查体、术后病理报告等,经整理得出相关资料。
1.3统计学处理
应用SPSS 26.0统计学软件进行数据处理,计数资料用率(%)表示,以Shapiro-Wilk检验判断PLR、MLR、NLR均为非正态分布资料,计量资料用M(P25,P75)表示。高、低PLR、MLR、NLR组分别与病理特征进行Mann-Whitney U检验,并与性别和临床症状进行χ2检验,以受试者工作特征(ROC)曲线评价不同水平PLR、MLR、NLR的诊断效能,以P<0.05为差异有统计学意义。
2结果
2.1两组NLR、PLR、MLR水平比较
采用Wilcoxon秩和检验判断研究青年胃腺癌NLR、PLR、MLR与同时期正常体检者NLR、PLR、MLR是否有差异。结果显示,病例组NLR为1.91(1.30,3.01),与对照组的1.52(1.23,1.92)比较,差异有统计学意义(Z=-5.746,P<0.001)。病例组PLR为140.69(111.15,229.47),与对照组的113.99(92.51,138.97)比较,差异有统计学意义(Z=-7.521,P<0.001)。病例组MLR为0.24(0.18,0.33),与对照组的0.18(0.15,0.22)比较,差异有统计学意义(Z=-7.187,P<0.001)。
2.2 PLR、MLR、NLR的相关性
本研究采用Spearman相关分析青年胃癌患者的NLR与MLR、PLR与MLR、NLR与PLR的关系。结果显示,NLR与MLR、PLR与MLR、NLR与PLR均呈正相关(rs=0.738、0.630、0.665,P<0.001)。
2.3临床病理特征与不同PLR、MLR、NLR水平的关系
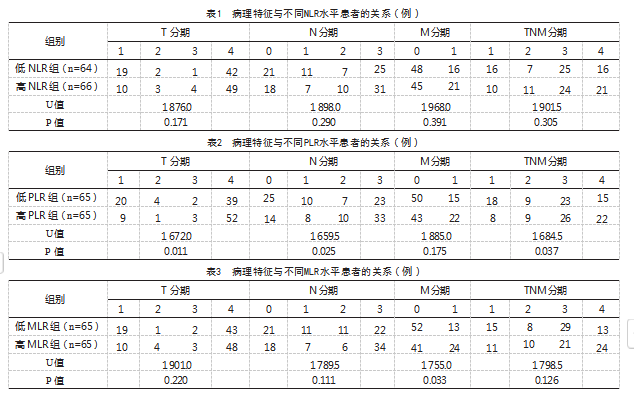
按照NLR、PLR、MLR中位数(分别为1.91、140.69、0.24)将病例组患者分别为高、低组。Mann-Whitney U检验结果显示,不同NLR水平患者T分期、N分期、M分期及TNM分期比较,差异无统计学意义(P>0.05),见表1。不同PLR水平患者T分期、N分期及TNM分期比较,差异有统计学意义(P<0.05);不同PLR水平患者M分期比较,差异无统计学意义(P>0.05),见表2。不同MLR水平患者M分期比较,差异有统计学意义(P<0.05);不同MLR水平患者T分期、N分期及TNM分期比较,差异无统计学意义(P>0.05),见表3。
2.4性别与不同PLR、MLR、NLR水平的关系
低NLR组男32例(61.5%),女32例(41.0%);高NLR组男20例(38.5%),女46例(59.0%);不同NLR患者性别比较,差异有统计学意义(χ2=5.253,P=0.022)。低PLR组男33例(63.5%),女32例(41.0%);高PLR组男19例(36.5%),女46例(59.0%)。不同PLR患者性别比较,差异有统计学意义(χ2=6.282,P=0.012)。低MLR组男30例(57.7%),女35例(44.9%);高MLR组男22例(42.3%),女43例(55.1%)。不同MLR水平患者性别比较,差异无统计学意义(χ2=2.051,P=0.152)。
2.5临床症状与不同PLR、MLR、NLR水平的关系
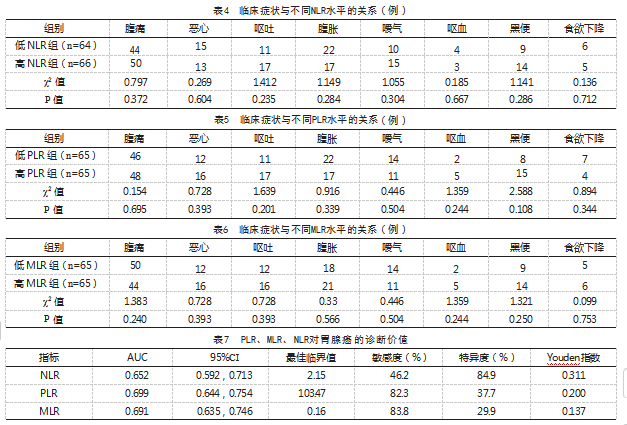
130例患者中腹痛94例(72.3%)、恶心28例(21.5%)、呕吐28例(21.5%)、腹胀39例(30.0%)、嗳气25例(19.2%)、呕血7例(5.4%)、黑便23例(17.7%)、食欲下降11例(8.5%);不同PLR、MLR、NLR水平临床症状比较,差异无统计学意义(P>0.05),见表4、表5、表6。
2.6 PLR、MLR、NLR对胃腺癌的诊断价值
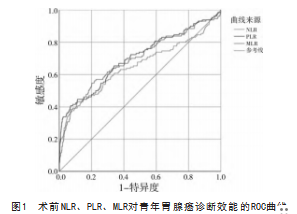
将130例青年胃腺癌患者与对照组PLR、MLR、NLR对胃腺癌诊断效能绘制相应的ROC曲线,结果显示NLR、PLR、MLR对青年胃腺癌有一定的诊断效能,见表7、图1。
3讨论
青年胃腺癌患者由于其少见性,症状的隐匿性,所以在其被明确诊断时往往已经处于中晚期,本文Ⅲ期+Ⅳ期患者占总样本的66.2%,发病率呈逐年上升的趋势,且相较于老年患者,青年胃腺癌往往倾向于更低的分化,更差的预后及生存期望,在全球范围内,青年患癌已经是越来越不容忽视的问题了[10-11]。在本研究中,全身炎症标志物为临床诊治中基础检查项目,其已经被证实在包括胃腺癌在内的多种恶性肿瘤具有重要临床意义[12-13]。NLR是细胞免疫活化的新的标志物,是应激和全身炎症的有效指标[7]。在胃癌的临床治疗中,胃镜病理和腹部增强CT是胃癌诊断和临床分期重要检查[14],但是往往因其价格和复杂的检查前准备而使推广变得困难,而NLR、PLR、MLR来源于血常规检查,具有快速简便、结果可信度高、可定期重复检测、价格亲民等特点,更加适合应用于临床筛查。
本研究结果显示,青年胃腺癌患者的NLR、PLR、MLR三者具有一定的相关性,NLR与MLR、PLR与MLR、NLR与PLR均呈正相关(rs=0.738、0.630、0.665,P<0.001)。究其原因,三者水平的升高不外乎淋巴细胞数目的减少及中性粒细胞、血小板、单核细胞数目的上升,这与胃癌患者的免疫细胞变化是相符的。本文中NLR水平与T分期、N分期、M分期及TNM分期无显著差异。PLR水平与T分期、N分期及TNM分期有显著差异,与M分期无显著差异,提示PLR数值越高往往意味着更高的肿瘤分期,更高可能的癌周淋巴转移,而与远处转移无明显相关。MLR水平与M分期差异显著,而与T分期,N分期及TNM分期差异显著。提示肿瘤的远处转移可能导致MLR水平升高。本文研究中MLR水平与患者性别组间比较无明显差异,而NLR、PLR水平与性别组间比较有显著差异,这与既往研究中提示NLR、MLR在性别组间存在显著差异有所不同[15],猜测可能是患癌使全身炎症指标全面升高,而致使男女性别间的差异减小,该推测需要更多的研究证明。青年患者症状以腹痛腹胀最为常见,与傅永吉等[16]研究一致,而NLR、PLR、MLR水平与腹痛、恶心、呕吐、腹胀、嗳气、呕血、黑便、食欲下降等临床症状的出现无明显统计学意义,但是与出现临床症状的严重程度是否有临床意义还需更多数据来研究。同时通过分析术前NLR、PLR、MLR对青年胃腺癌诊断效能的ROC曲线,笔者发现NLR、PLR、MLR对青年胃腺癌有一定的诊断效能,其中PLR的诊断效能高于NLR及MLR。PLR的受试者工作特征曲线下面积(AUC)为0.699,当PLR的临界值为103.47时,用于诊断胃腺癌的敏感度为82.3%,特异度为37.7%,Youden指数为0.200。NLR的AUC为0.652,当NLR的临界值为2.15时,用于诊断胃腺癌的敏感度为46.2%,特异度为84.9%,Youden指数为0.311。MLR的AUC为0.691,当MLR的临界值为0.16时,用于诊断胃腺癌的敏感度为83.8%,特异度为29.9%,Youden指数为0.137。Nguyen等[17]的研究结果表明其患者ROC曲线分析显示PLR(临界值135.0)和NLR(临界值2.0)对胃癌诊断具有显著的特异度和敏感度,AUC下面积分别为0.847 4和0.851 7。本研究受限于病例数量的限制及未能够与其他能导致患者全身炎症标志物变化的多种疾病进行对比,所以仍然需要进行更加详细的研究来验证此分析结果。但是不可否认的是,合理结合青年患者早期的临床症状,NLR、PLR、MLR异常变化仍能对青年胃腺癌的早期诊断及预后评估起到重要作用。
综上所述,本研究提示青年胃腺癌患者术前NLR、PLR、MLR水平与多个临床因素(浸润深度、TNM分期程度、淋巴结转移、性别)有关,而与腹胀、腹痛等临床症状无明显相关。这些结果表明,术前NLR、PLR、MLR水平有望能够成为青年胃腺癌早期筛查的生物标志物。同时术前NLR、PLR、MLR等全身炎症标志物水平对胃腺癌患者术后生存和预后也有一定的预判作用[18],这与本文所得出的结论也是一致的。考虑到NLR、PLR、MLR所涉及的是临床血液常规检测指标,价格便宜,性价比较高,所以青年胃癌诊治中有较广泛的前景,尤其是基层医院的初次诊治,可以为医生提供一定继续诊治的思路。除NLR、PLR、MLR之外,血清C反应蛋白(CRP)水平、白细胞(WBC)、纤维蛋白原等炎症指标也与多种癌症的高风险相关[19-20],未来可以联合多种炎症指标进行进一步的研究来评估其与青年胃腺癌之间的联系。本文所具有的创新性在于将炎症标志物与青年胃腺癌患者这一少见人群结合在一起,且将NLR、PLR、MLR三者一起纳入讨论。由于青年胃腺癌患者的隐匿性及不易察觉性,早期有效的观察指标很少,所以本研究中早期的炎症标志物升高可以对青年胃腺癌患者的诊治提供更多的证据,且未来可以将术前NLR、PLR、MLR与青年胃腺癌患者的预后进行联系,形成整体的诊治观点。另外由于本文回顾性单中心研究的局限,患者队列较少,术前NLR、PLR、MLR与青年胃腺癌之间的因果关系尚未完全明确,未来可以期待以多中心或更大样本或前瞻性研究来进一步证实术前NLR、PLR、MLR与青年胃腺癌之间的关系。
参考文献
[1]SMYTH E C,NILSSON M,GRABSCH H I,et al.Gastric cancer[J].Lancet,2020,396(10251):635-648.
[2]史玉雪,赵卫刚,钟少东,等.126例青年胃癌临床特点及预后分析[J].安徽医科大学学报,2023,58(5):867-871.
[3]SUNG H,SIEGEL R L,ROSENBERG P S,et al.Emerging cancer trends among young adults in the USA:analysis of a population-based cancer registry[J/OL].Lancet Public Health,2019,4(3):e137-e147.
[4]OHNO Y.Role of systemic inflammatory response markers in urological malignancy[J].Int J Urol,2019,26(1):31-47.
[5]GASPARYAN A Y,AYVAZYAN L,MUKANOVA U,et al. The platelet-to-lymphocyte ratio as an inflammatory marker in rheumatic diseases[J].Ann Lab Med,2019,39(4):345-357.
[6]MIYAMOTO R,INAGAWA S,SANO N,et al.The neutrophil-to-lymphocyte ratio(NLR)predicts short-term and long-term outcomes in gastric cancer patients[J].Eur J Surg Oncol,2018,44(5):607-612.
[7]ZAHOREC R.Neutrophil-to-lymphocyte ratio,past,present and future perspectives[J].Bratisl Lek Listy,2021,122(7):474-488.
[8]PIBER D,OLMSTEAD R,CHO J H,et al.Inflammaging:age and systemic,cellular,and nuclear inflammatory biology in older adults[J].J Gerontol A Biol Sci Med Sci,2019,74(11):1716-1724.
[9]AMIN M B,GREENE F L,EDGE S B,et al.The Eighth Edition AJCC Cancer Staging Manual:Continuing to build a bridge from a population-based to a more"personalized"approach to cancer staging[J].CA Cancer J Clin,2017,67(2):93-99.
[10]NAKATA K,HIYAMA E,KATANODA K,et al.Cancer in adolescents and young adults in Japan:epidemiology and cancer strategy[J].IntJ Clin Oncol,2022,27(1):7-15.
[11]FIDLER M M,GUPTA S,SOERJOMATARAM I,et al.Cancer incidence and mortality among young adults aged 20-39 years worldwide in 2012:a population-based study[J].Lancet Oncol,2017,18(12):1579-1589.
[12]CHEN Q,LI M,CHEN J,et al.AST·MLR index and operation injury condition are novel prognostic predictor for the prediction of survival in patients with colorectal cancer liver metastases undergoing surgical resection[J].BMC Cancer,2022,22(1):921.
[13]HE B,WU J.Clinical value of PLR,MLR,and NWR in neoadjuvant chemotherapy for locally advanced gastric cancer[J].Comput Math Methods Med,2022,2022:8005975.
[14]李凯.CACA胃癌整合诊治指南(精简版)[J].中国肿瘤临床,2022,49(14):703-710.
[15]MENG X,CHANG Q,LIU Y,et al.Determinant roles of gender and age on SII,PLR,NLR,LMR and MLR and their reference intervals defining in Henan,China:a posteriori and big-data-based[J/OL].J Clin Lab Anal,2018,32(2):e22228.
[16]傅永吉,彭飞,郭美,等.青年胃癌的临床特征[J].昆明医科大学学报,2021,42(5):81-86.
[17]NGUYEN M L T,PHAM C,LE Q V,et al.The diagnostic and prognostic value of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio on gastric cancer patients[J/OL].Medicine(Baltimore),2023,102(31):e34357.
[18]ZHANG Y,LU J J,DU Y P,et al.Prognostic value of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio in gastric cancer[J/OL].Medicine(Baltimore),2018,97(12):e0144.
[19]ZHU M,Ma Z,ZHANG X,et al.C-reactive protein and cancer risk:a pan-cancer study of prospective cohort and Mendelian randomization analysis[J].BMC Med,2022,20(1):301.
[20]DOS SANTOS SILVA I,DE STAVOLA B L,PIZZI C,et al.Circulating levels of coagulation and inflammation markers and cancer risks:individual participant analysis of data from three long-term cohorts[J].Int J Epidemiol,2010,39(3):699-709.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/80456.html