【摘要】目的:探讨阴道灌洗1号方联合乳酸杆菌治疗宫颈高危型人乳头瘤病毒(HR-HPV)持续感染的临床效果及对阴道微生态的影响。方法:选择2021年3月—2023年3月暨南大学附属第六医院妇科门诊收治的119例宫颈HR-HPV持续感染患者作为研究对象。随机分为三组,研究组(n=44)采用阴道灌洗1号方联合阴道用乳杆菌活菌胶囊治疗;干扰素组(n=41)采用人干扰素α2b阴道泡腾片治疗;空白组(n=34)拒绝用药治疗。观察三组HR-HPV转阴率及宫颈细胞学变化,分析三组阴道微生态的情况。结果:研究组HR-HPV转阴率为75.61%,高于干扰素组的52.63%及空白组的14.71%,差异有统计学意义(P<0.05)。治疗后,研究组细胞学升级率为2.44%,低于空白组的32.35%,差异有统计学意义(P<0.05)。研究组细胞学降级率为43.90%,高于干扰素组、空白组的21.05%、5.88%,差异有统计学意义(P<0.05)。治疗后,研究组过氧化氢(H2O2)、白细胞酯酶(LE)阴性占比均高于干扰素组及空白组,β-葡萄糖醛酸苷酶(GUS)、凝固酶(GADP)阴性占比高于空白组,差异有统计学意义(P<0.05)。结论:阴道灌洗1号方联合乳酸杆菌可高效清除宫颈HR-HPV感染,改善阴道微生态环境,抑制宫颈组织学升级。
【关键词】高危型人乳头瘤病毒,持续感染,阴道灌洗1号方,乳酸杆菌
近年来,子宫颈癌发病率、致死率一直居高不下。大量的临床和基础研究已证实高危型人乳头瘤病毒(HR-HPV)持续感染是子宫颈癌发生发展中的首要因素和必要条件[1]。至今,国内外尚无有效清除HPV感染的药物。宫颈HPV感染受很多种因素的影响。目前研究比较多的是阴道微生态的影响。女性阴道内的菌群与内环境、宿主形成相互协调、相互制约的动态平衡关系,从而抵御病原菌入侵。故多数女性感染HPV以后可通过阴道微环境及机体自身免疫系统清除,仅有5%~10%无法清除,发展为持续性感染。而乳杆菌作为阴道内优势菌,在维持阴道微生态平衡中发挥极为重要的作用[2]。另外,祖国医学洗液在妇科炎症、肿瘤治疗中有增效减毒的作用,已被临床广泛应用[3-4]。本研究采用中药阴道灌洗1号方联合乳酸杆菌治疗宫颈HR-HPV持续感染患者,同时与干扰素治疗、空白观察对比,探究用药的治疗效果,现报告如下。
1资料与方法
1.1一般资料
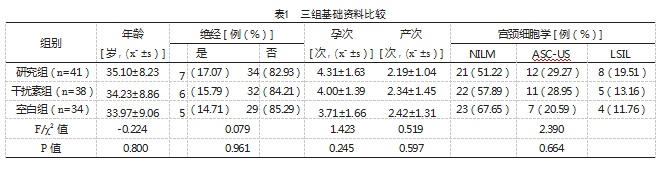
选择2021年3月—2023年3月暨南大学附属第六医院妇科门诊收治的119例宫颈HR-HPV持续感染者作为研究对象。纳入标准:(1)年龄20~50岁,既往月经规则或已绝经,有性生活史;(2)HR-HPV连续2次检测为同一类型阳性,且间隔时间≥12个月;(3)宫颈细胞学为上皮内瘤样病变及恶性细胞(NILM)、意义不明的不典型鳞状细胞(ASC-US)、低度鳞状上皮内病变(LSIL),或阴道镜下宫颈活检病理为慢性宫颈炎。排除标准:(1)近期有生育计划或妊娠期、哺乳期;(2)近6个月内使用同类药物治疗或曾进行过宫颈手术治疗;(3)宫颈活检病理为子宫颈上皮内瘤变(CIN)及以上宫颈病变;(4)有中药成分及干扰素过敏史;(5)已参加其他临床研究。随机分为研究组(n=44)、干扰素组(n=41)、空白组(n=34),其中研究组2例因月经紊乱,用药不规范予剔除,1例失访,干扰素组急发阴道炎1例予剔除,2例失访,最终研究组41例、干扰素组38例,空白组34例完成了观察。三组年龄、绝经、孕产次数、宫颈细胞学类型比较,差异无统计学意义(P>0.05),有可比性,见表1。本研究经医院医学伦理委员同意,患者签署知情同意书。
1.2方法
研究组:给予阴道灌洗1号方(苦参20 g,土茯苓20 g,蛇床子20 g,白花蛇舌草20 g,地肤子20 g,白鲜皮20 g,半枝莲20 g)煎水200 mL(中药房统一煎制),阴道灌洗,随后给予阴道用乳杆菌活菌胶囊(内蒙古双奇药业股份有限公司,国药准字S20030005,规格:0.25 g/粒)治疗,每2天1粒,使用卫生指套将药塞入阴道深处。
干扰素组:单独使用人干扰素α2b阴道泡腾片(北京凯因科技股份有限公司,国药准字S20120019,规格:50万IU/片)治疗,1片/次,睡前使用卫生指套将药塞入阴道深处。未绝经者,月经干净第1天开始用药,每2天1次,绝经者用药每2天1次,均连续用药10次为1个疗程,共连续治疗3个疗程。
空白组:患者拒绝用药,予随访观察3个月。
所有研究对象治疗前本人及配偶或性伴侣进行相关知识宣教及用药方法培训,治疗期间同房使用避孕套隔离。
1.3观察指标
(1)治疗后宫颈HR-HPV转阴率;(2)宫颈细胞学变化:宫颈细胞学结果NILM<ASC-US<LSIL,治疗前后统计三组的升级率和降级率;(3)治疗前后阴道微生态指标变化:包括过氧化氢(H2O2)、唾液酸苷酶(SNa)、白细胞酯酶(LE);β-葡萄糖醛酸苷酶(GUS)、凝固酶(GADP)阳性率、阴性率。(4)用药期间密切观察患者有无药物不良反应。
1.4统计学处理
本研究数据采用SPSS 25.0统计学软件进行分析和处理,计量资料以(x-±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1三组宫颈HR-HPV转阴率及不良反应发生率比较
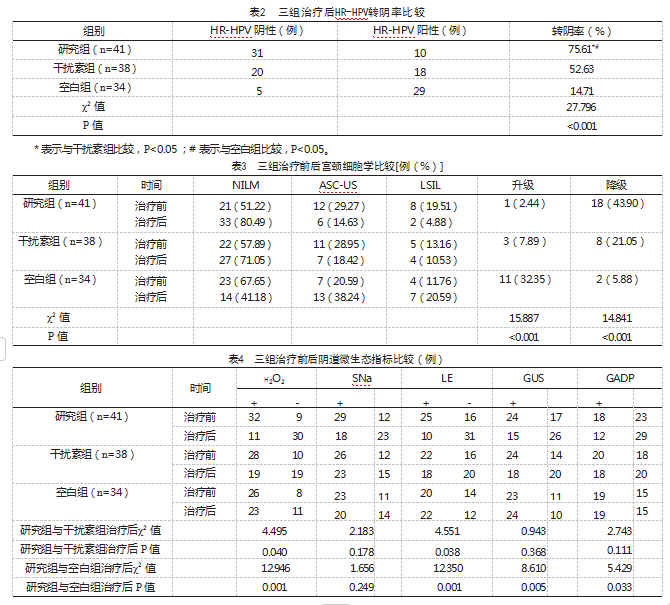
用药期间,三组均无药物不良反应发生。治疗后,研究组宫颈HR-HPV转阴率为75.61%,高于干扰素组的52.63%及空白组的14.71%,差异有统计学意义(P<0.05),见表2。
2.2三组治疗前后宫颈细胞学比较
治疗后,研究组细胞学升级率为2.44%,低于空白组的32.35%,差异有统计学意义(χ2=12.375,P<0.05),研究组细胞学降级率为43.90%,高于干扰素组、空白组的21.05%、5.88%,差异有统计学意义(χ2=4.663、13.739,P=0.035、<0.001),见表3。
2.4三组治疗前后阴道微生态指标比较
治疗后,研究组H2O2、LE阴性占比均高于干扰素组及空白组,差异有统计学意义(P<0.05);治疗后,研究组GUS和GADP阴性占比高于空白组,差异有统计学意义(P<0.05),研究组GUS和GADP阴性占比与干扰素组比较,差异无统计学意义(P>0.05),见表4。
3讨论
目前大量的研究已证实HR-HPV持续感染是导致子宫颈癌的主要原因,积极阻断HR-HPV持续感染具有重要的临床意义[5-6]。至今国内外尚无清除HPV病毒的特效药。近期研究较多的是阴道微生态对HPV感染的影响,阴道菌群可与宿主、内环境之间形成彼此制约、相互协调的动态平衡关系,有效抵御病原微生物的入侵[7]。有学者发现HPV阳性者的阴道菌群多样性显著升高,但乳酸杆菌的丰度低于HPV阴性者,且宫颈病变的严重程度与阴道优势菌乳酸杆菌的数量呈负相关[8]。研究发现乳酸杆菌能降低HPV感染率及提高HPV清除率[9-10]。
本研究发挥中西医结合优势,阴道灌洗1号方经阴道给药,属于中医外治法。参照《金匮要略·百合狐蜮阴阳毒病脉证治》:“蚀于下部则咽干,苦参汤洗之”,《金匮要略·妇人杂病脉证并治》:“蛇床子散方,温阴中坐药”。药方包括苦参、蛇床子、半枝莲等中药,诸药共用,可奏“燥湿止带、杀虫止痒、清热解毒”之功。现代药理学方面,苦参可有效杀菌抗毒,降低HPV病毒载量[11-12];白鲜皮有较强的抗炎杀虫、抗肿瘤等药理活性[13-14];地肤子、蛇床子、土茯苓均具有抗病毒、抗炎、抗肿瘤等作用,促进相应细胞的凋亡达到治疗效果[15];白花蛇舌草、半枝莲抑制肿瘤细胞增长,同时促进细胞免疫功能、抗病毒、抗癌等药理作用[16-17]。同时联合使用阴道用乳杆菌活菌胶囊,每粒胶囊中活菌不低于0.25×106 CFU,以阴道微生态为切入点,发挥乳酸杆菌优势菌作用,重建阴道微生态稳态,增加局部免疫力。
本研究选择HR-HPV感染时间12个月以上患者作为研究对象,最大程度地排除了HPV感染自然转阴的影响因素。治疗和观察3个月后研究结果显示:研究组HR-HPV转阴率为75.61%,高于干扰素组的52.63%及空白组的14.71%,提示研究组可以高效清除HR-HPV;在细胞学方面,治疗后研究组细胞学改善情况优于干扰素组,推测中药通过清除HPV病毒,抗肿瘤作用,同时乳酸杆菌发挥优势菌作用,增加阴道局部免疫力,可以稳定或改善宫颈细胞学、病理学结局。在阴道微生态方面,研究组H2O2、LE阴性占比均高于干扰素组及空白组,GUS和GADP阴性占比高于空白组,可见研究组能改善阴道微生态环境,效果优于干扰素组。
综上所述,阴道灌洗1号方联合乳酸杆菌清除宫颈HR-HPV感染疗效确切,并能改善阴道微生态环境,抑制宫颈组织学升级,而其作用机制需后期进一步的基础研究进行探索。
参考文献
[1]ESTÊVÃO D,COSTA N R,GIL DA COSTA R M,et al.Hallmarks of HPV carcinogenesis:the role of E6,E7 and E5 oncoproteins in cellular malignancy[J].Biochimica et Biophysica Acta-Gene Regulatory Mechanisms,2019,1862(2):153-162.
[2]阎冰冰,金芬,王青,等.乳酸杆菌对阻断高危型HPV持续性感染作用的前瞻性研究[J].中国医药指南,2018,16(19):161-162.
[3]刘佳敏,周明,温丹婷,等.清毒洗液治疗宫颈HR-HPV持续感染的临床疗效研究[J].广州中医药大学,2023,40(1):89-94.
[4]谢丽芬,黄健妹.止痒灵坐浴对湿热下注型LSIL伴HR-HPV感染患者阴道微生态及HR-HPV转归的影响[J].中国医药指南,2021,19(33):4-6.
[5]SPRIGGS C C,LAIMINS L A.Human papillomavirus and the DNA damage response:exploiting host repair pathways for viral replication[J].Viruses,2017,9(8):232.
[6]HU H,ZHAO J,YU W,et al.Human papillomavirus DNA,HPV L1 capsid protein and p16 INK4a protein as markers to predict cervical lesion progression[J].Archives of Gynecology and Obstetrics,2019,299(1):141-149.
[7]王雪琪,郑文瑾,叶艳箐,等.阴道微生态失衡与HPV感染以及宫颈病变研究进展[J].中国计划生育和妇产科,2023,15(7):29-32,36.
[8]SANTELLA B,SCHETTINO M T,FRANCI G,et al.Microbiota and HPV:the role of viral infection on vaginal microbiota[J].J Med Virol,2022,94(9):4478-4484.
[9]欧杨,田莉,罗勇,等.乳杆菌对HSIL全子宫切除术后HR-HPV清除率及阴道微生态的影响[J].中国微生态学杂志,2023,35(9):1079-1083.
[10]PALMA E,RECINE N,DOMENICI L,et al.Long-term Lactobacillus rhamnosus BMX 54 application to restore a balanced vaginal ecosystem:a promising solution against HPV-infection[J].BMC Infect Dis,2018,18(1):13.
[11]张明发,沈雅琴.苦参碱抗宫颈癌和子宫内膜癌的药理作用研究进展[J].抗感染药学,2019,16(6):925-930.
[12]侯立强,李伟男,冯宇飞,等.苦参中黄酮类化合物的化学成分分析及药理研究进展[J].现代中西医结合杂志,2020,29(18):2050-2052.
[13]周晓鹰,陈洁,金柳,等.白鲜皮的药理作用及抗炎活性成分研究进展[J].常州大学学报(自然科学版),2018,30(1):82-86.
[14]陈佳骏,杨妞妞.白鲜皮及其活性成分抗炎止痒机制研究进展[J].江西中医药,2020,51(5):77-80.
[15]王艳华,王谨言,关晓梅.苦参、蛇床子、苍术等中药制剂治疗宫颈HPV感染临床研究[J].陕西中医,2017,38(10):1337-1338.
[16]刘莹,张世超.基于网络药理学的白花蛇舌草—半枝莲抗肿瘤作用机制研究[J].辽宁中医药大学学报,2020,22(8):27-31.
[17]陈丽娜,王海丹,许可娟,等.干扰素联合阴道用乳酸菌对宫颈HR-HPV感染的疗效观察及病毒载量的影响[J].黑龙江医学,2020,44(1):85-88.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/79693.html