[摘要]目的探讨七氟烷对U87细胞侵袭能力的影响及机制。方法于2022年9月—2023年6月,采用徐州医科大学麻醉学实验室提供的U87细胞培养至对数生长期。Transwell实验取对数生长期细胞分成8份,然后随机分为对照(Con)组和七氟烷(Sev)组,每组4份进行平行实验。培养的细胞置于麻醉箱内,七氟烷组通载体气体和1.4%七氟烷4 h,对照组只通载体气体,观察七氟烷对U87细胞侵袭能力的影响;免疫印迹实验取对数生长期细胞分成12份,然后随机分为对照组,七氟烷2 h组和七氟烷4 h组,每组4份进行平行实验,观察七氟烷对pERK1/2、ERK1/2表达水平的影响;细胞免疫荧光化学实验取对数生长期细胞分成8份,然后随机分为对照组和七氟烷组(4 h),每组4份进行平行实验,检测七氟烷对pERK1/2、Nrf2在细胞分布的影响。结果与对照组相比,七氟烷组U87细胞穿过微孔膜的数目减少[Con组(100.000±0.000)%,Sev组(34.180±3.342)%],差异有统计学意义(t=16.697,P<0.05)。与对照组相比,七氟烷组pERK1/2的灰度值下降[Con组(100.000±0.000)%,Sev2 h组(0.196±0.028)%,Sev4 h组(0.073±0.025)%],差异有统计学意义(F=546.886,P<0.05),且核内pERK1/2[Con组(21.903±1.776)%,Sev组(8.412±0.367)%]及核内Nrf2表达水平均显著下降[Con组(18.083±0.788)%,Sev组(12.315±1.604)%],差异有统计学意义(t=7.438、3.228,P均<0.05)。结论七氟烷通过抑制ERK1/2-Nrf2信号通路抑制人胶质细胞瘤U87侵袭能力。
[关键词]七氟烷,细胞外信号调节激酶,转录因子NF-E2相关因子2,人胶质细胞瘤
胶质细胞瘤是人中枢神经系统最常见的恶性脑瘤,有病死率高和复发率高的特点[1]。由于胶质细胞瘤侵袭能力强,并且在肿瘤形成的早期就具有很强的弥散能力,导致临床治疗效果差,患者生存期较短[1-2]。手术摘除联合后续的放疗或化疗是当前治疗胶质细胞瘤的主要方案[3-4]。近年的研究表明,围术期的多种因素,如手术的创伤、手术过程的体温下降以及麻醉等,均可直接或间接影响患者预后,使得围术期管理对肿瘤进展的影响日渐被重视[5-6]。麻醉药的选择在围术期管理中占重要位置,麻醉方法和麻醉药物均可干扰患者的自身免疫系统和(或)肿瘤组织,进而影响患者的康复[7]。开创性的研究显示局部麻醉药可逆转肿瘤耐药性[8],这也让麻醉药作为化疗联合用药成为可能。但目前尚不清楚麻醉药对肿瘤细胞本身的具体影响。本研究选用2022年9月—2023年6月徐州医科大学麻醉学实验室提供的U87(Uppsala 87 Malignant Glioma,U87)细胞,采用吸入性麻醉药七氟烷直接作用于人胶质瘤U87细胞,观察七氟烷对U87细胞迁移侵袭的影响,并探讨其可能的机制。现报道如下。
1材料与方法
1.1细胞培养及处理
复苏的人脑胶质瘤细胞(U87细胞,由徐州医科大学麻醉学重点实验室提供)利用含10%FBS的高糖DMEM(Sigma公司)在37℃、5%CO2培养箱中培养。用含EDTA的0.25%胰酶(Sigma公司)消化后传2~3代,取对数生长期细胞用于实验。Transwell实验取对数生长期细胞分成8份,然后随机分为对照组和七氟烷组,每组4份进行平行实验。免疫印迹实验取对数生长期细胞分成12份,然后随机分为对照组,七氟烷2 h组和七氟烷4 h组,每组4份进行平行实验。细胞免疫荧光化学实验取对数生长期细胞分成8份,然后随机分为对照组和七氟烷组(4 h),每组4份进行平行实验。七氟烷(Sev)组孵育细胞操作为:恒温培养箱内,将同一批培养的细胞置于25 cm×25 cm×15 cm的麻醉箱,麻醉箱的两侧各设有一个孔,分别连接麻醉机(瑞沃德)和气体检测器(Datex)。通过挥发罐调节七氟烷浓度至2%,维持2 h或4 h,应用气体检测器持续监测箱内七氟烷、O2、CO2浓度。用21%O2、5%CO2、平衡N2作为载体气体。对照(Con)组只通载体气体。
1.2 Transwell体外迁移实验
胰酶消化细胞后,用无血清DMEM调整密度为2×105/mL。在Transwell(孔径为8µm)的上室内加入100µL细胞悬液,下室加入500µL含10%FBS(爱必信公司)的DMEM培养基。培养箱内培养24 h(37℃,5%CO2)后去除上室内的多余细胞,然后用固定液(4%多聚甲醛+4%蔗糖)静置固定10 min(RT)。PBS漂洗后用0.1%结晶紫染液孵育20 min(RT),PBS漂洗3次。上室底面向上拍照计数统计结果。
1.3蛋白制备和免疫印迹
处理后的U87细胞经预冷的PBS漂洗,裂解液(含蛋白酶抑制剂)刮取细胞并超声破碎得蛋白样品。样品蛋白浓度用BCA蛋白浓度测定试剂盒(碧云天公司)测定。经SDS-PAGE电泳分离等量蛋白样品,电转至PVDF膜(Cytiva公司)。膜经3%~5%BSA封闭6 h后加入pERK1/2抗体(Sigma公司)、ERK1/2(Santa Cruz Biotechnology)和β-Actin抗体(Santa Cruz Biotechnology)孵育过夜(4℃)。洗涤液洗膜,HRP标记二抗(碧云天公司)孵育1 h(RT)。用化学发光成像仪显示ECL曝光条带。用Image J软件计算灰度比值。
1.4细胞免疫荧光化学方法
预热的PBS漂洗爬片U87细胞,用固定液室温固定10 min,0.3%TritonX-100(溶于PBS)破坏细胞膜,封闭液(10%马血清)封闭1 h(RT),加入一抗[pERK1/2抗体、转录因子NF-E2相关因子2(Nrf2)克隆抗体、抗β-Actin抗体]过夜(4ºC),二抗(标记FITC或Cy3,thermo公司)室温1 h。使用封片剂(含有DAPI)封片。Olympus(IX 81)荧光显微镜拍照,Image J软件处理分析平均荧光强度。
1.5统计方法
应用SPSS 16.0统计学软件分析数据。计量资料采用(±s)表示,符合正态分布,两组比较采用独立样本t检验;多组之间的比较采用单因素方差分析,并用Bonferroni(方差齐)或者Dunnett T3(方差不齐)做多组间的两两比较,P<0.05为差异有统计学意义。
2结果
2.1七氟烷对U87细胞迁移能力的影响
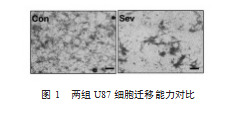
体外Transwell实验结果显示(4孔/组),与对照组(100.000±0.000)%相比,七氟烷组U87细胞穿过微孔膜的数目较少(34.180±3.342)%,差异有统计学意义(t=16.697,P<0.05)。见图1。
2.2七氟烷对U87细胞ERK1/2活化的影响
免疫印迹结果显示(每组实验取4批培养细胞做平行实验),与对照组(100.00±0.000)%相比,七氟烷组ERK1/2的蛋白灰度值没有明显变化,但pERK1/2的灰度值下降[Sev2 h组(0.196±0.028)%,Sev4 h组(0.073±0.025)%],差异有统计学意义[F=546.886,P<0.001]。见图2。
2.3七氟烷对U87细胞ERK1/2、Nrf2蛋白亚细胞分布的影响
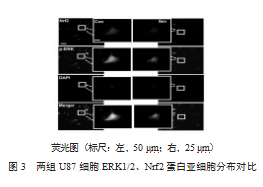
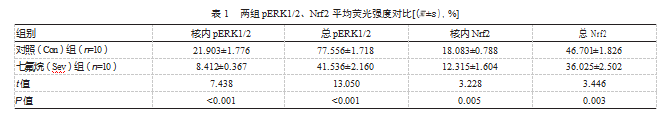
细胞免疫荧光化学结果显示,与对照组相比,七氟烷组U87细胞pERK1/2水平以及Nrf2蛋白表达水平显著降低(每组4个平行实验中选取10个细胞做分析)。更重要的是核内的pERK1/2与Nrf2蛋白表达水平均显著下降,差异有统计学意义(P均<0.05)。见图3、表1。
3讨论
麻醉对肿瘤手术患者预后的影响是临床研究的热点问题之一[5-8],但麻醉药对肿瘤细胞的直接影响目前知之尚少。本研究的目的是观察七氟烷对肿瘤细胞侵袭能力的影响,并探讨其可能机制。侵袭性强是胶质细胞瘤的特征之一,与正常脑组织无明确分界线,以致预后差[1-2]。本研究中,持续暴露于2%七氟烷后U87细胞透过微孔膜的数目为(34.180±3.342)%,较对照组减少了约69%,说明七氟烷作为麻醉剂,并不增强U87细胞的侵袭能力。另外,Hurmath FK等[9]研究也表明2.5%七氟烷在90 min时即可减弱U87细胞的迁移能力,此项研究结果与本文相互补充。这提示七氟烷在肿瘤扩散方面没有不良反应。
研究表明,ERK1/2信号通路在胶质细胞瘤中异常激活,促使细胞恶性转化、异常增殖[10]。本研究免疫印迹结果表明暴露于七氟烷的U87细胞pERK1/2的灰度值减至Sev2 h组的(0.196±0.028)%和Sev4 h组的(0.073±0.025)%,说明七氟烷抑制ERK1/2的活性,而抑制MAPK/ERK1/2信号通路可以抑制肿瘤侵袭的作用[11-12],提示七氟烷作为脑胶质瘤患者手术麻醉剂在减少肿瘤转移方面或有较好的作用。另外,ERK1/2信号通路被认为是细胞外刺激向细胞内传递的交汇点,在连接细胞膜表面受体与对应基因表达方面发挥重要作用。那么,七氟烷对ERK1/2的抑制作用是否具有时间依赖性?为此,本研究检测了七氟烷孵育2 h和4 h时,ERK1/2磷酸化的变化。结果显示七氟烷呈时间依赖的方式降低ERK1/2的活化。众所周知,当外界刺激激活ERK1/2后,活化的ERK1/2(pERK1/2)核转位,激活相应的转录因子,调控基因表达,调控细胞的生长、分化、迁移、侵袭等活动[13]。本研究免疫荧光结果显示,七氟烷处理后的U87细胞核内的ERK1/2磷酸化水平显著降低,提示七氟烷可调控ERK1/2的核转位。
Nrf2在调节细胞防御反应中发挥重要作用。最近的研究证明,Nrf2的异常激活与核转位可促进肿瘤细胞生存,与肿瘤细胞的恶化并抵抗放化疗息息相关[14-15]。抑制Nrf2的激活和核转位或许会成为治疗胶质细胞瘤的有效靶点[16]。本研究另一项结果显示,七氟烷抑制Nrf2蛋白的表达(36.025±2.502)%及核转位(12.315±1.604)%。Nrf2在较低的水平时可通过清除ROS等调控氧化应激状态来抑制肿瘤的发生和转移[17]。本研究提示七氟烷作为麻醉剂对U87细胞的侵袭能力有抑制作用。此外,本结果显示七氟烷处理后的U87细胞ERK1/2和Nrf2都存在明显的核转位的抑制现象,而Nrf2被认为是ERK1/2的下游分子[18],提示七氟烷可能通过抑制ERK1/2信号使得Nrf2的核积累减少,下调了Nrf2下游一系列的基因表达,进而影响U87细胞侵袭能力。
综上所述,本研究结果表明七氟烷可能通过抑制ERK1/2信号通路降低Nrf2核累积,从而影响人胶质细胞瘤U87细胞的侵袭能力。
[参考文献]
[1]朱正阳,韩小伟,叶梅萍,等.MRI在鉴别胶质母细胞瘤治疗相关反应与复发中的应用进展[J].磁共振成像,2023,14(4):147-153.
[2]Rong L,Li N,Zhang Z.Emerging therapies for glioblas⁃toma:current state and future directions[J].J Exp Clin Cancer Res,2022,41(1):142.
[3]Huang B,Li X,Li Y,et al.Current immunothera⁃pies for glioblastoma multiforme[J].Front Immunol,2021,11:603911.
[4]李莹莹,李晋虎,刘晓东.放疗联合免疫检查点抑制剂在胶质母细胞瘤治疗中的研究进展[J].肿瘤防治研究,2022,49(5):490-495.
[5]Sanfilippo F,Palumbo GJ,Bignami E,et al.Acute respi⁃ratory distress syndrome in the perioperative period of cardiac surgery:Predictors,diagnosis,prognosis,manage⁃ment options,and future directions[J].J Cardiothorac Vasc Anesth,2022,36(4):1169-1179.
[6]De Biase G,Garcia DP,Bohnen A,et al.Perioperative management of patients with glioblastoma[J].Neurosurg Clin N Am,2021,32(1):1-8.
[7]Krawczyk P,Lonc T,Świstek R,et al.Anesthesia for gy⁃necological cancer surgery[J].Folia Med Cracov,2022,62(3):19-42.
[8]赵文博,曾炼,胡鹏超,等.局部麻醉药逆转肿瘤耐药性作用的研究进展[J].山东医药,2023,63(19):89-93.
[9]Hurmath FK,Mittal M,Ramaswamy P,et al.Sevoflurane and thiopental preconditioning attenuates the migration and activity of MMP-2 in U87MG glioma cells[J].Neuro⁃chem Int,2016,94:32-38.
[10]Barbosa R,Acevedo LA,Marmorstein R.The MEK/ERK1/2 network as a therapeutic target in human can⁃cer[J].Mol Cancer Res,2021,19(3):361-374.
[11]李宗熹,种姝伊,古丽米然·阿里同别克,等.舒林酸衍生物K-80003与MEK抑制剂考比替尼联合用药对乳腺癌的效果研究[J].中国药理学通报,2019,35(2):251-254.
[12]Zhou L,Li M,Chai Z,et al.Anticancer effects and mechanisms of astragaloside-IV(Review)[J].Oncol Rep,2023,49(1):5.
[13]Liu XY,Yao B,Hao JR,et al.IQGAP1/ERK1/2 regu⁃lates fear memory formation via histone posttransla⁃tional modifications induced by HDAC2[J].Neurobiol Learn Mem,2020,171:107210.
[14]Zheng XJ,Chen WL,Yi J,et al.Apolipoprotein C1 pro⁃motes glioblastoma tumorigenesis by reducing KEAP1/NRF2 and CBS-regulated ferroptosis[J].Acta Pharmacol Sin,2022,43(11):2977-2992.
[15]陈亚娟,刘晓平.肿瘤细胞耐药性与Keap1/Nrf2/p62的研究进展[J].医学理论与实践,2016,29(14):1858-1860.
[16]Gao X,Guo N,Xu H,et al.Ibuprofen induces ferropto⁃sis of glioblastoma cells via downregulation of nuclear factor erythroid 2-related factor 2 signaling pathway[J].Anticancer Drugs,2020,31(1):27-34.
[17]张高山,蒋青青,陈敏,等.Nrf2与p53/p21信号通路在肿瘤中作用的研究进展[J].实用药物与临床,2023,26(6):549-555.
[18]Hsieh YH,Deng JS,Chang YS,et al.Ginsenoside Rh2 ameliorates lipopolysaccharide-induced acute lung in⁃jury by regulating the TLR4/PI3K/Akt/mTOR,Raf-1/MEK/ERK1/2,and Keap1/Nrf2/HO-1 signaling path⁃ways in mice[J].Nutrients,2018,10(9):1208.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/79546.html