[摘要]目的探究高迁移率族蛋白1(High Mobility Group Box Protein1,HMGB1)通过(Toll-like Receptor 4,TLR4)/核因子κB(Nuclear Factor Kappa-B,NF-κB)/NOD样受体热蛋白结构域相关蛋白3(NOD-like Receptor Thermal Protein Domain Associated Protein 3,NLRP3)信号通路介导内皮细胞焦亡在系统性血管炎中的作用机制。方法研究于2021年10月—2023年9月在齐齐哈尔医学院附属第三医院开展。取人脐静脉血管内皮细胞进行培养,随机分为对照组和实验组,实验组加入人重组HMGB1,对比对照组与实验组、实验组NLRP3及TLR4表达抑制前后,内皮细胞焦亡相关蛋白的表达水平。结果系统性血管炎组与健康对照组比较,人脐静脉血管内皮细胞中HMGB1、含半胱氨酸的天冬氨酸蛋白水解酶-1(caspase-1)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-18(interleukin-18,IL-18)水平升高,差异有统计学意义(P均<0.05)。细胞实验中实验组与对照组比较,caspase-1、IL-1β、IL-18水平升高,差异有统计学意义(P均<0.05)。过表达HMGB1并抑制NLRP3可使NLRP3(2.71±0.59 vs 1.24±0.58)、caspase-1(0.69±0.12 vs 0.40±0.03)、IL-1β[(1.75±0.31)pg/mL vs(1.16±0.12)pg/mL]、IL-18[(0.15±0.04)pg/mL vs(0.09±0.01)pg/mL]水平降低,差异有统计学意义(P均<0.05);过表达HMGB1并抑制TLR4可使TLR4(4.93±1.04 vs 1.96±0.84)、NF-κB(5.62±1.39 vs 2.15±1.04)、NLRP3(2.71±0.59 vs 1.24±0.58)、caspase-1(0.69±0.12 vs 0.40±0.03)、IL-1β[(1.75±0.31)pg/mL vs(1.16±0.12)pg/mL]、IL-18[(0.15±0.04)pg/mL vs(0.09±0.01)pg/mL]水平明显降低,差异有统计学意义(P均<0.05)。结论HMGB1通过调节TLR4/NF-κB/NLRP3信号通路介导内皮细胞焦亡,进而改善系统性血管炎。
[关键词]HMGB1,TLR4/NF-κB/NLRP3,内皮细胞焦亡,系统性血管炎
系统性血管炎(Systemic Vasculitis,SV)的主要病理特征为血管壁损伤和炎症,引起血流减少或血管阻塞,从而导致组织缺血、坏死[1]。高迁移率族蛋白1(High Mobility Group Box-1,HMGB1)作为一种非组蛋白核蛋白质,在转录、复制、重组、修复和其他DNA相关活动中发挥作用[2]。在炎症过程中,HMGB1从单核细胞或巨噬细胞被动递送或主动排泄到细胞外环境中,可以与受体或晚期糖基化终产物受体结合以触发内源性危险信号,如炎症、中性粒细胞募集、细胞凋亡和细胞焦亡[3-4]。本文旨在探究HMGB1通过Toll样受体4重组蛋白(Toll-Like Receptor 4,TLR4)/核因子κB(Nuclear Factor Kappa-b,NF-κB)/NOD样受体热蛋白结构域相关蛋白3(NOD-Like Receptor Thermal Protein Domain Associ⁃ated Protein 3,NLRP3)信号通路介导内皮细胞焦亡在系统性血管炎中的作用机制。本研究于2021年10月—2023年9月在齐齐哈尔医学院附属第三医院开展,现报道如下。
1材料与方法
1.1细胞培养
购买人脐静脉血管内皮细胞系,采用含10%胎牛血清(Fetal Bovine Serum,FBS)的RPM1-1640细胞培养液进行培养。将培养的细胞随机分为两组,其中实验组中细胞培养液加入重组HMGB1,对照组加入二甲基亚砜(Dimethyl Sulfoxide,DMSO),培养至细胞密度70%~90%备用。将实验组细胞随机分为5份,其中4份分别加入NLRP3抑制剂(实验组+sh-NLRP3)及抑制剂空载质粒(实验组+sh-NC)、TLR4抑制剂(实验组+sh-TLR4)及抑制剂空载质粒(实验组+sh-NC)。
1.2 Western blot实验
采用RIPA细胞裂解液和PMSF蛋白抑制剂提取细胞蛋白,蛋白定量后加入蛋白上样缓冲液,混匀煮沸10 min。蛋白样品进行SDS-PAGE凝胶电泳,转膜后孵育含半胱氨酸的天冬氨酸蛋白水解酶-1(caspase-1)、白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-18(Interleukin-18,IL-18),最终滴加显影液滴于聚偏氟乙烯(Poly Vinylidene Fluoride,PVDF)膜上,成像扫描仪扫膜,软件进行分析HMGB1刺激下HMGB1、NLRP3、TLR4、NF-κB、caspase-1,IL-1β,IL-18表达水平。每组实验分别取3次样本进行。
1.3统计方法
采用SPSS 22.0统计学软件对数据进行分析,HMGB1、caspase-1、IL-1β、IL-18、TLR4、NF-κB表达水平为计量资料,均符合正态分布,以(±s)表示,组间比较进行t检验。P<0.05为差异有统计学意义。
2结果
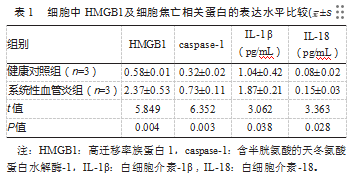
2.1细胞中HMGB1及细胞焦亡相关蛋白的表达水平比较
与健康对照组比较,系统性血管炎组caspase-1、IL-1β、IL-18水平升高,差异有统计学意义(P均<0.05),见表1。
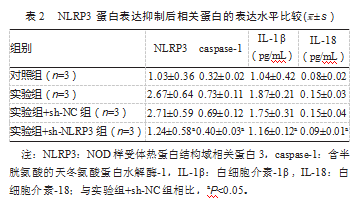
2.2 NLRP3蛋白表达抑制后相关蛋白的表达水平比较
实验组+sh-NC组与实验组细胞焦亡相关蛋白的表达水平比较,差异无统计学意义(P均>0.05);与实验组相比,实验组+sh-NLRP3组NLRP3、cas⁃pase-1、IL-1β、IL-18水平明显降低,差异有统计学意义(P均<0.05),见表2。
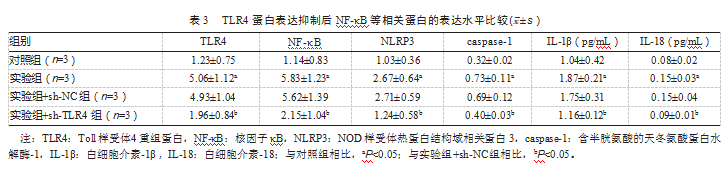
2.3 TLR4蛋白表达抑制后NF-κB等相关蛋白的表达水平比较
与对照组相比,实验组TLR4、NF-κB、NLRP3、caspase-1、IL-1β、IL-18水平明显升高,差异有统计学意义(P均<0.05)。实验组+sh-NC组与实验组TLR4、NF-κB、NLRP3、caspase-1、IL-1β、IL-18的表达水平比较,差异无统计学意义(P均>0.05);与实验组相比,实验组+sh-TLR4组TLR4、NF-κB、NLRP3、caspase-1、IL-1β、IL-18水平明显降低,差异有统计学意义(P均<0.05),见表3。
3讨论
据统计报道,每年每100万人中有40~54例发生系统性血管炎,系统性血管炎患者通常有前驱症状、体质障碍和器官特异性表现[5]。目前SV治疗方法主要为糖皮质激素、免疫抑制剂和生物制剂等,然而全身性血管炎患者由于疾病相关的终末器官损伤和免疫抑制治疗导致出现合并症的风险增加[6]。
HMGB1作为一种非组蛋白核蛋白质,在转录、复制、重组、修复和其他DNA相关活动中发挥作用[7]。HMGB1通常由免疫细胞主动分泌或由受伤或死亡细胞释放,通过各种细胞表面受体结合介导炎症反应[8]。另外研究发现HMGB1易与其他促炎分子结合,包括DNA、RNA、组蛋白、核小体、脂多糖、IL-1β和其他因子。在本研究中发现高表达的HMGB1促进了人脐静脉血管内皮细胞系中的炎症相关因子及细胞焦亡相关蛋白[caspase-1:0.73±0.11 vs 0.32±0.02、IL-1β:(1.87±0.21)pg/mL vs(1.04±0.42)pg/mL、IL-18:(0.15±0.03)pg/mL vs(0.08±0.02)pg/mL]的表达,同时也有研究显示川崎病等相关血管炎患者血清中HMGB1水平较高,尤其是肉芽肿合并多血管炎表现的患者[9-10],这项研究与本研究一致,均认为高表达的HMGB1可能与血管炎症有关,并且本研究还发现高表达的HMGB1与细胞焦亡存在关联。同时有研究证实HMGB1可作为一种促炎激活因子[11],这些研究共同提示HMGB1对系统性血管炎的炎症激活作用,也提示着HMGB1可能通过激活炎症因子来协调内皮细胞焦亡。然而,其他研究显示ANCA相关血管炎、大动脉炎和巨细胞动脉炎患者与健康对照组相比,其外周血血清中HMGB1水平并无明显变化[12]。因此,HMGB1作为一种促炎介质是否与SV相关仍存在争议。另外在细胞实验中发现激活HMGB1后TLR4、NF-κB、NLRP3、caspase-1、IL-1β、IL-18水平显著升高;过表达HMGB1并抑制NLRP3后NLRP3、caspase-1、IL-1β、IL-18水平降低;过表达HMGB1并抑制TLR4后TLR4、NF-κB、NLRP3、caspase-1、IL-1β、IL-18水平明显降低(P均<0.05)。这一发现与当前的理论一致,即炎症小体激活后发生焦亡,导致caspase-1的表达及其下游效应,包括细胞因子IL-1β和IL-18的裂解。并且近年关于急性青光眼的研究也表明了HMGB1可主要通过诱导NLRP3炎症小体形成,并促进IL-1β的加工和细胞焦亡,从而参与疾病的发生发展[13]。
综上所述,HMGB1通过调节TLR4/NF-κB/NLRP3信号通路介导内皮细胞焦亡,进而改善系统性血管炎。
[参考文献]
[1]侯传云,李*军.系统性血管炎的诊断与治疗[J].中华全科医学,2022,28(5):710-711.
[2]黄绚丽,秘乐,徐宇,王红嫚.HMGB1和RAGE在呼吸机相关性肺炎中作用的研究进展[J].天津医药,2023,51(10):1428-1432.
[3]孙雪东,严一核,褚韦韦,等.高迁移率族蛋白B1和肺泡巨噬细胞活性对呼吸机相关性肺炎患者短期内撤机拔管的影响[J].中华急诊医学杂志,2020,29(11):1466-1470.
[4]高秀莲,贾克鹏,张玉清.呼吸机相关性肺炎患者病原菌分布及血清HMGB1、PCT、CGRP水平变化的临床评价[J].中国微生态学杂志,2022,34(8):939-943.
[5]Moiseev S,Cohen Tervaert JW,Arimura Y,et al.2020 international consensus on ANCA testing beyond sys⁃temic vasculitis[J].Autoimmun Rev,2020,19(9):102618.
[6]Ferro F,Quartuccio L,Monti S,et al.One year in review 2021:Systemic vasculitis[J].Clin Exp Rheumatol,2021,39(2):3-12.
[7]王志浩,郭龙,王*莉,等.HMGB1在角膜损伤和修复中的作用研究进展[J].生命科学,2023,35(6):799-806.
[8]Wang Y,Shi J,Tan C,et al.The role of anti-HMGB1 an⁃tibody and anti-moesin antibody in ANCA-associated vasculitis[J].Med Clin(Barc),2023,161(3):101-106.
[9]Qian B,Huang H,Cheng M,et al.Mechanism of HMGB1-RAGE in Kawasaki disease with coronary ar⁃tery injury[J].Eur J Med Res,2020,25(1):8.
[10]朱晴,朱彬,吴婷,等.高迁移率族蛋白B1水平与系统性血管炎相关性的Meta分析[J].中华全科医学,2021,19(1):131-136.
[11]曾真,李建华,谢新平.晚期糖基化终末产物诱导人卵巢颗粒细胞株COV434凋亡并上调促炎因子HMGB1自分泌[J].中国病理生理杂志,2018,34(9):1711-1714.
[12]Zhu B,Li N,Zhu Q,et al.Association of serum high mobility group box 1 levels with disease activity and re⁃nal involvement in patients with systemic vasculitis[J].Medicine(Baltimore),2019,98(6):e14493.
[13]阙鹏程.HMGB1琥珀酰化修饰在NLRP3炎性小体激活诱导的BSCB功能改变中的作用研究[D].锦州:医科大学,2023.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/79300.html