SCI论文(www.lunwensci.com):
【摘要】核苷酸结合寡聚化结构域样受体热蛋白结构域相关蛋白 3(NLRP3 )是一种重要的炎症小体,广泛存在于人体各种组织和 细胞中。牙髓炎是一种发生在牙体髓腔内的炎症性疾病,主要由感染、化学刺激、物理损伤等因素引起。NLRP3 在牙髓炎的发生和发展 中发挥重要作用。然而,牙髓炎的病理生理机制尚未完全阐明,特别是 NLRP3 在牙髓炎中的作用机制尚未得到充分研究。现就牙髓炎 的病理生理机制、NLRP3 的生物学功能、NLRP3 与牙髓炎的关系及其作用机制进行综述,对于理解牙髓炎的发生和发展机制,以及探 索牙髓炎的治疗新靶点提供重要的理论和实践依据。
【关键词】牙髓炎; 核苷酸结合寡聚化结构域样受体热蛋白结构域相关蛋白 3 ; 作用机制
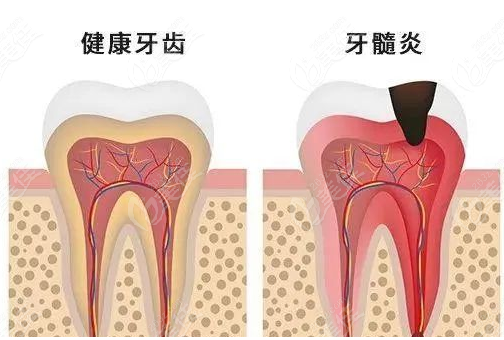
牙髓炎是一种发生在牙体髓腔内的炎症性疾病,主要 由感染、化学刺激、物理损伤等因素引起,常表现为一种 剧烈的、难以忍受的疼痛,夜间加重,受到温度刺激时疼 痛也会加剧。由于髓腔具有特殊的生理结构特点,其处于 四壁坚硬的牙髓腔中,只能通过细小的根尖孔进行血液循 环,因此牙髓自愈能力较差, 一旦发生感染,渗出物不易 引流,常常以慢性炎症状态持续存在,炎症不易治愈,进 而导致牙髓组织发生坏死或退行性变,甚至引发根尖周炎 继发病变、牙齿缺失或牙槽骨缺损等,因此有效控制髓腔 内的感染和炎症反应至关重要。牙髓炎的发病机制非常复 杂,在其发病过程中,多种细胞因子、细胞黏附分子均参 与其中 [1] 。核苷酸结合寡聚化结构域样受体热蛋白结构域 相关蛋白 3(NLRP3)是一种多聚体蛋白,位于细胞质内, 是炎症小体的组成成分之一 [2]。NLRP3 炎症小体是一种能 够诱导细胞凋亡和促炎症反应的分子复合体,它的激活 会引起促炎因子的产生,如白细胞介素 -1β(IL-1β)、白 细胞介素 -18(IL-18)等 [3]。NLRP3 炎症小体与风湿性疾 病、肠道性疾病等多种炎性疾病有关,但对牙髓组织中的 NLRP3 的研究则相对较少。有研究表明,在牙髓炎组织 中,NLRP3 炎症小体被激活,其表达水平明显增加,与牙 髓炎的发病和炎症反应密切相关 [4] 。因此,研究 NLRP3 炎症小体在牙髓炎中的作用及其调节机制,对于揭示牙髓 炎的发病机制和寻找治疗牙髓炎的新靶点具有重要意义。现就牙髓炎的病理生理机制、NLRP3 的基本概念和生物学 功能、NLRP3 与牙髓炎的炎症反应关系、NLRP3 在牙髓炎 中的细胞信号传递机制、NLRP3 在牙髓炎治疗中的应用作 如下综述。
1 牙髓炎的病理生理机制
牙齿具有独特的结构特征,牙釉质、牙本质及牙骨质 等 3 种钙化的硬组织构成牙齿坚硬的外壳,牙齿内部的牙 髓腔内则容纳牙髓组织,牙髓组织是疏松的结缔组织,由 神经、细胞、血管以及丰富的胶原纤维组成。口腔为多种 微生物提供栖息地,形成口腔微生态系统,生理状态下口 腔常驻微生物保持动态平衡。而内环境稳态失衡则可导致 牙髓炎的发生、发展,细菌及其代谢产物渗透至牙髓,则 引起炎症反应, 其发病机制和病理生理学特性较为复杂 [5]。 牙髓炎的发生多由细菌感染牙髓引起,牙髓感染通常继发 于龋病、牙体手术操作或创伤等,当牙釉质遭到破坏,牙 本质暴露于口腔内的多种细菌中,一旦细菌侵入至牙髓, 将激活牙髓的免疫并诱导牙髓和根尖周炎症反应 [6] 。在细 菌感染过程中,宿主细胞释放细胞因子和趋化因子,这些 因子会吸引单核细胞、中性粒细胞、淋巴细胞等免疫细胞 进入感染部位,并启动炎症反应 [7] 。此外,牙髓细胞在感 染或刺激后也会释放炎症介质, 如白细胞介素 -6(IL-6 )、 IL-1β、肿瘤坏死因子 -α(TNF-α ) 等, 这些介质会促进炎症反应的发生,并参与调节细胞凋亡、增殖和分化等生理 过程 [8]。同时, 炎症反应会引起细胞和分子的损伤和改变, 从而导致牙髓细胞凋亡和功能障碍。随着炎症的发展,牙 髓组织的细胞凋亡和坏死会加剧, 导致组织坏死和分解 [9]。 在坏死组织周围,常常会有成纤维细胞增生和骨质破坏的 表现。在近年来的研究中, 人们发现NLRP3 炎症小体在牙 髓炎中也起着重要作用 [10] 。因此探究 NLRP3 炎症小体在 牙髓炎发生发展过程的作用及其机制,有利于为拓展牙髓 炎的干预提供新的思路。
2 NLRP3 的基本概念和生物学功能
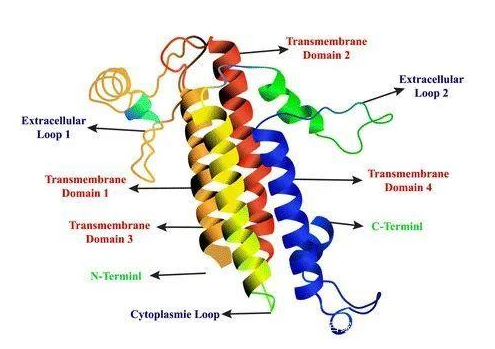
2.1 NLRP3 的结构和功能特点 模式识别受体是启动 固有免疫应答的关键,其可识别病原微生物表面的病原 相关分子模式,传递感染信号,从而激活机体的免疫反 应,进而对机体内病原微生物进行清除,并诱导程序性 细胞死亡,是天然免疫系统的重要组成部分 [11]。NLRP3 炎症小体是一种模式识别受体,与多种炎性疾病以及自 身免疫性疾病相关。NLRP3 是目前研究最广泛的核苷酸 结合寡聚化结构域(NOD)样受体(NLR)家族成员之 一,由核苷酸结合寡聚化结构域(NACHT)、羧基端的 富含亮氨酸的重复序列(LRR )和氨基端的热蛋白结构 域(PYD )3 个结构域组成,其中 NACHT 负责介导信 号转导和炎症体形成;LRR 主要负责识别配体;PYD 通过 与程序性细胞死亡相关斑点样蛋白(ASC)中的 PYD 相 关作用,参与炎症小体的装配形成 [12]。NLRP3 的功能是 调控炎症和免疫反应,其主要作用是在细胞内感知外界 的病原体、细胞损伤、代谢产物等多种刺激因子,进而 引发炎症反应 [13]。当 NLRP3 感知到刺激因子时,其结 构域会发生构象变化, NLRP3 依次经历 LRR 结构域识别 配体和 NACHT 结构域依赖腺苷三磷酸(ATP)寡聚化, 然后通过 PYD 与 ASC 的 PYD 的相互作用而结合,之 后 ASC 通过其羧基端的半胱氨酸蛋白酶 (caspase) 活化 募集结构域(CARD)募集半胱氨酸蛋白酶 -1 前体蛋白 (pro-caspase-1)进而聚集成 NLRP3 炎症小体 [14]。
2.2 NLRP3 与炎症反应的关系 炎症反应是人体一种重 要的免疫防御机制,当组织受到毒素或细菌的破坏或感 染,或其他原因的伤害时,就会进入正常的自我保护和损 伤修复状态,机体会释放出一系列的细胞因子,将免疫细 胞吸引到感染位点并引起炎症,但当炎症反应过度或长期 持续时,会引发多种炎症性疾病 [15]。NLRP3 炎症小体是 识别危险信号的多蛋白复合物,其能被各种类型的分子、 细菌或病毒所激活,激活的 NLRP3 炎症小体将激活半胱 氨酸蛋白酶 -1(caspase-1),继而促使 IL-1β、IL-18 等炎症 因子分泌,以及介导特殊的程序性细胞死亡 [16] 。这些炎症因子将引发炎症反应,包括血管扩张、渗透性增加、白 细胞浸润等一系列生理反应,以清除病原体,避免组织 的结构和功能受到损伤 [17]。其中 IL-1β 在炎症发生、发展 中起着重要作用,其产生于损伤或免疫应激部位,刺激 炎症和引起自身免疫性疾病相关基因的表达,诱导干扰 素 γ、环氧化酶 2 及黏附分子等效应蛋白的表达,促进炎 症进程 [18]。
3 NLRP3 与牙髓炎的关系及其作用机制
3.1 NLRP3 在牙髓炎中的分布和表达 牙髓腔是一种相 对封闭的解剖结构,仅通过根尖孔与外界相通。牙髓组织 中的成牙本质细胞及成纤维细胞参与牙髓组织的免疫防御 反应,前者位于牙髓组织最外层,最早接触侵入牙本质小 管中的细菌、细菌分解产物,而成纤维细胞是牙髓中的主 要细胞, 表面有多种 Toll 样受体(TLRs)表达,可对病原 体进行识别,同时分泌促炎因子 [19]。NLRP3 表达于牙龈 成纤维细胞、成骨细胞、淋巴细胞、单核- 巨噬细胞、粒 细胞等,在先天免疫和炎症相关的疾病发生过程中具有重 要作用。NLRP3 在牙髓炎中的表达方式有两种, 一种是在 发生炎症的牙髓细胞内部表达,损害牙髓内部组织,加剧 炎症反应;另一种是游离至细胞外表达后,侵袭损害牙髓 周围组织 [20]。SONG 等 [21] 的免疫组织化学染色结果证明, NLRP3 在正常人牙髓组织中有所表达,正常牙髓组织中 NLRP3 在成牙本质细胞中强阳性,牙髓血管内皮细胞中 可见 NLRP3 染色,牙髓成纤维细胞中未见明显染色;而 发生牙髓炎时,NLRP3 强表达,且牙髓成纤维细胞中可见 NLRP3 染色,提示 NLRP3 可能参与了牙髓炎的炎症反应。
3.2 NLRP3 与牙髓炎的炎症反应关系 当机体受到外来 微生物感染或来自本身的损伤信号刺激时,便会启动先天 性免疫系统,借助种系编码的模式识别受体能够有效识别 内源性和外源性危险信号。NLRP3 炎症小体活化可介导 促炎因子产生与细胞凋亡,从而抵御病原微生物感染、维 持自身稳态,这是机体的一种自我保护性措施,而炎症细 胞因子过度分泌会致使细胞凋亡,使组织损伤加重,使 得炎症相关性疾病发生、发展 [22] 。病原微生物感染、牙 本质缺损、蛋白质酶水解产物及氧化应激等刺激能够激活 NLRP3 炎症小体,NLRP3 炎症小体的激活能够引发细胞 内的炎症反应,促进炎性细胞因子释放,从而促进炎症反 应的发生和发展,导致细胞凋亡和坏死,加剧牙髓组织的 损伤 [23]。ZHANG 等 [24] 的研究表明,发生牙髓炎时,牙 髓成纤维细胞和成牙本质细胞中 NLRP3 的表达量明显升 高,表明 NLRP3 介导的信号通路在牙髓成牙本质复合体 免疫防御中起重要作用。胡乐等 [25] 的研究也表明,牙髓 炎组 NLRP3 表达明显强于正常组,且牙髓炎组 IL-1β 信使核糖核酸(mRNA)和蛋白相对表达量均明显高于正常 组,表明 NLRP3 在牙髓炎组织中高表达,参与了牙髓的 炎症反应。此外,NLRP3 的激活还可影响一系列与炎症反 应相关的信号通路,包括核因子 -κB(NF-κB)通路和线粒 体通路等。NLRP3 通路的激活可以引起 NF-κB 的激活和 线粒体功能的紊乱,进而导致炎症反应的进一步加剧 [26]。
3.3 NLRP3 在牙髓炎中的细胞信号传递机制 NLRP3 在 牙髓炎中的作用是通过多种信号通路参与炎症反应的调 控,影响炎症介质的释放、细胞凋亡、神经元的活动等多 个方面,进一步促进炎症反应的发生和发展,NLRP3 在牙 髓炎中的细胞信号传递机制主要包括以下几个方面。
3.3.1 激活 NLRP3 炎症小体的信号通路 在牙髓炎的炎 症反应过程中, 一些刺激物质可以激活细胞内的 NLRP3 炎症小体,从而引发炎症反应。这一过程主要包括两个 步骤:第一步是 NLRP3 激活,需要与刺激物结合;第 二步是 ASC 和前炎症因子,如白细胞介素 -1β 前体 (pro-IL-1β)和白细胞介素 -18 前体(pro-IL-18)聚合成炎 症小体。在这一过程中,NLRP3 的激活与多种细胞信号通 路密切相关,第一种激活途径为钾离子外流,当细胞内 的钾离子外流至细胞外时,细胞膜上会形成孔隙,NLRP3 炎症小体的活化物质可通过这些孔隙进入细胞内,从而 使 NLRP3炎症小体被激活;第二种为线粒体来源的活性 氧(ROS),细胞内 ROS 可随着病原体相关的分子模式 (PAMPs)或损伤相关的分子模式(DAMPs)的侵入而被 刺激生成,产生的 ROS 和硫氧还蛋白互作蛋白(TXNIP) 发生反应,然后从硫氧还蛋白(TRX)释放,进而激活 NLRP3 炎症小体;第三种为溶酶体损伤,当一些源于细 胞外的大颗粒物质被细胞吞噬掉后,会损伤细胞内的溶酶 体,致使大量溶酶体内容物被释放出来,导致 NLRP3 炎 症小体以直接或间接的方式被激活 [27] 。此外,细胞内钙 离子增加可诱导线粒体损伤,引起线粒体功能紊乱,从而 激活 NLRP3 炎症小体 [28]。
3.3.2 促炎症因子的表达和分泌 被激活的 NLRP3 炎 症小体可促使 ASC 将 pro-caspase-1 切割成具有活性的 caspase-1,caspase-1 被激活后,会将无活性的促炎细胞 因子 pro-IL-1β 和 pro-IL-18 切割成成熟的 IL-1β 和 IL-18, 从而诱导炎症,进一步加剧了牙髓炎的炎症反应导致疾病 严重程度加重 [29]。
3.3.3 诱导细胞凋亡 NLRP3 炎症小体的激活还能够诱 导细胞凋亡,这可能是牙髓炎病变组织中细胞死亡的重要 机制之一。研究发现,NLRP3 炎症小体激活后会导致细胞 内 ROS 的产生, ROS 进一步激活 caspase-1 家族酶的级联 反应,引发牙髓细胞凋亡,导致牙髓组织坏死,进一步促 使疾病进展 [30]。
4 NLRP3 在牙髓炎治疗中的应用
根管治疗是牙髓炎的首选治疗方法,分成清除牙髓、 根管塑形预备、根管充填 3 个步骤, 其通过机械清创和化学 消毒制备根管, 彻底清除髓腔中的感染性物质, 并将其紧密 填充以防止再感染。此外,小范围、可逆的根尖周病可考 虑药物治疗,主要针对是感染、疼痛症状的治疗。深入理 解炎症反应的生理、病理过程,并根据其激活途径探寻新 靶点、高选择性的抑制剂可为治疗牙髓炎提供全新的干预 思路。近年来, 随着对 NLRP3 的深入研究, 人们发现针对 NLRP3 的治疗策略可能成为牙髓炎的一种新的治疗手段。
4.1 抗炎药物 非甾体类抗炎药、激素、解热镇痛剂等 药物可以通过抑制炎症反应和抑制细胞凋亡等方式来减轻 牙髓炎的症状。同时,这些药物也可以通过抑制 NLRP3 炎症小体的形成和功能,减少炎症反应和细胞损伤。有研 究表明,非甾体类抗炎药物,如阿司匹林,可以通过抑制 NLRP3 炎症小体的形成和促炎因子 IL-1β 的分泌,减轻 炎症反应和疼痛程度 [31]。
4.2 NLRP3 炎症小体抑制剂 NLRP3 的激活因子多种 多样,该通路与众多疑难疾病发生、发展密切相关,探 索新型的 NLRP3 抑制剂已成为前沿热点,也具有广泛 的应用前景,可为治疗重大炎症相关疾病提供全新的思 路,如抑制 NLRP3 炎症小体活性可显著减轻急性肺损 伤 [32] 。小分子抑制剂 MCC950 证实可直接抑制 NLRP3 炎 症小体的信号通路,受到重点关注 [33] 。有研究表明,针 对 NLRP3 信号通路的干扰剂可能具有治疗牙髓炎的潜力, 微小 RNA-22(miR-22)作为一种协同负调控因子,可通 过靶向 NLRP3 和低氧诱导因子 -1(HIF-1α ),参与控制 NLRP3/caspase-1 炎症小体途径介导的促炎细胞因子的分 泌 [34] 。这些结果提供了 miR-22-HIF-1α-NLRP3 信号传导 在控制促炎细胞因子分泌中的新功能和机制,从而为未来 的牙髓炎靶向治疗药物的开发提供了新的治疗策略。
5 小结与展望
NLRP3 炎症小体活化可导致 caspase-1 自身裂解和活 化, 从而促进 IL-1β 和 IL-18成熟和分泌, 介导免疫炎症反 应。但炎症因子过度分泌可导致过度的炎症反应, 对宿主组 织造成损伤。NLRP3 在牙髓炎的发病机制和炎症反应中发 挥着重要作用, 因此深入研究NLRP3 在牙髓炎中的作用机 制将有助于揭示牙髓炎的发病机制, 并且针对NLRP3 信号 通路的干扰剂可能具有治疗牙髓炎的潜力。但是,目前关 于NLRP3 在牙髓防御和炎症中的激活机制及激活后的信号 转导通路和相互作用的分子的研究尚不充分,NLRP3 炎症 小体抑制剂治疗牙髓炎的相关研究还比较少,关于 NLRP3 在牙髓炎治疗中的应用还需要进一步研究和探索。
参考文献
[1] 努尔比亚木·麦麦提依明 , 吴龙 , 赵今 . 牙髓炎的发病机制和分子 靶标研究 [J]. 中国医药导报 , 2021, 18(1): 22-26.
[2] SWANSON K V, DENG M, TING J P. The NLRP3 inflammasome: molecular activation and regulation to therapeutics[J]. Nat Rev Immunol, 2019, 19(8): 477-489.
[3] 张懿 , 刘磊 , 刘韵资 , 等 . NLRP3 炎性小体研究新进展 [J]. 现代 生物医学进展 , 2014, 14(9): 1763-1765, 1743.
[4] 王雪纯 . NOD1、NOD2 和NLRP3 炎症小体与牙髓炎 [J]. 临床与 病理杂志 , 2017, 37(4): 849-854.
[5] 李丹 , 张旗 . 牙髓成纤维细胞内质网应激在牙髓炎中的作用 [J]. 口腔医学研究 , 2022, 38(11): 1064-1070.
[6] 封黎明 , 赵西珍 . 口腔厌氧菌牙髓感染患者血清免疫球蛋白和炎 症介质检测的临床意义 [J]. 中国实验诊断学, 2020, 24(6): 978-980.
[7] 丁灿灿 , 李适廷 . 连接蛋白 43 与牙髓组织炎症和修复关系的研 究进展 [J]. 江苏医药 , 2021, 47(2): 196-199.
[8] 黄松靖 , 雷雅燕 , 佘睿 , 等 . 云南白药在 P.g-LPS 诱导的炎症环境 下对人牙髓细胞分泌 TNF-α 、IL-6、IL-1β 的影响 [J]. 昆明医科 大学学报 , 2017, 38(8): 73-78.
[9] 林珊如 , 钱虹 , 吕婧雯 , 等 . Caspase 家族参与乳牙根吸收牙髓组 织细胞凋亡的研究进展 [J]. 口腔医学 , 2022, 42(2): 180-183.
[10] 王海婧 . NLRP3/Caspase-1 在牙髓组织中的表达及其与牙髓损伤 修复的关系研究 [D].西安 : 第四军医大学 , 2013.
[11] 付思思 , 刘磊 , 吕玲 , 等 . NOD 样受体家族核苷酸结合寡聚化结 构域样受体 3 炎症小体与自身免疫病研究进展 [J]. 中华风湿病 学杂志 , 2017, 21(8): 561-565.
[12] 王位 , 马远方 , 韩根成 . NLRP3 炎性小体激活调控机制研究新进 展 [J]. 国际免疫学杂志 , 2015, 38(4): 343-347.
[13] 黄谦 , 谢青 . NLRP3 炎性小体与适应性免疫研究进展 [J]. 国际流 行病学传染病学杂志 , 2012, 39(2): 125-128.
[14] 丁杨 , 胡容 . NLRP3 炎症小体激活及调节机制的研究进展 [J].药 学进展 , 2018, 42(4): 294-302.
[15] CHEN X L, LIU G L, YUAN YY, et al. NEK7 interacts with NLRP3 to modulate the pyroptosis in inflammatory bowel disease via NF-κB signaling [J]. Cell Death Dis, 2019, 10(12): 906-918.
[16] 刘艳辉 , 范永会 , 王建文 . 重症肺炎患者外周血 NLRP3 炎性小 体表达水平的变化及临床意义 [J]. 分子诊断与治疗杂志 , 2022,14(6): 970-974.
[17] 梅群广 . 牙周炎组织中 NLRP3 炎性小体表达量与炎症反应、牙 槽骨吸收的相关性研究 [J].海南医学院学报 , 2018, 24(12): 1215-1218.
[18] 张帆 , 苏爱峰 , 李彦芳 , 等 . NLRP3 炎性小体促分泌产物 IL-1β 、 IL-18 评估 RA-IP 预后的临床价值 [J]. 实用医学杂志 , 2018,34(1): 107-110.
[19] 张安生, 张海欧, 倪龙兴 . 炎症环境下牙髓成纤维细胞中NOD 样 受体蛋白 3 炎症体相关分子表达的调节 [J]. 中国组织工程研究 ,2022, 26(26): 4107-4112.
[20] 王培娜, 王海婧, 蒋文凯, 等. NLRP3 炎症体在小鼠实验性急性牙 髓炎中的表达 [J]. 牙体牙髓牙周病学杂志 , 2015, 25(5): 259-262.
[21] SONGZ, LIN Z M, HE F, et al. NLRP3 is expressed in human dental pulp cells and tissues[J]. J Endod, 2012, 38(12): 1592-1597.
[22] 李翔 , 刘红梅 . NLRP3 炎性小体在炎症疾病中的研究进展 [J]. 医 学综述 , 2015, 21(24): 4451-4454.
[23] 吴冷 , 王骏 , 赵蕾 , 等 . 核苷酸结合寡聚化结构域样受体热蛋白 结构域亚家族成员 3 炎症小体的活化调节与牙周疾病的关系 [J]. 国际口腔医学杂志 , 2015, 42(6): 710-714.
[24] ZHANG A S, WANG P N, MA X Y, et al. Mechanisms that lead to the regulation of NLRP3 inflammasome expression and activation in human dental pulp fibroblasts[J]. Mol Immunol, 2015, 66(2): 253-262.
[25] 胡乐 , 沈浩 , 许佳丽 . NLRP3 与牙髓炎的相关性分析 [J/CD]. 中 国医学前沿杂志 ( 电子版), 2018, 10(8): 69-72.
[26] 陈江龙 , 陈砼 , 吕志宝 . NLRP3 炎症小体激活转录后及翻译后调 节机制研究进展 [J]. 国际免疫学杂志 , 2020, 43(6): 670-676.
[27] 唐园园 , 贺樟平 , 吴移谋 . P2X7 受体及 NLRP3 炎性小体在炎 症性疾病中的研究进展 [J]. 中华微生物学和免疫学杂志 , 2023,43(4): 316-321.
[28] 穆瑞旭 , 勾文峰 , 魏会强 , 等 . 炎症小体 NLRP3 信号通路调控 机制及其小分子靶点抑制剂的研究进展 [J]. 现代药物与临床 ,2020, 35(11): 2283-2287.
[29] 张国华 , 胡淑橙 , 郁利 . 大黄素对大鼠实验性牙周炎模型中 NLRP3 炎性小体通路的影响研究 [J]. 中国药师 , 2019, 22(9):1596-1601.
[30] 王娜娜 , 陈莉丽 , 丁佩惠 . 核苷酸结合寡聚化结构域样受体家族 热蛋白结构域3 炎性小体与牙周炎 [J]. 国际口腔医学杂志, 2017, 44(4): 484-487.
[31] 杜秀明 . 阿司匹林能过抑制NLRP3 炎症小体激活对 1- 甲基4-苯 基 -1,2,3,6- 四氢吡啶诱导的帕金森病小鼠模型发挥神经保护作 用 [D].上海 : 中国人民解放军海军军医大学 , 2016.
[32] 江勇 , 宋剑刚 , 朱大侠 , 等 . 柚皮素通过调控巨噬细胞 NLRP3 炎 症小体活化对脓毒症致急性肺损伤的影响 [J]. 山东大学学报( 医 学版 ), 2021, 59(1): 14-21.
[33] 陈凌 , 茅松 , 朱若尘 , 等 . NLRP3 抑制剂 MCC950 对中性粒细胞 性哮喘气道炎症的影响及其作用机制 [J]. 中国生物制品学杂志 , 2022, 35(7): 829-835.
[34] JING W K, SUN S K, WANG D Y, et al. MicroRNA ‐22 suppresses NLRP3 / CASP1 inflammasome pathway‐mediated proinflammatory cytokine production by targeting the HIF ‐ 1α and NLRP3 in humandental pulp fibroblasts[J]. Inte EndodJ, 2022, 55(11): 1225-1240.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/70912.html