SCI论文(www.lunwensci.com):
摘要:背景:乐伐替尼是一种多靶点受体酪氨酸激酶抑制剂,欧洲药品管理局(EMA)以及美国食品药品监督管理局(FDA)已于2015年 批准乐伐替尼用于治疗甲状腺癌,尤其是局部复发或转移性、进行性、放射性碘难治性分化型甲状腺癌的患者⑴。且2017年12月,乐伐替尼 作为抗肝癌制剂被中国国家食品药品监督管理总局授予优先审批评审资格。本文主要就目前乐伐替尼在甲状腺癌中的临床研究进展进行讨论。 笔者从Pubmed, Cochrane Library, EMBASE、中国国家知识基础设施数据库以及万方数据库进行了检索,然后对检索结果进行分析,以此对 乐伐替尼治疗放射性碘难治性分化型甲状腺癌的无进展生存期(PFS)、客观应答率(ORR)和不良事件进行研究。目前的临床研究显示,乐 伐替尼延长了放射性碘难治性分化型甲状腺癌患者的PFS,提升了 ORR。高血压、腹泻、乏力或疲劳、食欲不振、体重下降等是其最常见的 副作用。得出乐伐替尼可显著改善放射性碘难治性分化型甲状腺癌患者的PFS及ORR。尽管具有一些副作用,但它目前仍然是治疗甲状腺癌, 尤其是放射性碘难治性分化型甲状腺癌最有希望的药物之一。
关键词:乐伐替尼;甲状腺癌;临床研究
本文引用格式:崔玉娇,董建军,廖琳.乐伐替尼治疗放射性碘难治性甲状腺癌的研究进展卩].世界最新医学信息文摘,2019,19(30):108-109,111.
Research Progress of Levotinib in the Treatment of Refractory Thyroid Cancer with Radioiodine
CUI Yu-jiao1, DONG Jian-jun2, LIAO Lin3*
(1. Shandong University of Traditional Chinese Medicine, Jinan Shandong; 2.Department of Endocrinology, Qilu Hospital, Shandong University, JinanShandong; 3. Department qfEndocrinology, Qianfoshan Hospital, Shandong Province, Jinan Shandong)
ABSTRACT: Background:Lenvatinib is a multi-target receptor tyrosine kinase inhibitor,and the US Food and Drug Administration (FDA) approved lenvatinib in 2015 for the treatment of thyroid cancer,especially local recurrence or metastatic,progressive, radioactive iodine-refractory differentiated thyroid cancer patients.And in December 2017,levabinib was granted the priority approval accreditation by the State Food and Drug Administration of China as an anti-liver cancer preparation.This article mainly discusses the current clinical research progress of levartinib in thyroid cancer. The authors searched from Pubmed,Cochrane Library,EMBASE,China National Knowledge Infrastructure Database and Wanfang Database,and then assessed the progression-free survival (PFS),objective response rate (ORR) and adverse events of lenvatinib in treatment of radioactive iodine-refractory differentiated throid cancer.Current clinical studies have shown that lenvatinib prolongs PFS in patients with radioactive iodine-refractory differentiated thyroid cancer and improves ORR High blood pressure,diarrhea,fatigued,loss of appetite,weight loss,etc. are the most common side effects.Conclusion:Lenvatinib can significantly improve PFS and ORR in patients with radioactive iodi ne-refractory differentiated thyroid cancer. De spite its side effects, it is still one of the most promising drugs for the treatment of thyroid cancer,especially radioactive iodine-refractory differentiated thyroid cancer.
KEY WORDS: Lenvatinib; Thyroid cancer; Clinical study
0引言
甲状腺癌(TC)作为一种常见的内分泌恶性肿瘤,近几十年 来全球发病率迅速增加。分化型甲状腺癌(DTC )是甲状腺癌最 常见的亚型,通常可通过手术、放射性碘(RAI)以及促甲状腺激 素(TSH)抑制手段治疗⑵,10年生存率约
为90%团。然而其中约 15%的患者可出现局部复发和/或远处转移,近三分之二的患者将 成为预后不良的放射性碘难治性分化型甲状腺癌(RR-DTC )[气
由日本卫材公司研发生产的乐伐替尼是一种新型靶向药物, 2015年被美国FDA批准用于治疗放射性碘难治性分化型甲状 腺癌。乐伐替尼是一种小分子酪氨酸激酶抑制剂,可抑制血管 内皮生长因子受体1-3 ( VEGFR1-3 )、成纤维细胞生长因子受 体1-4 ( FGFR1-4 ).血小板衍生生长因子受体a (PDGFRa)、 干细胞因子受体(KIT),并在转染期间重新排列(RET),这些受 体与肿瘤血管生成密切相关,而乐伐替尼正是通过抑制这些受 体的功能来抑制肿瘤血管生成
[5]o为了更好地了解乐伐替尼治 疗放射性碘难治性分化型甲状腺癌的疗效及安全性,本文对乐 伐替尼治疗RR-DTC的相关临床研究进行了分析。
1 II期临床实验
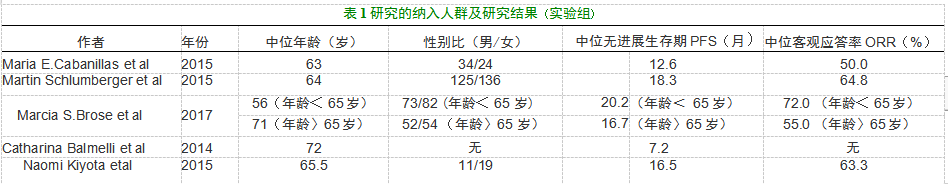
Maria E. Cabanillas等人
[6]2015年进行了一项临床实验,纳入 了 58名12个月内有疾病进展的RR-DTC患者,28夭周期内每 天口服24 mg乐伐替尼一次,主要结局指标是0RR,次要结局指 标包括PFS和安全性。经过14个月的随访,患者的0RR
为50% (95% CI:37%-63% ),中位响应时间为3.6个月,中位应答持续时 间为12.7个月,中位PFS为12.6个月(95% CI:9.9-16.1个月)。 该实验为进一步研究乐伐替尼的疗效与安全性提供了参考。
2 III期临床实验——SELECT实验
2015年,Martin Schlumberger等人'刀进行了一项多中心、随 机、双盲、安慰剂对照HI期研究(the Study of (E7080) Lenvatinib in Differentiated Cancer of the Thyroid ( SELECT )),该研究纳入 了 392名RR-DTC患者,其中261名患者服用乐伐替尼进行治 疗(实验组),131名患者服用安慰剂(对照组)。主要结局指标 是无进展生存期,次要结局指标包括应答率、总体存活率及安全 性。实验组中位PFS为18.3个月,对照组为3.6个月(进展/死 亡的风险比为0.21;99% CI:0.14-0.31;P<0.001 )
o实验组的应 答率为64.8%( 4个完全应答和165个部分应答),对照组为1.5% (P<0.001 )。与安慰剂相比,乐伐替尼使得RR-DTC患者的PFS 和应答率得到显著改善。
3影响疗效的因素
3.1年龄
Marcia S.Brose等人⑻按照年龄>65岁或年龄W 65岁对 SELET实验中的392名研究对象进行了分层分析,结果显示, 实验组与对照组相比,65岁以下中位PFS为20.2个月比3.2个 月(风 险比 0.19 ; 95%CI, 0.13-0.27 ;P<0.001 ),65 岁以 上中位 PFS 为 16.7 个月 比 3.7 个月(风险 比 0,27;95%CI,0.17-0.43; P<0.001 ),两个年龄层的实验组患者在PFS方面均比安慰剂组 有明显改善,组内各年龄层间的PFS无明显差异;此外,65岁以 上年龄层的实验组患者总生存期显著高于同年龄层的安慰剂组 患者(风险比,O.53;95%CI,O.31-O.91;P=O.O2O ),从而证实了乐伐 替尼在老年患者中的疗效。
3.2地域
2014年Catharina Balmelli等人⑼在瑞士招募了 13名中位 年龄为72岁的RR-DTC患者,并让所有患者以乐伐替尼24mg 每日一次的剂量接受治疗,主要结局指标为总生存期,次要结局 指标包括应答率、PFS和毒性。值得注意的是,纳入的13名患 者中,有12名患者(92% )患有肺转移,9名患者(69% )患有骨转移,放射性碘难治性状态在开始接受乐伐替尼治疗之前的 中位持续时间为48个月。研究结果显示,4名患者(31%)达 到部分缓解(PR ),4名患者(31%)病情稳定(SD),疾病控制率 (DCR)为 62%,中位 PFS 为 7.2 个月(95%CI,0.78—13.67),中位 总生存期为22.7个月(95%CI;0-53.9)无进展生存期结果的不 理想可能是其较小的样本量及所选择患者群体的广泛异质性导 致的,但毫无疑问,该研究体现了乐伐替尼在RR—DTC患者中的 临床益处。
2015年Naomi Kiyota等人[10]对SELET实验中的40位(实 验组狀=30;对照组狀=10 )日本患者进行了亚组分析,以评估乐 伐替尼在参与SELECT的日本患者中的有效性与安全性,其主 要结局指标为PFS,次要结局指标包括总生存期,总体应答率和 安全性。分析指出,日本患者的PFS (中位PFS:实验组,16.5 个月;对照组,3.7个月),与SELET实验结果无明显差异(风 险比,0.39;95 % CI010-1.57;阵0.067 ),可能是因为样本量较 少。实验组与对照组的总体应答率分别为63.3%和0%,总生存 期则没有显著差异。由此可见,乐伐替尼的疗效在日本患者和 SELECT实验总体中的研究结果是相似的。表格1总结了以上 研究的纳入人群及研究结果(实验组)。
4乐伐替尼的安全性
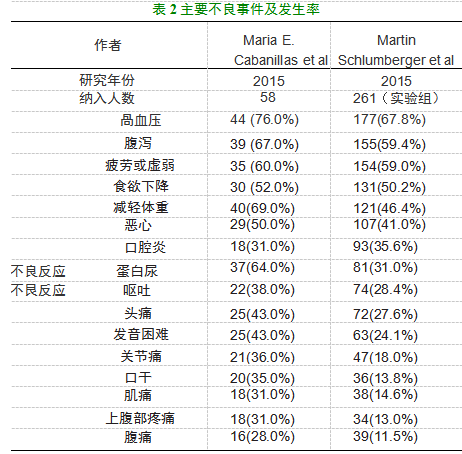
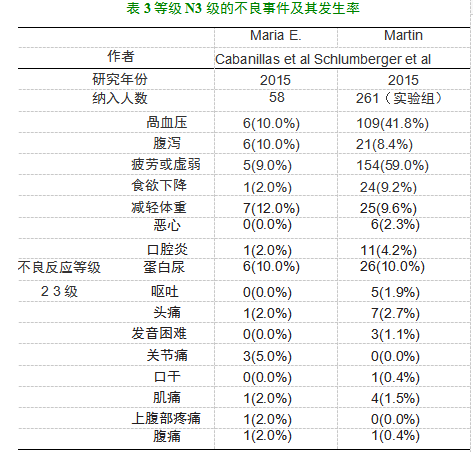
2015年的乐伐替尼U期临床实验[6]中,在中位治疗持续时 间的13.5个周期(总范围包括1 — 19个周期)内,所有患者均出 现治疗引起的不良事件(TEAE),最常见的不良事件包括高血 压(76%)、体重减轻(69%)、腹泻(67%)、尿蛋白(64%)、疲劳 (60%、、食欲下降(52% )以及恶心(50%、,大多数高血压和尿 蛋白事件为1级或2级,无需调整剂量或停止治疗;有42名患者 (72%)发生3级或4级TEAE。实验中报告了 6例4级TEAE, 包括低钙血症、高钾血症、痉挛和急性心肌梗死各一例以及2例 肺栓塞;至少2位患者因TEAE蛋白尿(5%、、肺栓塞(3%)或 深静脉血栓形成(3%、导致药物戒断;有28位患者(48%、发生 非致命性严重不良事件;至少2位患者发生脱水(7%)、低血压 (5% )、肺栓塞(3% )、下腹痛(3% )、高血压(3%、和心力衰竭 (3%)。最后一剂lenvatinib治疗后30天内发生3例死亡:1例 死于疾病进展,2例在严重不良事件后死亡(1例动脉血管破裂 和1例心脏骤停)
2015年的SELET实验[7]也记载了乐伐替尼的副作用:实 验组的中位治疗时间为13.8个月,TEAE发生率为97.3%,其 中3级或以上TEAE发生率为75.9%,常见的不良反应包括高 血压(所有等级,69.3%;等级N 3级,42.9%,、蛋白尿(所有等 级,32.2%;等级N 3级,10.0% )、动脉血栓栓塞作用(所有等级, 5.4%;等级N 3级,2.7% )、静脉血栓栓塞效应(所有等级,5.4%; 等级N 3级,3.8%)、肾功能衰竭,包括急性肾功能衰竭(所有等 级,4.2% ;等级N 3级,1.9%)、肝功能衰竭(N 30.4%)、胃肠痿 (所有等级,1.5%;等级N 3级,0.8% )、校正后QT间期延长(所 有等级,8%;等级N 3级,1.5% )和可逆性后部脑病综合征(所 有等级,0.4%;等级N 3级,0%)实验组在实验期间的20例死 亡中有6例(2.3% )被认为与治疗有关,包括1例肺栓塞和1例 出血性中风。由于治疗期间产生的不良反应,lenvatinib停药率 为14.2%。表格2、3分别说明了 U期与瓦期实验中的主要不良 事件及等级N 3级的事件发生情况(实验组)。
5讨论
以上研究中的副作用与很多文献[11'15]中提到的VEGF/ VEGFR抑制剂的毒性基本一致,且大多数不良反应通过临床干 预或剂量调整可得到有效控制。
乐伐替尼作为一种新型的靶向药物,已被研究证明可明显延 长放射性碘难治性分化型甲状腺癌患者的无进展生存期及总生 存期,显著提升患者的缓解率,甚至可以实现肿瘤的减小[16],是 除凡德他尼[17,18]、索拉非尼[19,20]以外常规疗法下预后不佳的甲 状腺癌患者的又一福音。虽然之前的研究中乐伐替尼也曾出现 一些较为广泛、严重的不良事件,但临床上可通过剂量调整或一 些干预措施对不良事件进行管理,而且更严格的筛选符合用药 条件的RR—DTC患者服用乐伐替尼治疗也可有效预防不良事件 的发生。
虽然欧洲EMA和美国FDA已于2015年批准乐伐替尼用 于治疗甲状腺癌,但乐伐替尼尚未在我国上市。令人欣喜的是, 2017年12月,乐伐替尼被中国国家食品药品监督管理总局授予 优先审批评审资格。未来乐伐替尼仍需继续开展大规模前瞻性 研究和相关的荟萃分析,为临床提供更权威的参考。
参考文献
[1] Sanitarios, A.A.E.D., Informe de Posicionamiento Terapeutico de lenvatinib (Lenvima®) en cancer diferenciado de tiroides refractario a tratamiento con [J]. Iodo, 2017,131.
[2] Cabanillas, M.E., D.G. McFadden and C. Durante, Thyroid cancerQ]. Lancet, 2016,388(10061): 2783-2795.
[3] Durante, C., et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy0]. J Clin Endocrinol Metab, 2006, 91(8): 2892-9.
[4] Jin, Y., et al. Radioiodine refractory differentiated thyroid cancerQ]. Crit Rev Oncol Hematol, 2018,125: 111-120.
[5] Suyama, K. and H. Iwase, Lenvatinib: A Promising Molecular Targeted Agent for Multiple CancersQ]. Cancer Control, 2018,25(1): 1073274818789361.
[6] Cabanillas, M.E., et al. A phase 2 trial of lenvatinib (E7080) in advanced, progressive, radioiodine- re frac tory, differentiated thyroid cancer: A clinical outcomes and biomarker assessment[J]- Cancer, 2015,121(16): 2749-56.
[7] Schlumberger, M., et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancerQ]. N Engl J Med, 2015,372(7): 621-30.
[司 Brose, M.S., et al. Effect of Age on the Efficacy and Safety of Lenvatinib in Radioiodine-Refractory Differentiated Thyroid Cancer in the Phase III SELECT TrialQ]. J Clin Oncol, 2017,35(23): 2692-2699.
[9] Balmelli, C., et al. Lenvatinib in Advanced Rad io iodine-Re fr actory Thyroid Cancer - A Retrospective Analysis of the Swiss Lenvatinib Named Patient ProgramQ]. J Cancer, 2018,9(2): p. 250-255.
[10] Kiyota, N., et al. Subgroup analysis of Japanese patients in a phase 3 study of lenvatinib in rad ioiodine -re frac tory differentiated thyroid cancer。]. Cancer Sci, 2015,106(12):1714-21.
[11] Eskens, F.A. and J. Verweij. The clinical toxicity profile of vascular endothelial growth factor (VEGF) and vascular endothelial growth factor receptor (VEGFR) targeting angiogenesis inhibitors; a re view [J]. Eur J Cancer, 2006,42(18): 3127-39.
[12] Klastersky, J. A. Adverse events of targeted therapies [J]. Curr Opin Oncol,2014,26(4):395-402.
[13] Cao, Y., VEGF-targeted cancer therapeutics-paradoxical effects in endocrine organs [J] - Nat Rev Endocrinol, 2014,10(9): 530-9.
[14] Alameddine, R.S., et al. Cardiac and vascular toxicities of angiogenesis inhibitors: The other side of the coin [J]- Crit Rev Oncol Hematol, 2015,96(2): 195-205.
[15] Ghatalia, P., et al. Hepatotoxicity with vascular endothelial growth factor receptor tyrosine kinase inhibitors: A meta-analysis of randomized clinical trials Q]. Crit Rev Oncol Hematol, 2015,93(3): 257-76.
[16] Robinson, B., et al. Characterization of Tumor Size Changes Over Time From the Phase 3 Study of Lenvatinib in Thyroid CancerQ]. J Clin Endocrinol Metab, 2016,101(11): 4103-4109.
[17] Leboulleux, S., et al. Vandetanib in locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 2 trial[J]- Lancet Oncol, 2012,13(9): 897-905.
[18] Wells, S.J., et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial 0] .J Clin Oncol, 2012,30(2): 134-41.
[19] Brose, M.S., et al. Rationale and design of decision: a double-blind, randomized, placebo-controlied phase III trial evaluating the efficacy and safety of sorafenib in patients with locally advanced or metastatic radioactive iodine (RAI)-re frac tory, differentiated thyroid cancer [J]. BMC Cancer, 2011,11: 349.
[20] Gupta-Abram son, V., et al. Phase II trial of sorafenib in advanced thyroid cancerQ]. J Clin Oncol, 2008,26(29): 4714-9.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/5207.html