SCI论文(www.lunwensci.com):
摘要:循环肿瘤细胞(circulating tumor cells,CTC)是外周血中肿瘤细胞的统称,通过循环肿瘤检测可以及时、动态的对体内肿瘤状态进行无创监测。本文报道1例卵巢癌患者临床资料,以CTC监测其肿瘤复发及评估治疗效果,并结合国内外文献对CTC检测方法和其在卵巢癌早期诊断、疗效评价、预后预测以及指导个体化诊疗中的应用进行文献综述。
关键词:循环肿瘤细胞;卵巢癌;肿瘤复发,肿瘤转移
本文引用格式:王祥旭,申兴勇,张晶,等.循环肿瘤细胞在卵巢癌复发监测及疗效评估中的应用1例及文献回顾[J].世界最新医学信息文摘,2019,19(76):75-76,78.
Application of Circulating Tumor Cells in Monitoring Tumor Relapse and Evaluating Therapeutic Efficacy in Ovarian Cancer:A Case Report and Review of Literature
WANG Xiang-xu,SHEN Xing-yong,ZHANG Jing,WANG Xiao-wen,ZHANG Hong-mei*
(Department of Clinical Oncology,Xijing Hospital,The Air Force Medical University,Xi’an Shaanxi)
ABSTRACT:Circulating tumor cells(CTC)are the general term for tumor cells in peripheral blood.It is a non-invasive method for monitoring tumor status in a timely and dynamic manner.This article reports the clinical data of a patient with ovarian cancer,and monitors the tumor recurrence and evaluates the therapeutic effect by CTC.Combined with domestic and foreign literatures,this paper reviews the CTC detection methods and its application in early diagnosis,efficacy evaluation,prognosis prediction and individualized treatment of ovarian cancer.
KEY WORDS:Circulating tumor cells(CTC);Ovarian cancer;Relapse;Metastasis
0引言
循环肿瘤细胞(circulating tumor cell,CTC)是外周血液循环中肿瘤细胞的统称。肿瘤细胞不断增殖、迁移并经过上皮-间质转化进入血液循环成为CTC,转移至相应靶器官,形成肿瘤远处转移灶[1]。研究显示,CTC检测比传统组织活检更微创且更具时效性;与血清肿瘤标志物相比更具敏感性和特异性;较影像学提前2-6周发现肿瘤复发进展[2]。临床实践中CTC检测是更具前景的监测肿瘤复发及评估疗效的方法,现报道1例我科住院的卵巢癌根治术后患者临床资料,以CTC监测其肿瘤复发转移并评估治疗效果,进一步结合国内外文献对CTC检测在卵巢癌诊疗中的应用进行综述。
1临床资料
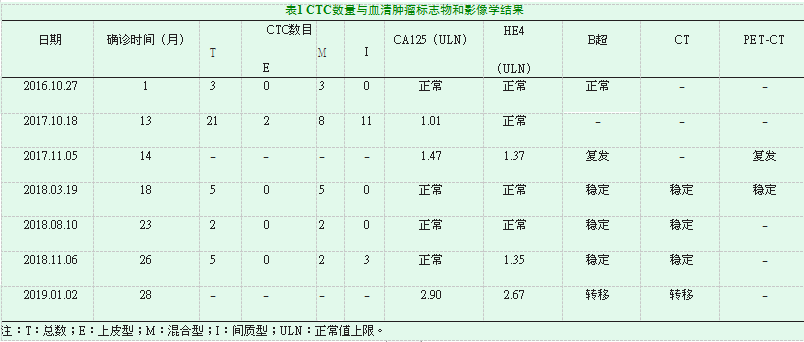
51岁女性,2016年9月3日因“腰部不适”于我院查阴式超声示:子宫左上方8.7cm×8.9cm包块,考虑卵巢来源;血清CA125正常(正常值<35.00U/mL),人附睾蛋白4(HE4)未查(正常值<74.30 pmol/L)。9月20日接受“腹腔镜探查术、全子宫+双附件+阑尾切除+盆腔淋巴结清扫+大网膜切除术”。术后病理:卵巢高级别浆液性腺癌,Ⅰa期,Ki-67标记指数局部约60%。术后未治疗。术后1个月采外周静脉血5mL利用Can Patrol CTC分型检测技术(益善)查CTC:总数3个(上皮型0个、混合型3个、间质型0个);血清CA125和HE4正常;阴式超声正常。此后分别于术后3个月、6个月、11个月复查血清CA125、HE4和阴式超声均正常。
2017年10月18日(术后13个月)查CTC:总数21个(上皮型2个、混合型8个、间质型11个);血清CA125 1.01ULN(upper limits of normal),HE4正常;患者无不适症状,未进行影像学评估。一个月后复查血清CA125 1.47ULN,HE4 1.37ULN,均升高;进一步PET-CT提示:阴道残端(1.4cm×1.9cm)、肝右叶前间隙(2.4 cm×2.0cm)、胸12椎体水平膈肌脚区淋巴结多发转移。判断病情进展至Ⅳ期,给予“贝伐珠单抗+多西他赛+顺铂”治疗6周期,末次治疗时间为2018年3月20日(术后18个月)。之后即复查CTC:总数5个(上皮型0个、混合型5个、间质型0个),叫化疗前明显降低;血清CA125、HE4降至正常;阴式超声、CT未再发现明确病变。复查PET-CT示:原阴道残端、原肝右叶前间隙和胸12椎体水平膈肌脚区病变消失,评估治疗效果显著。5月2日(首次术后20个月)行“腹腔探查术+腹壁病灶活检术”,术中见盆腔腹壁及肝区腹壁散在粟粒状白色组织;病理:腹膜浸润性癌,符合卵巢高级别浆液性癌,Ki-67标记指数约85%;基因检测BRCA 1/2无突变。6月5日(二次术后1个月)复查血清CA125、HE4正常;阴式超声、CT未见明确病变;给予顺铂腹腔区域治疗联合多西他赛静脉化疗治疗2周期。之后(二次术后3个月)复查CTC:总数2个(上皮型0个、混合型2个、间质型0个);血清CA125、HE4正常;阴式超声、CT未发现明确病变。给予贝伐珠单抗维持治疗至2018年10月15日(共计3周期),期间多次复查血清CA125、HE4均正常;影像学提示未见明确肿瘤复发征象。
2018年11月6日(二次术后6个月)复查CTC:总数升高至5个(上皮型0个、混合型2个、间质型3个);血清CA125正常,HE4 1.35ULN;阴式超声、CT未见明确病变。鉴于该患者既往病程中CTC数目升高与病情进展密切相关,本次CTC总数尤其是间质型CTC升高考虑疾病进展可能,给予“贝伐珠单抗+盐酸多柔比星脂质体”二线治疗2周期后,复查血清CA125 2.90ULN、HE4 2.67ULN,明显升高;影像学评估提示病情进展。患者ECOG评分好(0-1分),遂给予“贝伐珠单抗+培美曲塞+洛铂”三线治疗,至今已3周期,肿瘤标志物下降。目前患者带瘤生存,ECOG评分为1分,NRS评分为0分。
2讨论
本例患者,51岁时接受“腹腔镜探查术+卵巢癌根治术”,术后病理:卵巢高级别浆液性腺癌,Ⅰa期。术后1个月查CTC总数3个(均为混合型);血清CA125、HE4正常;阴式超声正常。术后13个月查CTC数目上升至21个,且以间质型为主;血清CA125略升高、HE4正常。一个月后复查血清CA125、HE4均高于正常;影像学提示肿瘤复发,多发转移。接受“贝伐珠单抗+多西他赛+顺铂”一线治疗6周期后,复查CTC数目由21降至5个,间质型由11降至0个;血清CA125、HE4降至正常;阴式超声、CT提示肿瘤缓解。首次术后20个月接受二次腹腔探查手术,二次术后1个月查CTC:总数2个(均为混合型);血清CA125、HE4正常;阴式超声、CT示未见明确病变。二次术后6个月查CTC数目较前升高且检测出间质型CTC;CA125正常,HE4略升高;阴式超声、CT未见明显病变。给予“贝伐珠单抗+盐酸多柔比星脂质体”二线治疗,之后复查血清CA125、HE4继续升高;影像学评估提示肿瘤进展。从本例患者临床资料可以看出CTC的检出可较传统肿瘤标志物(CA125/HE4)和影像学方法更早发现卵巢癌复发,且其数目变化可反映治疗效果,另外间质型CTC数目升高可能提示更差的预后(见表1)。现将CTC检测在卵巢癌诊断治疗中的应用进行综述。
2.1CTC检测方法
外周血中CTC含量低,仅占外周血白细胞含量的1/107~1/106,且具有很强的异质性[3],因此CTC的富集与鉴定是CTC检测的难点。基于肿瘤细胞生物学特性与物理性质差异,CTC富集方法可分为两大类。第一类为基于细胞表面标志物和其侵袭能力不同的生物学特性富集法,具有代表性的有Cell Search技术与免疫磁珠阴性富集法,前者利用免疫磁珠法将上皮细胞黏附因子(epithelial cells adhesion molecule,EpCAM)阳性的CTC从7.5mL血液中富集出来并计数[4];后者利用白细胞表面抗原CD45分子,将血液中白细胞去除,该方法减少了EpCAM阴性CTC的丢失,提高了检出率。第二类为利用CTC密度、体积、带电荷和可塑性等性质不同的物理学特性富集法[5,6],主要包括过滤法[7]、电化学[8]和微流控[9]等检测技术。富集后的CTC根据细胞形态学、免疫学及分子生物学差异进行具体分型鉴定,主要鉴定技术包括上皮细胞免疫斑点技术[10]、免疫荧光标记、聚合酶链式反应(PCR)、逆转录-聚合酶链式反应(RT-PCR)和RNA原位杂交等[5]。不同的CTC检测方法所需的外周血样本从4mL到10 mL不等,本例患者5次CTC检测均采用Can Patrol CTC分型检测技术(益善),属于第二类物理学特性富集法。采集外周静脉血5mL通过孔径8m的纳米材料滤膜进行CTC富集,并根据CTC表面标志物(EpCAM、CK、vimentin等)不同,利用多重RNA原位杂交技术,将CTC分为上皮型、间质型及上皮-间质混合型。
2.2CTC检测与卵巢癌早期诊断
卵巢癌早期症状隐匿,常规方法难以早期筛查及诊断,约70%的卵巢癌患者确诊时,已属于中晚期。目前常用的卵巢癌筛检方法包括血清肿瘤标志物和影像学方法,前者主要包括血清CA125和HE4;后者包括B超、CT、MRI以及PET-CT。血清肿瘤标志物灵敏度高,但特异性较差,易误诊;影像学方法可直观评估肿瘤大小,但对早期肿瘤复发进展分辨率低。近年来,越来越多研究表明CTC在卵巢癌早期诊断、复发监测、预后预测和指导个体化诊疗中具有一定临床价值。
CTC检测具有微创、实时和高特异性等特点,可作为血清学、影像学和病理学等检查手段的重要补充。2018年南方医科大学课题组[11],采用免疫磁珠阴性富集和免疫荧光原位杂交法,对381例受试者(其中正常对照151例、卵巢良性肿瘤138例、卵巢癌92例)进行CTC检测,结果显示:卵巢癌患者CTC阳性(>2个/4mL外周血)检出率为90.22%,而正常对照和卵巢良性肿瘤患者中均为0;与金标准病理学相比,CTC检测诊断卵巢癌的符合率为97.64%,灵敏度为90.22%,特异度为100%。
2.3CTC检测与卵巢癌疗效评估及预后预测
CTC富含全面的肿瘤信息,可更及时有效地进行肿瘤疗效评估和预后预测。2018年北京大学基础医学院课题组[12],采用免疫磁珠筛选结合多重RT-PCT技术,检测109名上皮型卵巢癌患者外周血(5mL)中CTC数目及细胞分型,结果显示:CTC数目高的患者疗效相对较差,且CTC中EpCAM或HER2高表达的患者多发生化疗耐药。在晚期卵巢癌研究中,2014年西班牙研究者Poveda A.等[13]采用Cell Search系统(强生)对216例卵巢癌复发患者进行CTC检测,探寻CTC数目与疾病预后的相关性,结果显示高CTC的患者预后更差,复发进展和死亡风险更高。国内亦有研究显示,CTC阳性(>2个/7.5mL外周血)是影响卵巢癌复发和生存的独立危险因素[14]。乳腺癌中研究显示,在恶性肿瘤复发转移前,原发灶肿瘤细胞通过微环境作用将从上皮型转化为间质型,间质型CTC具有更强的侵袭迁移能力和耐药能力,间质型CTC出现和升高往往提示更差的预后[15-17]。间质型CTC在卵巢癌中临床作用尚缺少大样本研究报道。
2.4CTC检测与卵巢癌个体化医疗
随着单细胞全基因组测序的深入发展,基于CTC的单细胞基因检测和蛋白分析技术,在指导肿瘤患者个体化诊疗中作用愈加突出[18]。2014年德国埃森大学Kuhlmann JD.等[19]通过免疫磁珠富集和RT-PCR联合对243名卵巢癌患者进行CTC检测,并基于CTC进行复交叉互补基因1(ERCC1)表达分析,结果发现CTC中ERCC1表达阳性的患者预后较差,且伴有铂类药物耐药。2015年捷克研究者Kolostova K.等[20]进行的一项包含118名卵巢癌患者的多中心、随机、前瞻性研究中,采集外周血8mL利用孔径为8m的多孔聚碳酸脂膜富集CTC,并进行体外培养。通过对体外培养的CTC进行基因分析和肿瘤相关标志物测定,为临床化疗药物选择提供了更具针对性的建议。
综上所述,CTC检测虽然在卵巢癌临床应用中尚处于起步阶段,但是其在卵巢癌早期诊断、复发监测、疗效评估以及预后预测方面显示了巨大潜力。根据患者CTC数目、分型以及CTC中肿瘤基因组信息可以更为深入地了解肿瘤复发转移机制,发现肿瘤治疗的新靶点,从而为卵巢癌个体化诊疗提供更多思路。
参考文献
[1]Allard W J,Matera J,Miller M C,et al.Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases[J].Clin Cancer Res,2004,10(20):6897-6904.
[2]董小丽,赵恩锋.上皮-间质型循环肿瘤细胞在卵巢癌复发转移中的作用[J].解放军医学杂志,2016,41(09):788-791.
[3]郑颖龄,仝进毅.循环肿瘤细胞检测在妇科恶性肿瘤中应用的研究进展[J].中国实用妇科与产科杂志,2018,34(01):123-127.
[4]Chen X,Zhang Z.Study on the Detection Rate of Cell and Linearity Performance Detection Method in the Cell-Search System[J].Chinese journal of medical instrumentation,2016,40(1):58-66.
[5]Ferreira M M,Ramani V C,Jeffrey S S.Circulating tumor cell technologies[J].Mol Oncol,2016,10(3):374-394.
[6]Alix-Panabieres C,Pantel K.Technologies for detection of circulating tumor
cells: facts and vision[J].Lab Chip,2014,14(1):57-62.
[7]Zhao X H, Wang Z R, Chen C L, et al.Molecular detection of epithelial- mesenchymal transition markers in circulating tumor cells from pancreatic cancer patients: Potential role in clinical practice[J].World J Gastroenter ol,2019,25(1):138-150.
[8]Shen H, Yang J, Chen Z, et al.A novel label-free and reusable electrochemical cytosensor for highly sensitive detection and specific collection of CTCs[J]. Biosens Bioelectron,2016,81:495-502.
[9]Okano H, Konishi T, Suzuki T, et al.Enrichment of circulating tumor cells in tumor-bearing mouse blood by a deterministic lateral displacement microfluidic device[J].Biomed Microdevices,2015,17(3):9964.
[10]Alix-Panabieres C, Pantel K.Liquid biopsy in cancer patients: advances in capturing viable CTCs for functional studies using the EPISPOT assay[J]. Expert Rev Mol Diagn,2015,15(11):1411-1417.
[11]陈志强 , 米贤军 , 陈昂 , 等 . 外周血循环肿瘤细胞检测在筛查卵巢上皮性癌中的应用 [J]. 中山大学学报 ( 医学版 ),2018,39(06):891-896.
[12]Zhang X, Li H, Yu X, et al.Analysis of Circulating Tumor Cells in Ovarian Cancer and Their Clinical Value as a Biomarker[J].Cellular Physiology and Bi ochemistry,2018,48(5):1983-1994.
[13]Poveda A, Kaye S B, Mccormack R, et al.Circulating tumor cells predict progression free survival and overall survival in patients with relapsed/recurrent advanced ovarian cancer[J].Gynecol Oncol,2011,122(3):567-572.
[14]莫美绒 , 崔尖 , 赵晓慧 . 外周血循环肿瘤细胞对卵巢癌预后的评估价值 [J]. 检验医学与临床 ,2018,15(14):2151-2153.
[15]Yu M, Bardia A, Wittner B S, et al.Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition[J]. Science,2013,339(6119):580-584.
[16]Kasimir-Bauer S, Hoffmann O, Wallwiener D, et al.Expression of stem cell and epithelial-mesenchymal transition markers in primary breast cancer patients with circulating tumor cells[J].Breast Cancer Res,2012,14(1):R15.
[17]Yeung K T, Yang J.Epithelial-mesenchymal transition in tumor metastasis[J]. Mol Oncol,2017,11(1):28-39.
[18]李军 , 殷正丰 . 循环肿瘤细胞分子鉴定与个体化肿瘤诊疗 [J]. 世界华人消化杂志 ,2013,21(26):2679-2684.
[19]Kuhlmann J D, Wimberger P, Bankfalvi A, et al.ERCC1-positive circulating tumor cells in the blood of ovarian cancer patients as a predictive biomarker for platinum resistance[J].Clin Chem,2014,60(10):1282-1289.
[20]Kolostova K, Matkowski R, Jedryka M, et al.The added value of circulating tumor cells examination in ovarian cancer staging[J].Am J Cancer Res,2015,5(11):3363-3375.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/21691.html