SCI论文(www.lunwensci.com):
摘要:目的观察在不同H-Y分期的帕金森病患者之间,血脂水平是否有差异。方法将入选的帕金森病患者按照H-Y分级进行分组,比较各组之间血脂水平是否有差异,并分析病例组血脂水平与病情严重程度之间有无相关性。结果病例组与对照组在TG水平上差异无统计学意义(P>0.05),病例组较对照组TC、HDL-C及LDL-C水平低,差异有统计学意义(P<0.05,P<0.05)。病例组中血脂水平与病情严重程度之间未见明显相关性(P>0.05)。结论血脂水平下降可增加PD患病的风险,尤以HDL-C下降对PD病情的影响最明显,低脂血症在PD的发生发展中可能扮演了重要角色。
关键词:帕金森病;血脂;代谢紊乱
本文引用格式:徐泽恒,杨新玲.血脂水平与帕金森病患者病情严重程度的相关性研究[J].世界最新医学信息文摘,2019,19(59):18-19.
Study on the Correlation between Serum Lipid Level and Severity of Parkinson's Disease
XU Ze-heng,YANG Xin-ling*
(Department of Neurology,Second Affiliated Hospital of Xinjiang Medical University,Urumqi Xinjiang)
ABSTRACT:Objective To observe whether there are differences in blood lipid levels among patients with Parkinson's disease with different h-y stages.Methods The selected patients with Parkinson's disease were divided into groups according to h-y classification,and the differences of blood lipid levels between each group were compared,and the correlation between blood lipid levels and disease severity was analyzed in the case group.Results There was no statistically significant difference in TG levels between the case group and the control group(P>0.05),while the TC,hdl-c and ldl-c levels in the case group were lower than those in the control group(P<0.05,P<0.05).No significant correlation was found between lipid levels and severity of the disease in the case group(P>0.05).Conclusion The decrease of lipid level can increase the risk of PD,especially the decrease of hdl-c,which has the most obvious effect on PD.Hypolipidemia may play an important role in the occurrence and development of PD.
KEY WORDS:Parkinson's disease;Serum lipid;Metabolic disorders
0引言
帕金森病是位居第二位的神经系统退行性疾病,在我国75岁以上老年人群中发病率为1.7%[1]。其临床表现以静止性震颤、肌僵直、姿势平衡障碍、运动迟缓为主要表现,并有嗅觉减退、睡眠障碍、消化功能紊乱如便秘及焦虑等一系列非运动症状。PD患者病程后期活动受限明显,药物治疗效果逐渐下降,严重影响生活质量。目前针对病因学的研究提示,PD的发病与年龄、基因易感性、环境因素等因素有关。目前的相关研究显示,血脂可能在PD的发病机制中起到一定的作用[2]。有研究提示PD患者的血脂水平较健康对照组偏低。而其具体机制仍未有明确的阐述,本文纳入无心脑血管病的PD患者,并对其进行H-Y分期,以期研究在无降脂药物干预下,PD患者血脂水平是否较健康对照组有差异,及是否与疾病分期有相关性,意在为PD的诊疗带来新的切入点。
1资料与方法
1.1研究对象
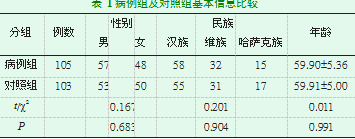
本病例对照研究中入选病例均为在2017年12月至2018年8月期间新疆医科大学第一附属医院神经内科住院诊疗的明确诊断为PD的患者其中男性57例,女性48例,汉族58例,维吾尔族32例,哈萨克族15例,其年龄在50-72岁,平均(59.90±5.36)岁,病程2年-15年。符合英国脑库帕金森病诊断标准。入选病例组按照改良的Hoehn-Yahr分级法分级,I级13例,II级11例,III级33例,IV级37例,V级11例。病例组符合英国脑库PD病诊断标准,并定期在我院进行随访及复诊。排除标准:排除帕金森叠加综合征、帕金森综合征、合并糖尿病、合并血脂严重异常及体重指数在正常范围之内。无免疫系性、代谢性及心脑血管意外病史,近期饮食规律。并纳入同期于我院体检的健康对照组共103名,其中男性53名,女性50名,汉族55名,维吾尔族31名,哈萨克族17名,年龄在51-72岁,平均(59.91±5.00)岁,对照组亦排除合并糖尿病、合并血脂严重异常及体重指数在正常范围之内。无免疫系性、代谢性及心脑血管意外病史,近期饮食规律。
1.2研究方法
病例组及对照组均采集清晨空腹外周静脉血3 mL于紫色抗凝管中,送医院检验科进行外周静脉血生化成分检测。测定其中甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)水平。并对病例组患者进行H-Y分级。
1.3统计学处理
采用SPSS 23.0统计软件,计数资料采用构成比表示,实验检测数据为计量资料,用均数±标准差表示。首先,对组间差异性用卡方检验来明确其可比性。对两组计量资料,首先用Kolmogorov-Sminmov对两组计量资料的正态性分布进行检验,如为正太分布,则两组间差异性采用两独立样本t检验,三组及以上采用方差分析。如计量资料不符合正太分布,两组间比较采用Mann-Whitney U检验,多组比较采用Kruskal-Wallis检验。对病例组及对照组之间差异有统计学意义的血脂成分与病情分期进行相关性分析时采用pearson相关分析。
2结果
2.1各组临床资料比较
病例组及对照组在性别、年龄、民族分布上差异无统计学意义(P>0.05),具有可比性(见表1)。
2.2病例组与对照组血脂水平比较
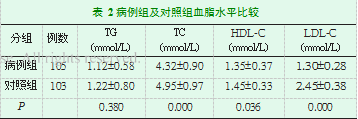
病例组与对照组在TG水平上差异无统计学意义(P大于0.05),病例组较对照组TC、HDL-C及LDL-C水平低,差异有统计学意义(P<0.05,P<0.05,表2)。
2.3相关性分析
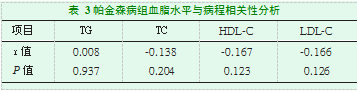
病例组中血脂水平与病情严重程度之间未见明显相关性(P>0.05,表3)。
3讨论
PD是位居第二位的神经系统退行性病变,临床上以椎体外系为症状,主要表现少动、僵直及震颤等症状,病情进行性加重,严重影响患者的身心健康及生活质量,病程晚期多因严重的运动障碍导致卧床,并引发坠积性肺炎、褥疮等并发症,预后差。PD病理表现为中脑黑质处多巴胺能神经元的变性、凋亡,导致多巴胺能神经递质减少,引起纹状体内乙酰胆碱-多巴胺两种递质失去平衡而发病,往往患者就诊时,黑质处的多巴胺能神经元损失大于百分之五十以上,引起纹状体处多巴胺能神经递质明显较少[3]。目前研究结果提示引起多巴胺能神经元凋亡的原因与年龄、基因易感性、环境因素等有关[4,5]。多巴胺能神经元减少的具体机制可能涉及氧化应激、兴奋性毒性所致的胞内钙超载、线粒体功能障碍、蛋白水解应激等有关[6]。
血浆中所含脂类统称为血脂,是中性脂肪和类脂的统称,中性脂肪包括TG和TC,而类脂包括磷脂、糖脂、固醇和类固醇,它们是生命细胞进行基础代谢的必需物质。一般说来,血脂中的主要成分是TG和TC,其中TG主要参与人体内能量代谢,而TC参于合成细胞浆膜、类固醇激素和胆汁酸。既往研究结果表明,血脂类生化指标:如TC、脂蛋白(a)等水平的异常改变,在动脉硬化形成过程中具有重要作用[7,8]。
研究发现,帕金森病及其他路易小体疾病中,黑质神经元和路易小体内出现apoE表达,且apoE受体的表达明显增加凹一。而apoE2基因具有降低LDL—C的作用[9,10]。帕金森病患者出现低TC可能与血清辅酶Q10浓度有关,TC和辅酶Q10有相同的生物合成途径,血清TC是血清辅酶QlO浓度的决定因素。而辅酶Q10作为电子传递体的基础,是呼吸链组分之一,辅酶Q10减少致线粒体功能障碍,引起多巴胺能神经元变性死亡,最终导致帕金森病。国外的一项临床研究提示更高的血清TC水平可能会减缓帕金森病的临床进展。路易小体的主要成分是a突触核蛋白,国内的一项研究显示,Q突触核蛋白基因rs356219多态性与帕金森病的发病相关[11-16]。而a突触核蛋白与脂质氧化代谢产物共同作用可产生线粒体功能障碍引起多巴胺能神经元死亡,导致帕金森病[17,18]。此外,有学者指出,营养状态不佳亦可导致HDL-C水平显著下降[19],该观点一方面说明HDL-C下降与神经元变性死亡有关,另一方面也说明通过合理的营养支持与血脂调节有望改善患者HDL-C水平,延缓病情进展、改善生存质量。
参考文献
[1]Jana N R.Protein homeostasis and aging:role of ubiquitin protein ligases[J].Neurochem Int,2012,60(5):443-447.
[2]Begley D J,Brightman M W.Structural and functional aspects of the blood-brain barrier[J].Prog Drug Res,2003(61):39-78.
[3]Kim WG,Mohney RP,Wilson B,et al.Regional difference in susceptibility to lipopolysaccharide-induced neurotoxicity in the rat brain:role of microglia[J].J Neurosci,2000,20(16):6309-6316.
[4]Hughes A J,Daniel S E,Kilford L,et al.Accuracy of clinical diagnosis of idiopathic Parkinson’s disease:a clinico-pathological study of 100 cases[J].J Neurol Neurosurg Psychiatry,1992,55(3):181-184.
[5]刘冬梅,黄宝丽,史进方.标本保存温度和保存时间对流式细胞仪检测淋巴细胞亚群及人类白细胞抗原B27结果的影响[J].中国血液流变学杂志,2016,26(3):354-358.
[6]Dexter D T,Jenner P.Parkinson disease:from pathology to molecular disease mechanisms[J].Free Radic Biol Med,2013,62(5):132-144.
[7]Hirsch E C,Hunot S.Neuroinflammation in Parkinson’s disease:A target for neuroprotection?[J].Lancet Neurology,2009,8(4):382-397.
[8]Jana N R.Protein homeostasis and aging:role of ubiquitin protein ligases[J].Neurochem Int,2012,60(5):443-447.
[9]Dauer W,Przedborski S.Parkinson’s disease:mechanisms and models[J].Neuron,2003,39(6):889-909.
[10]Dimayuga Smith V,Koot S,Mamber C,et al.Reactive glia show increased immunoproteasome activity in Alzheimer’s disease[J].Brain,2013,136(5):1415-1431.
[11]Peelaerts W,Bousset L,Van der Perren A,et al.a-Synuclein strains cause distinct synucleinopathies after local and systemic administration[J].Nature,2015,522(7556):340-344.
[12]Tyson T,Steiner J A,Brundin P.Sorting out release,uptake and processing of alpha‐synuclein during prion‐like spread of pathology[J].J Neurochem,2016,139(S1):15.
[13]Kortekaas R.Blood-brain barrier dysfunction in parkinsonian midbrain in vivo[J].Ann Neurol,2005,57(2):176-179.
[14]Louveau A,Smirnov I,Keyes TJ,et al.Structural and functional features of central nervous system lymphatic vessels[J].Nature,2015,523(7560):337-341.
[15]Reynolds AD,Stone DK,Mosley RL,et al.Nitraltedα-synuclein-induced alterations in microglial immunity are regulated by CD4+T Cell Subsets[J].J Immunol,2009,182(7):4137-4149.
[16]赵旭.帕金森病患者T淋巴细胞亚群与疾病相关性的分析[D].中国医科大学,2013.
[17]冯雪仪,陈映慧,秋辉,等.帕金森病不同年龄、病情患者的T淋巴细胞亚群检测结果分析[J].深圳中西医结合杂志,2016,26(11):46-47.
[18]余能伟,刘洁,李晓佳,等.帕金森病患者外周血T淋巴细胞亚群检测及临床意义[J].四川医学,2012,33(8):1465-1468.
[19]Papuc E,Kurys-Denis E,Krupski W,et al.Humoral response against small heat shock proteins in Parkinson’s disease[J].PLoS one,2015,10(1):54-58.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/17446.html