SCI论文(www.lunwensci.com)
文题释义:
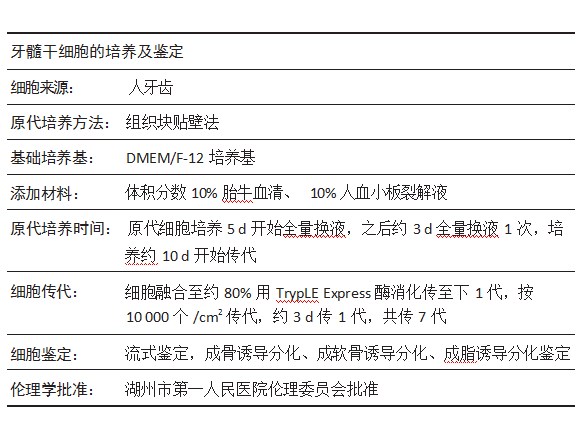
增龄因素:指提取牙源干细胞的牙齿样本所涵盖年龄区间不断递增:乳牙(6-13周岁)、少年恒牙(18周岁以下)、成年恒牙(18周岁及以上)。牙源干细胞:牙齿来源的间充质干细胞,其多向分化潜能不仅可向成牙细胞分化,还能向多种组织细胞分化,具有很高的增殖和自我更新能力。
摘要
背景:牙源干细胞在再生医学与组织工程等领域的研究不断深入,为牙相关组织修复及全身疾病治疗带来了希望。但目前对不同年龄区间牙源干细胞生物学特性上的差异缺少系统的分析。
目的:探讨脐血源血小板裂解液培养人乳牙、恒牙牙髓干细胞的生物学特性,为人血小板裂解液代替胎牛血清提供可靠依据。
方法:取出乳牙、少年恒牙及成年恒牙牙髓组织,在含体积分数为10%胎牛血清或5%,10%,15%人血小板裂解液的DMEM/F-12培养基中培养,采用细胞计数法检测4组细胞增殖情况,选取最佳人血小板裂解液浓度进行后续实验。在最佳人血小板裂解液浓度条件下,体外培养乳牙、少年恒牙及成年恒牙牙髓干细胞,显微镜下观察细胞生长状态,流式细胞术检测细胞表面特异性抗原,细胞计数法和CCK-8法检测细胞增殖能力,三系分化实验观察细胞体外分化能力。
结果与结论:①10%人血小板裂解液组的细胞增殖速率最高;②各组牙髓组织块周围均有梭形成纤维状细胞生长并扩增,乳牙与少年恒牙细胞形态无明显差异;与同代次乳牙和少年恒牙细胞相比,成年恒牙细胞体积偏大;③流式细胞术检测结果显示乳牙、少年恒牙及成年恒牙牙髓干细胞均符合间充质来源干细胞的表型特征;④成年恒牙牙髓干细胞增殖能力明显低于乳牙及少年恒牙牙髓干细胞(P<0.01);⑤成年恒牙牙髓干细胞中成骨相关基因碱性磷酸酶、骨形态发生蛋白2 mRNA表达,成脂相关基因脂蛋白脂肪酶、过氧化物酶体增殖物激活受体γ2 mRNA表达,成软骨相关基因Ⅱ型胶原α1、软骨寡聚基质蛋白mRNA表达均显著低于乳牙及少年恒牙牙髓干细胞(P<0.01);⑥结果表明,人乳牙与少年恒牙牙髓干细胞相较于成年恒牙牙髓干细胞具有更强的增殖能力与多向分化潜能,更适用于临床研究和疾病治疗。
关键词:血小板裂解液;牙髓;干细胞;分化;增龄性变化
Effects of aging factors on biological characteristics of dental stem cells
Xu Zhiguo1,2,Wu Yanfei3,Ren Zhenhui2,Yang Xuwei2,Niu Yikun2,Dong Zhilong4,Du Wei4,Yang Wenling4,Xu Xin5,Zhu Yi6,Liu Lefeng2,Liu Chao2
1College of Life and Health,Huzhou College,Huzhou 313000,Zhejiang Province,China;2Eastern Union Stem Cell&Gene Engineering Co.,Ltd.,Huzhou 313000,Zhejiang Province,China;3Huzhou First People’s Hospital,Huzhou 313000,Zhejiang Province,China;4VcanBio Cell&Gene Engineering Co.,Ltd.,Tianjin 300384,China;5Shenyang Institute of Science and Technology,Shenyang 110167,Liaoning Province,China;6Huzhou University,Huzhou 313000,Zhejiang Province,China Xu Zhiguo,PhD candidate,Associate professor,College of Life and Health,Huzhou College,Huzhou 313000,Zhejiang Province,China;Eastern Union Stem Cell&Gene Engineering Co.,Ltd.,Huzhou 313000,Zhejiang Province,China
Wu Yanfei,Master,Attending physician,Huzhou First People’s Hospital,Huzhou 313000,Zhejiang Province,China
Xu Zhiguo and Wu Yanfei contributed equally to this article.
Corresponding author:Liu Chao,Master,Senior engineer,Eastern Union Stem Cell&Gene Engineering Co.,Ltd.,Huzhou 313000,Zhejiang Province,China Co-corresponding author:Liu Lefeng,PhD candidate,Eastern Union Stem Cell&Gene Engineering Co.,Ltd.,Huzhou 313000,Zhejiang Province,China
Abstract
BACKGROUND:The research of dental stem cells in the fields of regenerative medicine and tissue engineering has been deepening,bringing hope for the repair of tooth-related tissues and the treatment of systemic diseases.However,there is a lack of systematic research and analysis on the biological characteristics of dental stem cells in different age groups.
OBJECTIVE:To explore the biological characteristics of the human deciduous tooth and permanent tooth pulp stem cells cultured in umbilical cord blood platelet lysate to provide a reliable basis for human platelet lysates to replace fetal bovine serum.
METHODS:The pulp tissues of deciduous teeth,juvenile permanent teeth and adult permanent teeth were taken out and cultured in DMEM/F-12 medium supplemented with 10%fetal bovine serum or different concentrations(5%,10%and 15%)of human platelet lysates.Cell proliferation in the four groups was detected by cytometry.The optimal concentration of human platelet lysates was selected for subsequent experiments.Under the optimal concentration of human platelet lysates,human deciduous tooth and juvenile and adult permanent tooth pulp stem cells were cultured in vitro.The cell growth status was
observed under the microscope.The specific antigen on the cell surface was detected by flow cytometry.The cell proliferation ability was tested by the cell counting method and CCK-8 assay.The cell differentiation ability in vitro was observed by a three-line differentiation assay.
RESULTS AND CONCLUSION:(1)The cell proliferation rate of the 10%human platelet lysate group was the highest.(2)In all three groups,fusiform fibrous
cells grew and expanded from around the tissue block.There was no significant difference between deciduous teeth and juvenile permanent tooth cells,but the adult permanent tooth cells were larger than the deciduous and juvenile permanent tooth cells of the same generation.(3)The results of flow cytometry showed that deciduous teeth,juvenile permanent teeth and adult permanent teeth conformed to the phenotypic characteristics of mesenchymal stem cells.(4)The proliferative capacity of adult permanent dental pulp stem cells was significantly lower than those of deciduous teeth and juvenile permanent dental pulp stem cells(P<0.01).(5)mRNA expressionsof osteoblast-related genes alkaline phosphatase and bone morphogenetic protein 2,lipoprotein lipase and peroxisome proliferator-activated receptorγ2,mRNA expressions of chondroblast related gene type II collagenα1 and cartilage oligomeric matrix protein
in adult pulp stem cells of permanent teeth were significantly lower than those of deciduous teeth and juvenile permanent teeth pulp stem cells(P<0.01).(6)Compared with adult dental pulp stem cells,human deciduous teeth and juvenile permanent teeth dental pulp stem cells have the stronger proliferative capacity and multidirectional differentiation potential,and are more suitable for clinical research and disease treatment.
Key words:platelet lysate;dental pulp;stem cell;differentiation;aging change
Funding:Key Research Plan Industrial Project of Huzhou,No.2020GG32(to XZG);Biomedical Special Project of Huzhou,No.2018ZD2018(to XZG)
How to cite this article:XUZG,WU YF,REN ZH,YANG XW,NIU YK,DONG ZL,DU W,YANG WL,XU X,ZHU Y,LIU LF,LIU C.Effects of aging factors on biological characteristics of dental stem cells.Zhongguo Zuzhi Gongcheng Yanjiu.2024;28(19):2996-3002.
0引言Introduction
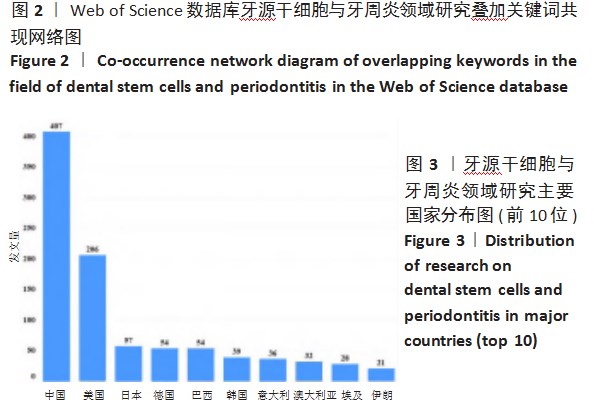
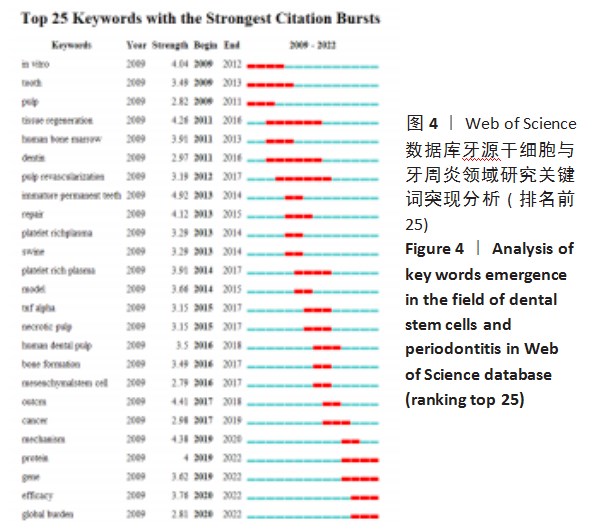
近年来间充质干细胞在中枢神经系统疾病、免疫系统疾病、消化系统疾病及包括新冠肺炎在内的呼吸系统疾病等多类疾病的临床研究中都显示出良好的安全性与有效性,为许多传统治疗方式疗效有限的疾病提供了全新的治疗手段[1-4]。牙髓干细胞存在于牙髓组织中,具有高度增殖能力和多向分化潜能,目前在自体生物牙根再生、骨损伤修复及神经修复等方面扩展应用,是极具潜力的组织工程学细胞[5-6]。基于Citespace和Vosviewer软件追溯牙源干细胞与牙周疾病的相关文献进行聚类分析,探讨其研究现状及热点,见图1-4。通过分析发现牙源干细胞与治疗牙周炎关系密切,见图2。国家药品监督管理总局药品评审中心网站显示可用于治疗牙周炎的人牙髓间充质干细胞注射液是最早获批进入临床研究的干细胞药物之一,已成为新药研究热点,并且中国在牙源干细胞与牙周炎领域显示出强劲势头,位居全球前列,见图3。关键词突现研究分析显示牙源干细胞已从最初的体外研究、组织再生等过渡到基因测序、疗效、全球疾病负担等相关领域,见图4。通过以上分析探讨牙源干细胞的研究热点、前沿及临床研究策略,启迪牙源干细胞今后的研究方向。
目前的相关临床研究与成果转化,大都选择乳牙来源干细胞,而少年与成年恒牙来源干细胞和与乳牙干细胞对比研究较少。文章以此为起点,探讨三者生物学特性的差异,为扩展适合成果转化的牙源干细胞来源提供有力的数据支撑。研究表明干细胞的组织结构和供能均可能随着个体年龄递增而发生明显变化[7-9]。因此,研究乳牙和不同年龄阶段恒牙间充质干细胞增殖与分化潜能的变化,对其临床转化有至关重要的意义。该研究综合比较分析了乳牙、少年恒牙和成年恒牙牙髓干细胞的生物学特性、分化能力及EP300基因表达情况,为细胞药物制备工艺、质量标准和干细胞临床转化提供依据。
1材料和方法Materials and methods
1.1设计体外细胞实验,实验数据采用方差分析与t检验。
1.2时间及地点实验于2021年1月至2022年9月在协和华东干细胞基因工程有限公司实验室完成。
1.3材料DMEM/F-12培养基(美国Gibco公司);胎牛血清(新西兰ExCell Bio公司);MSCgoTM chondrogenic成软骨诱导分化培养基、MSCgoTM Adipogenic成脂诱导分化培养基、MSCgoTM Osteogenic成骨诱导分化培养基(以色列Biological Industries公司);CCK-8试剂盒(美国Biomedical Technology公司);TRIzol(美国Introvigen公司);Prime-ScriptTM RT Master Mix反转录试剂盒(日本Takara公司);实时荧光定量PCR(qRT-PCR)试剂盒(美国BIO-RAD公司);超净台(BCM-1300A,苏净安泰);三气细胞培养箱(Forma4131,美国Thermo公司);酶标仪(FREEDOM EVOLYZER-2,瑞士TECAN公司);全自动血液分析仪(XP-100,日本SYSMEX公司);倒置显微镜(CKX41SF,日本OLYMPUS公司)。
1.4实验方法
1.4.1人血小板裂解液的制备与乳牙、恒牙样本的收集采集10份年龄在22-32周岁、身体健康无病史产妇捐献的公共脐血。产妇血型相同,均为A型、RH阳性血,采集前均进行免疫4项(HBV、HCV、HIV、梅毒标志物)检测且结果为阴性,血常规检测血小板含量正常[(100-300)×109 L-1],所有捐献者均签署知情同意书。每份脐血20 mL,平均放入4个5 mL无抗凝剂玻璃管中,立即在离心机中2 700 r/min离心12 min,血样分成3层,上层为血浆层,中间层为富血小板纤维蛋白,下层为红细胞层。无菌条件下弃去下层红细胞,保留上层和中间层,经3 000 r/min离心10 min将血小板与胶原蛋白网分离,上清液在-80℃与37℃下反复冻融3次(冻24 h/次)后过0.22μm滤器过滤除菌,去除细胞碎片,得到人血小板裂解液。将多人份的人血小板裂解液混合后使用,避免个体间差异对实验结果造成影响。
收集浙江省湖州市第一人民医院口腔颌面外科2019年1月至2020年4月因正常脱落、正畸或阻生而拔除的健康、完整、无龋坏的儿童乳牙共20颗、少年(<18周岁)恒牙10颗以及成年(≥18周岁)恒牙10颗,所有供者健康、无系统性疾病和病史,均进行免疫4项(HBV、HCV、HIV、梅毒标志物)检测且结果为阴性,且供者及其监护人均签署知情同意书。
该研究的实施符合湖州市第一人民医院的相关伦理要求。
1.4.2牙髓干细胞分离、培养及传代牙齿样本收集后于6 h内送往实验室,在超净台无菌条件下对牙齿表面进行清洁消毒,用医用骨科钳将牙冠与牙根分开,取出牙髓腔内的牙髓,用手术剪将牙髓组织剪碎,采用植块法移入Corning T25细胞培养瓶中,置于37.5℃、体积分数为5%CO2的细胞培养箱中5-10 min,待组织块贴壁后,分别加入含5%,10%,15%人血小板裂解液或体积分数为10%胎牛血清的DMEM/F-12培养基进行原代细胞培养,待细胞增殖到铺满培养瓶底部面积75%-85%进行传代,继续培养。
1.4.3显微镜下观察细胞形态倒置显微镜下观察乳牙、少年恒牙及成年恒牙来源原代、第3代及第7代牙髓干细胞生长状况。
1.4.4流式细胞术检测细胞表面抗原表达选取第3代处于对数生长期的细胞,制备细胞悬液,细胞浓度约为1×109 L-1,装入EP管中,分别加入0.2 mg/mL的CD13、CD19、CD29、CD34、CD44、CD45、CD73、CD90、CD105、HLA-DR对应的同型抗体,4℃避光孵育30 min,1 350 r/min离心5 min,去上清液,PBS重悬,过滤,上流式细胞仪测定分析。
1.4.5确定最佳培养条件第3代乳牙、少年恒牙及成年恒牙牙髓干细胞分别在含5%,10%,15%人血小板裂解液或体积分数10%胎牛血清的DMEM/F-12培养基中培养3 d,采用细胞计数法检测4组细胞增殖情况,绘制生长曲线,选取最佳人血小板裂解液浓度进行后续实验。
1.4.6细胞增殖检测
(1)细胞计数法:取对数生长期的第3代乳牙、少年恒牙及成年恒牙牙髓干细胞,以1×107 L-1细胞浓度接种于T25培养瓶(21瓶),每瓶5 mL,置于体积分数5%CO2、37℃细胞培养箱培养,每隔24 h取3瓶细胞,胰酶消化计数细胞,计算均值,连续计数7 d。
(2)CCK-8法:取对数生长期的第3代乳牙、少年恒牙及成年恒牙牙髓干细胞,以1×107 L-1细胞浓度接种于96孔板(100μL/孔),置于体积分数5%CO2、37℃细胞培养箱培养,每隔24 h取3孔细胞,加入CCK-8溶液(10μL/孔),在培养箱内孵育2 h后,用酶标仪测定450 nm处的吸光度值,计算均值,连续测定7 d。
1.4.7细胞体外成骨、成脂、成软骨诱导分化能力检测选取生长良好的第3代乳牙、少年恒牙与成年恒牙牙髓干细胞,制备成浓度为5×107 L-1细胞悬液,接种于24孔板中,每孔1 mL,待细胞贴壁后进行成骨、成脂诱导分化;对照组使用含10%人血小板裂解液的DMEM/F-12培养基培养。诱导第14天进行油红O染色(成脂分化),第21天进行茜素红染色(成骨分化)。
将10%壳聚糖醋酸溶液(壳聚糖和乙酸为美国Sigma公司产品)加入到pH值为7.7且含有7%poloxamer188(美国Sigma公司)的黄原胶(美国Sigma公司)水溶液中,机械搅拌、烘干消毒后制成支架。将无菌支架放置于24孔板中,加入成软骨培养液使之充满支架内部空隙;使用注射器将制备好的第3代乳牙、少年恒牙与成年恒牙牙髓干细胞悬液分别注入不同孔的支架内部,确保细胞充满整个支架内部孔隙;放入孵箱内孵育2 h后将2 mL成软骨培养液加入24孔板内防止细胞分离;对照组使用含10%人血小板裂解液的DMEM/F-12培养基培养。诱导培养第21天进行阿尔新蓝(Alcian blue)染色。
1.4.8 RT-PCR检测EP300和成骨、成脂、成软骨相关基因的表达第3代各组牙髓干细胞成骨诱导21 d/成脂诱导17 d后,弃去诱导液,PBS冲洗孔板,每孔中加入1 mL Trizol,反复用移液枪吹打以裂解细胞;第3代各组牙髓干细胞成软骨诱导21 d后,取出干细胞微球用PBS冲洗后放入含有液氮的无菌研钵内,充分研磨至微球碾碎成粉末,收集微球粉末,转移入1.5 mL无酶EP管内,加入1 mL Trizol试剂,吹打混匀。将上述裂解液分别加入0.2 mL氯仿,振荡15 s,12 000×g离心后收取上清液,加入0.5 mL异丙醇混匀,静置10 min后12 000×g离心,弃上清,加入体积分数75%乙醇洗涤,7 500×g离心弃上清,自然干燥,用50μL Rnase-free水收集RNA。提取各组细胞总RNA,所得的RNA样本经分光光度计检测,A260/A280比值在1.9-2.0之间。cDNA合成按反转录试剂盒操作说明,反应体系为20μL,取1μL的RNA于42℃50 min,85℃5 min PCR仪中反应。短暂离心,置于冰上冷却。
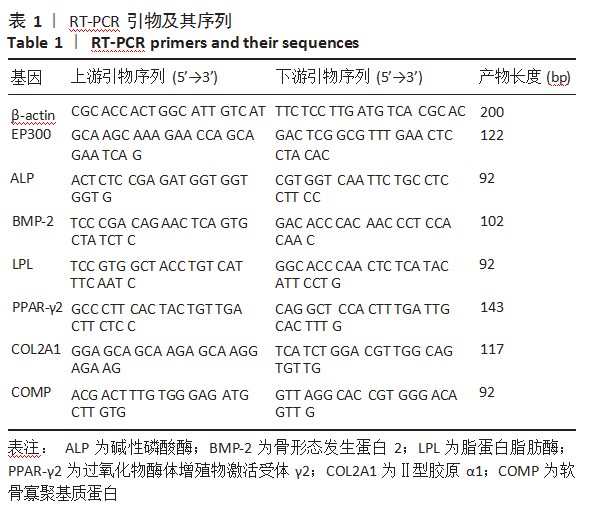
以β-actin为内参,根据PCR检测试剂盒配制反应液,总体积为20μL,选用三步法PCR扩增程序:预变性95℃1 min,变性95℃15 s,退火60℃15 s,延伸72℃45 s,40个循环。每个标本重复3次,所得Ct值代入公式2-ΔΔCt计算各组EP300、碱性磷酸酶(alkaline phosphatase,ALP)、骨形态发生蛋白2(bonemorphogenetic protein-2,BMP-2)、脂蛋白脂肪酶(lipoprotein lipase,LPL)、过氧化物酶体增殖物激活受体γ2(peroxisome proliferator activated receptorγ2,PPAR-γ2)、Ⅱ型胶原α1(collagen type II alpha 1,COL2A1)及软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)mRNA表达水平。各引物序列见表1。
1.5主要观察指标①不同浓度血小板裂解液对牙髓干细胞增殖水平的影响;②各组牙髓干细胞形态;③各组牙髓干细胞表型与增殖能力;④各组牙髓干细胞三系分化能力及分化相关基因的表达。
1.6统计学分析采用GraphPad Prism 5软件进行数据分析,实验数据均以±s表示,多组间比较采用方差分析(ANOVA),两组之间比较采用t检验,P<0.05为差异有显著性意义。文章统计学方法经过湖州学院生物统计学专家审核。
2结果Results
2.1血小板裂解液培养结果从脐血分离出的血小板裂解液中主要含有血小板源性生长因子[(29.03±7.00)pg/mL]、转化生长因子β[(2.39±0.19)ng/mL]、类胰岛素生长因子1[(422.87±20.55)pg/mL]、成纤维细胞生长因子b[(96.99±3.64)pg/mL]等细胞因子。
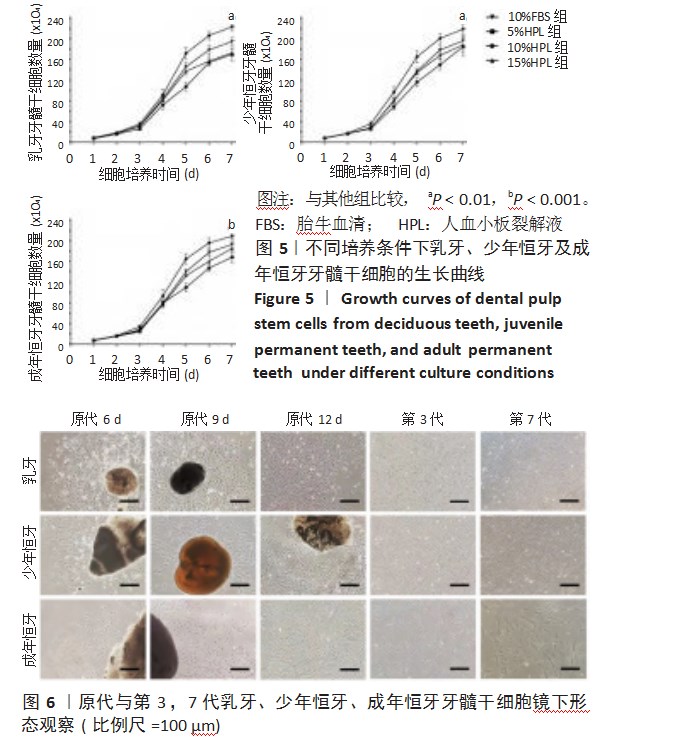
第3代乳牙、少年恒牙及成年恒牙牙髓干细胞在培养基中添加10%人血小板裂解液的条件下,第7天细胞增殖数显著大于5%人血小板裂解液组、15%人血小板裂解液组及体积分数为10%胎牛血清组(P<0.01,P<0.01,P<0.001),见图5。以下实验所用细胞均用含10%人血小板裂解液的DMEM/F-12培养基培养。
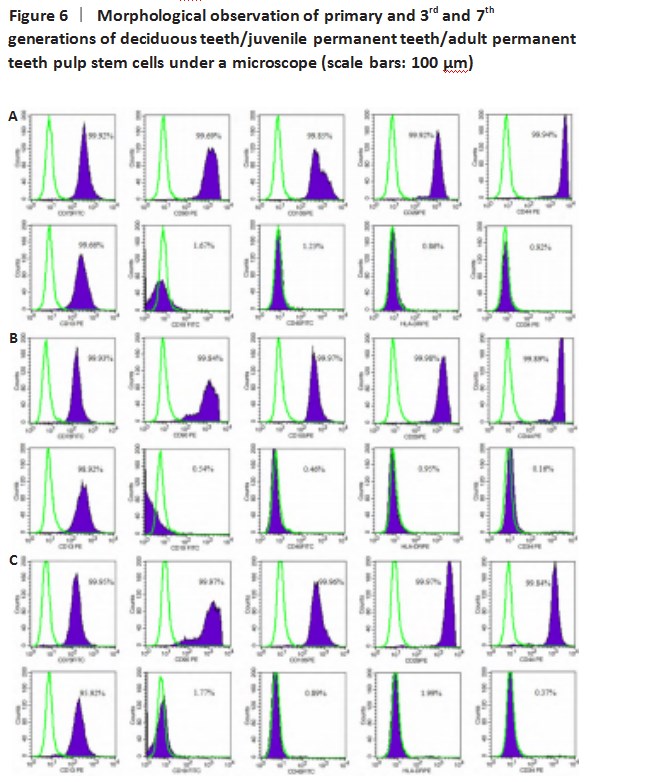
2.2细胞生长情况及镜下形态接种培养4-6 d后,各组牙髓组织块周围均出现贴壁细胞,细胞形态呈规则长梭形,成纤维细胞样,9-12 d后形成明显细胞晕,呈漩涡状排列。第3代与第7代乳牙、少年恒牙牙髓干细胞形态无明显差异。第3代成年恒牙牙髓干细胞与同代次乳牙与少年恒牙牙髓干细胞相比,细胞体积偏大,第7代成年恒牙细胞体积更大,贴壁形态呈多边形,见图6。
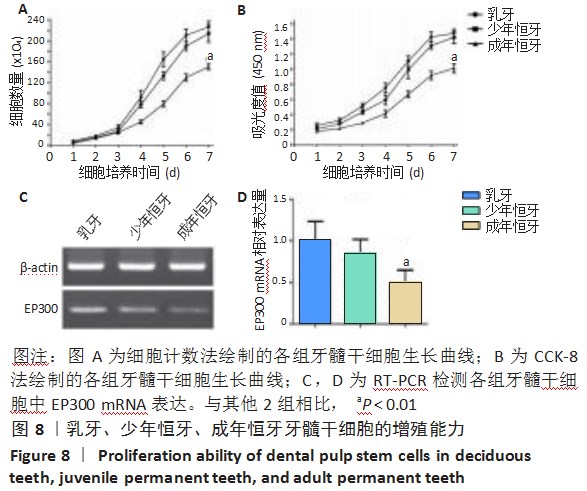
2.3流式细胞仪检测结果流式细胞仪检测第3代人乳牙、少年恒牙、成年恒牙的牙髓干细胞表面标记物,所培养细胞阳性表达特异性表面抗原CD13、CD29、CD44、CD73、CD90、CD105;阴性表达CD19、CD34、CD45、HLA-DR,结果表明培养的细胞为间充质来源,见图7A-C。
2.4细胞增殖检测结果细胞计数法与CCK-8法检测各组第3代牙髓干细胞生长曲线均呈S型,见图8A,B,各组细胞均在第3天开始快速增殖,第6天时生长速度放缓,第7天达到平台期。第7天收获细胞数与第7天吸光度值:乳牙与少年恒牙牙髓干细胞相比均无统计学差异(P>0.05),而成年恒牙与乳牙、少年恒牙牙髓干细胞相比均有统计学差异(P<0.01)。RT-PCR检测各组第3代牙髓干细胞中EP300 mRNA表达,其中成年恒牙与乳牙、少年恒牙牙髓干细胞相比显著降低(P<0.01),而乳牙与少年恒牙牙髓干细胞相比无统计学差异,见图8C,D。
2.5三系分化诱导结果
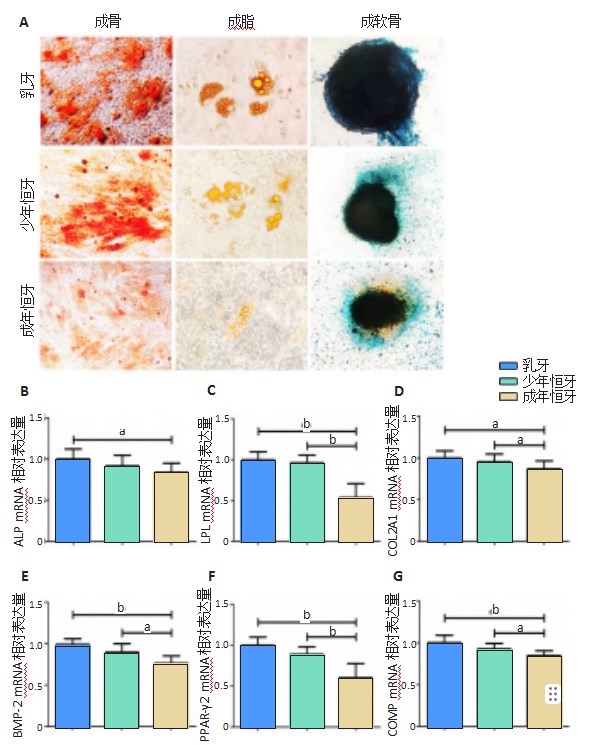
2.5.1成骨诱导连续3周体外成骨诱导后,茜素红染色可见乳牙与少年恒牙组形成的红色矿化结节比成年恒牙组更为明显,见图9A。荧光定量PCR检测成骨相关基因ALP,BMP-2 mRNA表达,可见少年恒牙与乳牙牙髓干细胞相比无统计学差异,而成年恒牙与乳牙、少年恒牙牙髓干细胞相比有统计学差异,见图9B,E。
2.5.2成脂诱导连续2周体外成脂诱导后,油红O染色可见各组均有脂滴样物质,但总体分布不多。乳牙与少年恒牙组脂滴数量相仿,成年恒牙组脂滴数量较少,见图9A。荧光定量PCR检测成脂相关基因LPL,PPAR-γ2 mRNA表达,可见少年恒牙与乳牙牙髓干细胞相比无统计学差异,而成年恒牙与乳牙、少年恒牙牙髓干细胞相比有统计学差异,见图9C,F。
2.5.3成软骨诱导连续3周体外成软骨诱导后,均能形成软骨微球,阿尔新蓝染色显示微球细胞分泌酸性黏多糖类蛋白聚糖,呈现深蓝色。成年恒牙组染色程度与乳牙与少年恒牙组相比较弱。荧光定量PCR检测成软骨相关基因COL2A1,COMP mRNA表达,可见少年恒牙与乳牙牙髓干细胞相比无统计学差异,而成年恒牙与乳牙、少年恒牙牙髓干细胞相比有统计学差异,见图9D,G。
3讨论Discussion
目前大多数干细胞体外培养采用胎牛血清,但血清动物源性污染、免疫排斥等问题,极大地限制了干细胞临床应用转化。血小板裂解液作为可能的胎牛血清替代物而受到广泛的关注[10]。该研究中,10%人血小板裂解液对于第3代牙髓干细胞的增殖水平不仅显著优于5%人血小板裂解液和15%人血小板裂解液,还优于体积分数10%胎牛血清。这表明人血小板裂解液对牙髓干细胞增殖能力的影响有着一定的剂量依赖性,当人血小板裂解液浓度达到10%时,这种剂量依赖达到饱和,且实验中应用10%人血小板裂解液培养的乳牙与少年恒牙牙髓干细胞的细胞形态、增殖能力、免疫表型及三系分化等生物性特性均为正常,表明人血小板裂解液作为胎牛血清有效替代的可行性得到了验证。
机体损伤组织的结构和功能修复一直是世界性难题,干细胞再生医学与组织工程技术的进展为这类疾病的研究与治疗带来新的希望,以牙源干细胞为代表的成体干细胞在组织修复、炎症调控等方面具有重要的潜在价值,日益受到研究者的广泛关注[11-14]。在组织修复方面,人牙源间充质干细胞有许多优势,其来源于胚胎时期的神经嵴细胞[15-16],神经嵴间充质来源干细胞在牙胚形成阶段分化为牙乳头干细胞和牙囊干细胞,在不同微环境下形成牙髓、牙本质及牙周组织[17-19]。人牙源间充质干细胞具有趋化、迁移及归巢功能,有助于组织修复、再生和免疫调控;在炎症调控方面,其分泌的产物(白细胞介素2、γ干扰素、外泌体)作为信号传递给相应的靶细胞,进行细胞间的信息传递和功能调节[20-23];降低可诱导组织损伤和炎症的促炎递质,如白细胞介素1β和肿瘤坏死因子α的分泌水平,通过以上多种方式维持机体稳态[24-27]。
干细胞在体外长期扩增可能会发生表观遗传和遗传改变,从而导致细胞衰老和相关的生长抑制,然而对这种介导间充质干细胞衰老过程的表观遗传知之甚少。越来越多的证据表明,牙髓干细胞随着增龄性变化和代次的提高,其多项生物学特性的变化与调控间充质干细胞衰老的基因表达相关[28-29]。有研究表明,相比老年人骨髓间充质干细胞,年轻人骨髓间充质干细胞在体外培养过程中具有更好的细胞倍增能力[30]。该研究也发现与乳牙和少年恒牙牙髓干细胞相比,成年恒牙牙髓干细胞的细胞活性与增殖能力显著降低,而少年恒牙与乳牙牙髓干细胞仍然保持着较高的增殖活性。相同结果还体现在细胞代次的更迭上,该实验中同为第7代细胞,成年恒牙牙髓干细胞形态明显变大,呈扁平状,相同单位面积内细胞数量明显减少,这可能与端粒缩短所致体细胞的有限增殖有关,成年恒牙在培养过程中提前出现“传代衰老”的现象。研究者发现,一种在衰老细胞高度表达的代谢酶——β-半乳糖苷酶染色阳性的人间充质干细胞,其成脂和成骨分化潜能显著下降[31]。在该实验的三系分化过程中,类似的年龄相关减退效应也体现在染色水平以及相关基因表达上的显著差异。
适合于临床的干细胞活性与细胞质量需要较高的要求,才能满足其对组织与器官有效的修复。有研究发现,脂肪间充质干细胞在体外培养过程中受供者年龄的影响,供者年龄越大,培养时间越长,衰老细胞就越多,越不适用于临床应用[32]。该研究中,各组牙髓干细胞中调控细胞衰老和抑制生长的EP300基因载量有显著变化。有研究表明,EP300表达下降会通过刺激p53/p21信号通路促进干细胞的衰老进程[33-35]。这些发现可能为牙髓干细胞制备工艺标准及关键点的把控提供数据支撑,为临床转化的细胞质量标准提供一种优化策略。
综上所述,选择合适浓度的人血小板裂解液培养牙髓干细胞替代胎牛血清成为一种新的路径。研究牙髓干细胞体外培养的增龄性变化与内在机制,对于其临床应用具有重要的价值与意义。乳牙与少年恒牙来源牙髓干细胞作为存在于组织中的成体干细胞,具有易于获得、增殖能力强、多代次培养仍保持良好活性等优点,在牙齿、骨骼及牙周组织的再生医学与组织工程中的应用具有非常广阔的前景。
4参考文献References
[1]LARONI A,NOVI G,KERLERO DE ROSBO N,et al.Towards clinical application of mesenchymal stem cells for treatment of neurological diseases of the
central nervous system.J Neuroimmune Pharmacol.2013;8(5):1062-1076.
[2]ZHENG Q,ZHANG S,GUO WZ,et al.The Unique Immunomodulatory Properties of MSC-Derived Exosomes in Organ Transplantation.Front Immunol.2021;12:659621.
[3]XU SJ,YE LP,WANG W,et al.Role of the Microenvironment in Mesenchymal Stem Cell-Based Strategies for Treating Human Liver Diseases.Stem Cells Int.2021;2021:5513309.
[4]TUFAN AC.Mesenchymal Stem Cells as a Treatment Strategy for Coronavirus Disease 2019(COVID-19):Need for Authority Regulations and Clinical Guidelines.Curr Stem Cell Res Ther.2021;16(4):465-480.
[5]TANIKAWA DYS,PINHEIRO CCG,ALMEIDA MCA,et al.Deciduous Dental Pulp Stem Cells for Maxillary Alveolar Reconstruction in Cleft Lip and Palate Patients.Stem Cells Int.2020;2020:6234167.
[6]YOUNG F,SLOAN A,SONG B.Dental pulp stem cells and their potential roles in central nervous system regeneration and repair.J Neurosci Res.2013;91(11):1383-1393.
[7]CHEN D,KERR C.The Epigenetics of Stem Cell Aging Comes of Age.Trends Cell Biol.2019;29(7):563-568.
[8]SPEHAR K,PAN A,BEERMAN I.Restoring aged stem cell functionality:Current progress and future directions.Stem Cells.2020;38(9):1060-1077.
[9]REVUELTA M,MATHEU A.Autophagy in stem cell aging.Aging Cell.2017;16(5):912-915.
[10]MOHAMED HE,ASKER ME,KOTB NS,et al.Human platelet lysate efficiency,stability,and optimal heparin concentration required in culture of mammalian cells.Blood Res.2020;55(1):35-43.
[11]陈彦,杨雪婷,马悦,等.基于外泌体的牙髓再生策略[J].中华口腔医学杂志,2021,56(7):709-714.
[12]FERNANDES TL,CORTEZ DE SANTANNA JP,FRISENE I,et al.Systematic Review of Human Dental Pulp Stem Cells for Cartilage Regeneration.Tissue Eng Part B Rev.2020;26(1):1-12.
[13]YOSHIMARU K,YAMAZA T,KAJIOKA S,et al.Dental pulp stem cells as a therapy for congenital entero-neuropathy.Sci Rep.2022;12(1):6990.
[14]KOK ZY,ALAIDAROOS NYA,ALRAIES A,et al.Dental Pulp Stem Cell Heterogeneity:Finding Superior Quality“Needles”in a Dental Pulpal“Haystack”for Regenerative Medicine-Based Applications.Stem Cells Int.2022;2022:9127074.
[15]GAZARIAN KG,RAMÍREZ-GARCÍA LR.Human Deciduous Teeth Stem Cells(SHED)Display Neural Crest Signature Characters.PLoS One.2017;12(1):e0170321.
[16]TAKAOKA S,UCHIDA F,ISHIKAWA H,et al.Transplanted neural lineage cells derived from dental pulp stem cells promote peripheral nerve regeneration.Hum Cell.2022;35(2):462-471.
[17]刁树,杨东梅,范志朋.牙组织源性干细胞的微环境[J].中华口腔医学杂志,2014,49(4):254-256.
[18]WANG LH,GAO SZ,BAI XL,et al.An Up-To-Date Overview of Dental Tissue Regeneration Using Dental Origin Mesenchymal Stem Cells:Challenges and Road Ahead.Front Bioeng Biotechnol.2022;10:855396.
[19]LI B,OUCHI T,CAO Y,et al.Dental-Derived Mesenchymal Stem Cells:State of the Art.Front Cell Dev Biol.2021;9:654559.
[20]CHAN YH,LEE YC,HUNG CY,et al.Three-dimensional Spheroid Culture Enhances Multipotent Differentiation and Stemness Capacities of Human Dental Pulp-derived Mesenchymal Stem Cells by Modulating MAPK and NF-kB Signaling Pathways.Stem Cell Rev Rep.2021;17(5):1810-1826.
[21]LOTT K,COLLIER P,RINGOR M,et al.Administration of Epidermal Growth Factor(EGF)and Basic Fibroblast Growth Factor(bFGF)to Induce Neural Differentiation of Dental Pulp Stem Cells(DPSC)Isolates.Biomedicines.2023;11(2):255.
[22]RAJEWSKA J,KOWALSKI J,MATYS J,et al.The Use of Lactide Polymers in Bone Tissue Regeneration in Dentistry-A Systematic Review.J Funct Biomater.2023;14(2):83.
[23]ISMAIL E,MABROUK M,SALEM ZA,et al.Evaluation of innovative polyvinyl alcohol/alginate/green palladium nanoparticles composite scaffolds:Effect on differentiated human dental pulp stem cells into osteoblasts.J Mech Behav Biomed Mater.2023;140:105700.
[24]NAKAO Y,FUKUDA T,ZHANG Q,et al.Exosomes from TNF-α-treated human gingiva-derived MSCs enhance M2 macrophage polarization and inhibit periodontal bone loss.Acta Biomater.2021;122:306-324.
[25]IRFAN M,CHUNG S.C5L2 modulates BDNF production in human dental pulp stem cells via p38αpathway.Sci Rep.2023;13(1):74.
[26]KEARNEY M,DUNCAN HF.Micro-RNA Profiling in Dental Pulp Cell Cultures.Methods Mol Biol.2023;2588:353-367.
[27]GOPINATH VK,MOHAMMAD MG,SHEELA S.Immunomodulatory effect of IL-1RA in LPS-activated macrophage/dental pulp stem cells co-culture.Int Endod J.2023;56(1):27-38.
[28]ÖZGÜLÖZDEMIR RB,ÖZDEMIR AT,KIRMAZ C,et al.Age-related changes in the immunomodulatory effects of human dental pulp derived mesenchymal stem cells on the CD4+T cell subsets.Cytokine.2021;138:155367.
[29]MAEDA H.Aging and Senescence of Dental Pulp and Hard Tissues of the Tooth.Front Cell Dev Biol.2020;8:605996.
[30]WANG Z,LIN Y,JIN S,et al.Bone marrow mesenchymal stem cells improve thymus and spleen function of aging rats through affecting P21/PCNA and suppressing oxidative stress.Aging(Albany NY).2020;12(12):11386-11397.
[31]AL-DALAHMAH O,NICHOLSON J,DRAIJER S,et al.Galectin-3 diminishes Wnt signaling in the postnatal subventricular zone.Stem Cells.2020;38(9):1149-1158.
[32]CHANG YM,SHIBU MA,CHEN CS,et al.Adipose derived mesenchymal stem cells along with Alpinia oxyphylla extract alleviate mitochondria-mediated cardiac apoptosis in aging models and cardiac function in aging rats.J Ethnopharmacol.2021;264:113297.
[33]LI Y,ZHONG H,WU M,et al.Decline of p300 contributes to cell senescence and growth inhibition of hUC-MSCs through p53/p21 signaling pathway.Biochem Biophys Res Commun.2019;515(1):24-30.
[34]HETTLER F,SCHRECK C,MARQUEZ SR,et al.Osteoprogenitor SFRP1 prevents exhaustion of hematopoietic stem cells via PP2A-PR72/130-mediated regulation of p300.Haematologica.2023;108(2):490-501.
[35]MUTHUKRISHNAN SD,KAWAGUCHI R,NAIR P,et al.P300 promotes tumor recurrence by regulating radiation-induced conversion of glioma stem cells to vascular-like cells.Nat Commun.2022;13(1):6202.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/72558.html