SCI论文(www.lunwensci.com)
摘要:文章详细分析了2021年AP化学试卷的自由作答部分试题,并总结了试题特点.
关键词:AP考试,试题分析,化学试题
AP化学课程是美国大学理事会开设的37门课程中的重要课程,其课程难度和考试优分率(>4分)属于中等,2020年受疫情影响,AP首次采用全球网考的模式,考试形式、时长、题型和评价体系都有所调整,学生普遍不太适应.2021年恢复传统纸考,本文以美国大学理事会(The College Board)在其官网上发布的相关资料为依据,详细分析了2021年AP化学试卷第二部分(选择题未公开)的试题并总结了试题特点.
例1甲酸(HCOOH)电离的方程式如下:HCOOH(aq)+H2 O(l)—H3 O+(aq)+HCOO-(aq)Ka=1.8×10-4
(1)写出该反应的电离平衡常数表达式;
(2)计算0.25mol/L甲酸溶液的pH;
(3)在图1中画出HCOOH的路易斯电子式,标出所有成键和未成键价电子.(4)化合物肼(H2 NNH2)在水溶液中反应离子方程式如下:
H2 NNH2(aq)+H2 O(l)—H2 NNH3+(aq)+OH-(aq)Kb=1.3×10-6将0.25mol/L 50.0mL H2 NNH2(aq)与0.25mol/L 50.0mL HCOOH(aq)混合.
(1)写出上述反应的离子方程式;
(2)反应完成后溶液是酸性、碱性还是中性?证明你的结论.
(3)若在甲酸溶液中加入某种催化剂,发生如下反应:HCOOH(aq)—→H2(g)+CO2(g),该反应是氧化还原反应吗?证明你的结论;
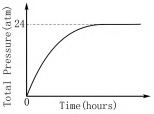
(4)25℃时,该反应在一个体积为4.3L的刚性容器中进行,容器的总压变化如图2所示.该容器原来不含任何气体,计算反应中生成CO2的物质的量.(溶解在溶液中的CO2(g)忽略不计)
(5)待反应进行几分钟后,催化剂的数量是增加、减少还是保持不变?证明你的结论.
分析本题以两种弱电解质(甲酸和肼)为研究点,考察了弱酸的电离(电离平衡常数表达式书写、pH计算)、酸碱反应(离子方程式的书写、反应后盐溶液的酸碱性)、电子式书写、氧化还原反应判断、理想气体状态方程和催化剂的性质等知识点.总体难度不高,知识点考察属于核心内容,第一题给学生有一个心理适应过程.
例2根据元素硅(Si)及其相关化合物回答下列问题:
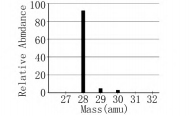
(1)纯硅样品的质谱图如图3所示.丰度最大的一种硅原子的原子核中的质子数和中子数分别是多少?写出基态硅原子的电子排布式.
(2)SiO2和SiH4是Si的两种化合物.在161K温度下,SiH4是气体而SiO2是固体,根据粒子键作用力理论解释这两者的沸点差异.在高温条件下,SiH4分解生成固体硅和氢气.
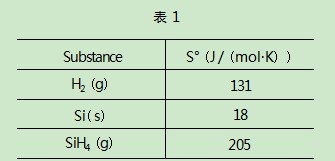
(3)写出上述反应的化学方程式.一些物质的标准熵数据见表1.
(4)单质硅比氢气的标准摩尔熵小,解释原因.
(5)计算上述分解反应的熵变(ΔS°).
(6)任何温度下,该反应在热力学上都能自发进行.解释为什么它只在高温下才发生?
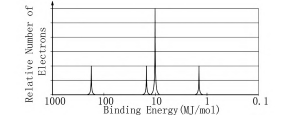
(7)图4是纯硅的部分光电子能谱图,在图中画出缺失的表征3p能级上电子的波峰.
(8)根据原子结构相关理论,解释Ge的第一电离能比Si低的原因.
(9)Si样品吸收一个波长为4.00×10-7m的光子,计算这个光子的能量.(单位为J)
分析本题考查知识点丰富,素材呈现多样化,有图表(质谱和光电子能谱)和数据(标准熵),涉及原子的结构与性质、分子的结构与性质、化学方程式的书写、熵的大小比较解释、熵变的计算、反应的自发性分析和光子能量计算等知识点.题目整合了学习大纲中的1、3、4、9等单元,融合性增强,要求学生能在短时间内对图标进行观察、分析、思考或猜想,提取有效信息进行加工,这种方式要求学生具备很强的综合解题能力和对知识本身的深刻理解,也是学生化学学科素养的体现.
例3某学生的任务是测定某CuSO4溶液的物质的量浓度,他要用沉淀法和光谱法这两种不同的方法测定.在沉淀法试验中,该学生向50.0 mL CuSO4溶液中加入0.200 mol/L 20.0 mL Ba(NO3)2溶液,反应发生后生成白色沉淀,沉淀经过滤、隔夜干燥后称量,相关数据干燥滤纸的质量:0.764 g;CuSO4溶液体积:50.0 mL;Ba(NO3)2溶液体积:20.0 mL;滤纸和干燥后沉淀的质量:1.136 g.
(1)写出沉淀反应的化学方程式;
(2)计算生成沉淀的物质的量;
(3)计算原来CuSO4溶液的物质的量浓度.在光谱实验中,该学生首先要绘制标准曲线.他用01000mol/LCuSO4溶液配制了3种不同浓度(分别为0.0500mol/L、0.0300mol/L、0.0100mol/L)体积为50.00mL的稀溶液.
(4)要配制0.0500 mol/L 50.00 mL CuSO4溶液,需要0.1000 mol/L CuSO4溶液的体积是多少?
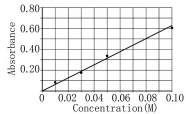
(5)在确保实验安全的情况下,简要叙述配制上述溶液的过程,实验用品如50.00mL容量瓶等均可提供.标准曲线如图5所示.
(6)某未知浓度CuSO4溶液的吸光度是0.219,计算该溶液的物质的量浓度.
(7)另一个学生也做了同样的实验,在导入未知溶液前,比色皿中有几滴水.这样测出来未知浓度的数据与(6)中的数据相比是偏大、偏小还是相同?证明你的结论.
分析本题围绕测定某溶液的物质的量浓度实验主题分三部分编排,包括沉淀法测定浓度中方程式的书写和根据实验数据进行定量计算,光谱法中的标准溶液的配制步骤和定量计算,根据标准曲线图进行读图计算和实验误差的讨论.本题设计巧妙,将沉淀法和色谱法用在同一种问题解决中,综合考察了学生的实验数据分析、实验步骤叙述、实验数据计算和误差分析等能力.
例4某学生研究暖手宝的化学反应原理,相关反应方程式如下:
4Fe(s)+3O2(g)—→2Fe2 O3(s)rsn
ΔH°=-1650 kJ/mol
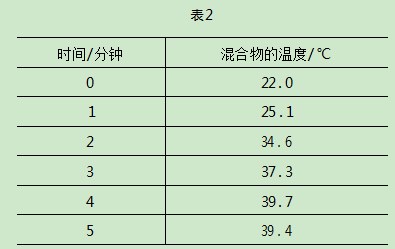
该学生将Fe粉、催化剂和沙子混合在一个敞口容器中,反应过程中该混合物的温度变化数据见表2.
(1)混合物的总质量为15.0g,比热容为0.72J/(g·℃),计算从0到4分钟内混合物吸收的热量.
(2)根据上述计算结果,计算参与反应的铁的质量.
(3)在第二次试验中,该学生用了相同质量的沙子,2倍质量的Fe,第二次实验能达到的最高温度与第一次相比是高、低还是相等?证明你的结论.
分析本题考察了热化学相关原理,以生活中常见的暖手宝的工作原理为材料,要求学生根据实验数据进行反应热相关计算,重点考察了热化学方程式的理解和q=Cm2 T公式的使用和分析.本题研究情境真实,问题设置有梯度和灵活性,引导学生化学现象的实质有深入思考.
参考文献:
[1]陈颖,王祖浩.美国AP化学试题能力考查的特点及其启示[J].基础教育课程,2009(08):66-69.
[2]张明亮,臧剑甬.美国AP化学课程和考试简介[J].化学教学,2002(04):13-15.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/70219.html