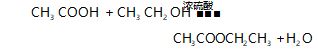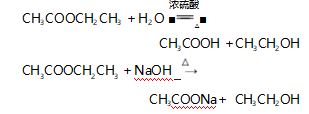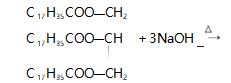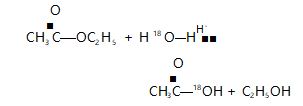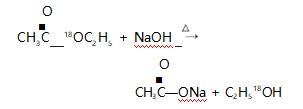SCI论文(www.lunwensci.com)
摘 要:部分高中教师根据酯化反应的一般原理及乙酸乙酯的水解反应是酯中的酰氧键断裂, 不加思考就提出所有酯的水解历程都是酯中的酰氧键断裂的结论;根据乙酸乙酯的酸性水解是酯 中的酰氧键断裂和水分子中的氢氧键断裂,经过机械的照搬就认为酯的碱性水解也是酯的酰氧键断裂和碱中的氢氧键断裂,本文针对以上教学失误,详细阐述了酯的水解历程,并提出了对酯的水 解和有机化学的教学启示.
1 研究背景
在苏教版高中有机化学教材中,酯化反应安排在 化学 2(必修)专题八第二单元第二课时“乙酸”课时,教材中设置了“基础实验”栏目,进行学生实验,指出 “乙酸乙酯是乙醇分子中的乙氧基(CH3 CH2 O -)取代 了乙酸分子中羧基上的羟基( -OH)的生成物,即乙酸分子和乙醇分子反应脱去一个水分子的产物”,同时也 指出化学方程式可表示为:
酸、醇的酯化反应机理与羧酸的和醇的结构有 关.已有实验表明:羧酸与一级、二级醇酯化反应,大 多符合“酸脱羟基醇脱氢”.羧酸与三级醇酯化反应脱去的水基本上是“ 酸脱羟基氢,醇脱羟基”( 已被 同位素示踪法证实).
酯化反应的一般机理还是可以表述为:通常状况下,酸脱羟基醇脱氢,其余部分结合成酯.在具体的教学过程中,一线教师为了便于学生记忆,也经常 忽略酯化反应的其它机理,直接进行如上的传授.
乙酸乙酯的水解反应则被安排在化学 2( 必修) 专题八第二单元第三课时“ 酯 油脂”,教材中提到, 乙酸乙酯在酸或碱的作用下与水发生水解反应,同 时给出了相应的化学方程式:
并在同一课时设置“ 实验探究”栏目,进行“ 油脂的水解”实验探究,并指出所发生的化学反应可 表示为:
硬脂酸甘油酯硬脂酸钠 甘油

人教版把酯的水解安排在有机化学基础 ( 选 修) 第三章第三节《 羧酸 酯》中,教材中提到,酯的 重要化学反应之一是可以发生水解反应,生成相应 的酸和醇,设置了“科学探究”栏目,要求学生设计 实验,探讨乙酸乙酯在中性、酸性和碱性溶液中的水 解速率.并在“ 资料卡片”中提出,乙酸乙酯的水解 反应是可逆反应,当在碱性条件下,碱与水解生成的 乙酸发生中和反应生成乙酸钠,减少了酸的浓度,平 衡就会向正反应方向移动.这样可使酯的水解趋于 完全,即在碱性条件的水解反应是不可逆的.鲁科版 把酯的水解安排在《 有机化学基础》( 选修) 第 2 章 第 4 节《 羧酸 氨基酸 蛋白质》中,教材中提到:“在 酸或碱催化的条件下,酯可以发生水解反应生成相 应的酸和醇.酯的水解反应是酯化反应的逆反应.酯 在碱性条件下的水解程度大于在酸性条件的水解程 度,其主要原因是在碱性条件下,酯水解产生的羧酸 可以与碱发生反应,使羧酸浓度减小,即减小了生成 物的浓度,化学平衡向正反应方向移动,使酯的水解 程度加大”.
部分教师根据酯化反应“ 酸脱羟基醇脱氢”的 机理以及乙酸乙酯水解属于酰氧键断键的反应历 程,提出所有的酯的水解都是酰氧键断裂的结论,很 显然存在科学性错误.另外部分教师根据乙酸乙酯 的酸性水解历程按如下方式进行:
即在酸性条件下水解,乙酸乙酯的酰氧键断裂, 水分子中的其中一个氢氧键断裂成氢原子和羟基, 其中羟基连接到羰基碳原子上形成羧酸,氢原子与 烷氧基上的氧原子相连形成醇.于是他们经过简单 类比,得出乙酸乙酯在碱性条件水解反应也是酯中的酰氧键断裂,氢氧化钠中氢氧键断裂:
这下学生困惑了,氢氧化钠是强电解质,它在水 溶液中完全电离出 OH - 和 Na+,应该是离子键断 裂,怎么变成了氢氧键断裂呢? 针对学生的疑问,部 分高中教师无法给出合理的解释,就开始回避酯的 碱性水解过程中的断键情况.
酯的水解历程到底是什么? 在课堂教学时教师 应该采取什么方式,如何把握教学的深度和广度,既 可以让学生能够理解和掌握酯的水解历程又不犯科 学性错误呢?
2 酯的水解历程
翻阅《有机化学》《 基础有机化学》教材进行查 证,发现酯的水解可能是酰氧键断裂,也可能是烷氧 键断裂;将含有同位素18 O 的酯水解证明反应是按 酰氧键断裂方式进行的.
酯的酸性水解同样用含同位素18 O 标记的水进 行水解获得的醇中不含有18 O,大量事实说明反应是 按酰氧键断裂进行的.
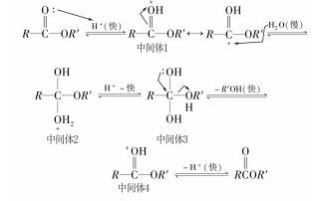
实际上大多数酯在酸性或碱性条件下水解都是 酰氧键断裂,这种酰氧键断裂是加成 -消除的结果, 而且是双分子反应.例如,酯的酸性水解历程如下:
酯的酸性水解历程显示,在酸性条件下,首先是 H + ( 亲电试剂) 加在羰基氧原子上,形成中间体 1. 经异构化得到碳正离子,水分子中的氧原子进攻该 碳正离子,形成中间体 2.中间体 2 经异构化后得到 中间体 3.由于中间体 3 中的羰基碳原子上还有一 个容易变成 R′OH 离去的分子,中间体 3 离去 R′OH 分子后剩下中间体 4.而中间体 4 不稳定,快速失去 一个 H + 形成羧酸.
酯的碱性水解历程如下:
酯的碱性水解历程显示,碱在水溶液中电离出 OH -,首先是 OH - ( 亲核试剂) 加在羰基碳原子上, 形成中间体,由于酯的羰基碳原子上还有一个容易 变成负离子离去的原子团,中间体容易失去烷氧基 离子( RO - ) 变成羧酸根( COO - ),生成的 COO - 有 较强的 p -π 共轭效应,是较烷氧基要弱得多的碱, 不可能攫取醇中的氢质子,因此得到的产物是羧酸 盐,从而使整个反应变为不可逆,也就使酯的碱性水 解可以进行到底.
前面讲到,酯的酸性和碱性水解大多数是按 加成 -消除的方式断裂酰氧键,由于 OH - 的亲核 能力比 H2 O 分子强,因此酯的碱性水解,是强碱 电离出的 OH -进攻羰基碳原子发生亲核反应,即 酯的碱性水解并不是部分高中教师所描述的是 “ 碱中的氢氧键断裂”,而是产生的羧酸与烷氧基 作用 生 成 羧 酸 盐,有 利 于 平 衡 向 正 反 应 方 向 移动.
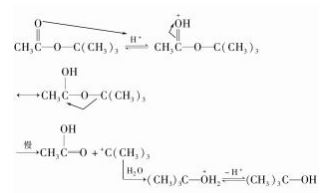
是否 所 有 的 酯 的 水 解 都 是 酰 氧 键 断 裂 呢? 很显然不是,在一些结构特殊的酯水解时也可以 烷氧键 断 裂,如 乙 酸 叔 丁 酯 在 酸 性 水 解 时 由于 ( CH3 ) 3 C + ( 碳正离子) 比较容易生成,所以是按 烷氧键断裂的反应历程进行的,乙酸叔丁酯酸性 水解的历程如下:
分析酯的水解历程可知,酯的水解历程大多数 是酰氧键断裂,且这种酰氧键断裂是加成 -消除的 结果,少数结构特殊的酯发生烷氧键断裂的反应历 程,酯的碱性水解是碱电离出的 OH -作为亲核试剂 直接进攻羰基碳原子发生亲核反应,水解产生的羧 酸与烷氧基作用生成羧酸盐,有利于平衡向正反应 方向移动.因此碱在酯的水解反应中既是催化剂,更 是反应试剂.
3 教学启示
部分教师根据酯化反应“ 酸脱羟基醇脱氢”的 机理以及乙酸乙酯水解属于酰氧键断键的反应历 程,提出所有酯的水解都是酰氧键断裂,机械地从 “ 酯的酰氧键断裂 、氢氧化钠中氢氧键断裂”的角 度去分析酯的碱性水解历程存在科学性错误,因 此,在高中 阶 段,教 师 在 进 行 酯 的 水 解 教 学 时 可 以这样进行讲授:“ 酯在酸性条件下发生 水 解 反 应生成相 应 的 羧 酸 和 醇,属 于 可 逆 反 应;酯 在 碱 性条件下发生水解反应先生成羧酸和烷氧基,由 于烷氧基的碱性很强,然后烷氧基攫取了羧酸中 的氢质子,因 此 得 到 的 产 物 是 羧 酸 盐 和 醇,从 而 使整个反应变为不可逆,也就是酯的碱性水解可 以进行到底.”
参考文献:
[ 1 ] 王祖浩.普通高中课程标准实验教科书.化学 2.( 必修) [ M ].南京:江苏教育出版社,2014.
[ 2 ] 唐增富.用乙醇传感器感受酯的水解[ J ].中学 化学教学参考,2020( 23 ):28 -30.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/jiaoyulunwen/65640.html