SCI论文(www.lunwensci.com):
摘要:目的探讨阿帕替尼联合常规化疗治疗非小细胞肺癌合并恶性胸腔积液患者的近期有效性和安全性。方法我院61例非小细胞肺癌合并恶性胸腔积液患者随机分为试验组(n=31)和对照组(n=30)。对照组使用常规化疗进行治疗,试验组在此基础每日服用阿帕替尼。结果治疗后两周,试验组和对照组的客观有效率分别为77.42%、53.33%,疾病控制率分别为96.77%、93.33%,两组患者客观有效率比较有统计学差异(P=0.048)。并且加用阿帕替尼并没有出现患者不耐受的情况。结论阿帕替尼能在一定程度上增强化疗对恶性胸腔积液的治疗效果。
关键词:阿帕替尼;非小细胞肺癌;恶性胸腔积液;顺铂
本文引用格式:苏州,罗文娟,税莲,等.阿帕替尼联合化疗对恶性胸腔积液治疗作用的临床研究[J].世界最新医学信息文摘,2019,19(96):9-11.
Clinical Effect of Apatinib Combined with Chemotherapy in Treatment of Malignant Pleural Effusion
SU Zhou,LUO Wen-juan,SHUI Lian,LIU Guang-guo,DENG Cheng-feng,SHU Pei
(Department of Oncology,Sichuan Mianyang 404 Hospital,Mianyang Sichuan)
ABSTRACT:Objective To investigate the efficacy and safety of apatinib combined with chemotherapy in treatment of malignant pleural effusion.Methods 61 patients were randomized as experimental group(n=31)and control group(n=30).The control group was given perfusion of cisplatin and intravenous drip of paclitaxel;the experimental group was treated with apatinib and chemotherapy.The clinical efficacy and safety in both groups were compared.Results The objective response rate was 77.42%in the experimental group,and it was 53.33%in the control group,with statistically significant differences observed(P=0.048).All patients tolerated the treatment well,and no severe adverse effects were observed.Conclusion Apatinib could enhance the efficacy of chemotherapy to treat malignant pleural effusion to some extent.
KEY WORDS:Apatinib;Non-small cell lung cancer;Malignant pleural effusion;Cispatin
0引言
恶性胸腔积液(Malignant Pleural Effusion,MPE)是晚期非小细胞肺癌常见的并发症,常导致胸闷、气闭等临床症状,严重影响肺癌患者生活质量,甚至危及患者生命,是肺癌患者预后差的标志[1,2]。胸腔内化疗药物灌注给药是目前MPE的常见治疗方法,尽管此方法能有效减少胸水的生成,但总体治疗效果仍不够理想[3]。
研究表明,血管内皮生长因子(Vascular Epidermal Growth Factor,VEGF)及受体VEGFR在MPE中有着较高的表达[4,5],提示干扰VEGF-VEGFR通路对MPE的治疗具有理论的可行性。甲磺酸阿帕替尼片(Apatinib,艾坦)是口服的新一代小分子VEGFR-2酪氨酸激酶抑制剂,对晚期胃癌和非小细胞肺癌具有显著的治疗效果[6]。为评估阿帕替尼在MPE中的治疗价值,本研究对31例非小细胞肺癌合并MPE患者采用了阿帕替尼联合常规化疗的方式进行治疗,和30例常规治疗的患者进行了对比,现将研究结果报道如下。
1资料与方法
1.1研究对象
选取2016年3月至2018年10月绵阳市四〇四医院肿瘤科收治的经组织病理学、细胞学确诊的非小细胞肺癌合并恶性胸水患者61例。其中男性49例、女性12例,年龄42岁~75岁,中位年龄69岁。61例患者经计算机随机对照系统分为试验组和对照组,对照组30名患者接受TP化疗方案(紫杉醇静脉滴注+顺铂腹腔灌注),试验组患者接受TP方案联合阿帕替尼治疗。两组患者基线资料比较,差异无统计学意义(表1),具有可比性。该试验通过了绵阳市四〇四医院医学伦理委员会的批准。所有参与试验的患者均同意参加试验并签署了知情同意书。
1.2入排标准
主要入组标准:(1)年龄>18岁;(2)病理活检支持原发性非小细胞肺癌,排除转移性肺癌、小细胞肺癌;(3)胸水彩超或CT提示双侧或单侧胸水,组织学或细胞学已证明为癌性胸水,胸水量可测量;(4)预计生存期≥3个月;(5)KPS评分大于60分;(6)心功能、肝功能、肾功能无异常,对化疗耐受;(7)治疗前4周内未接受过化疗,既往未接受过胸腔灌注给药;(8)病历资料完整,且对整个研究知情,自愿参与。
主要排除标准:(1)合并严重高血压、糖尿病、心脏病患者,通过药物无法有效控制;(2)合并严重肝肾功能损害、呼吸衰竭、免疫系统、心脑血管意外病史、心肌梗死病史、严重的心律失常、心力衰竭、肾功能衰竭和肝功能素衰竭、精神神智异常者等;(3)胸水性质为非肿瘤性,或合并低蛋白血症、心力衰竭、结核性、免疫系统疾病等所致胸水;(4)并发严重的肺部感染,通过药物治疗,无法控制或全身严重感染者;(5)症状性脑转移患者;(6)正在接受溶栓或抗凝治疗或试验期间需要进行溶栓、抗凝治疗的患者。
1.3治疗方法
给药前1~3天所有患者均采用B超定位穿刺点,随后留置引流导管引流积液,引流直到积液量达到最少水平后,实施以下治疗方案。对照组:顺铂75mg/m2,分三次胸腔灌注(d2、d9、d16);第d1静脉滴注紫杉醇135mg/m2。试验组在对照组的基础上每日口服阿帕替尼500mg(qd,d1-d28)。胸腔给药后嘱患者每15~30min变换体位1次,以利于药物与胸膜腔充分接触。两组患者均常规予以止吐、补水、纠正电解质紊乱等处理。每28d为一周期,第一周期治疗结束后,对恶性胸腔积液缓解情况进行评价,两周期治疗结束后对疗效再次进行评价。
1.4评价标准
治疗前和第一周期、第二周期治疗结束后,采用胸部CT定量监测两组患者的胸水量,同时监测患者血常规、肝肾功、胃肠道症状、血压、蛋白尿等表现,以评估治疗的安全性。
近期疗效评价标准参照WHO胸水评价标准,完全缓释(CR):胸水完全消失且维持4周以上;部分缓解(PR):胸水显著减少50%以上并维持4周以上;无效(NC):胸水减少不足50%或增加不超过25%;进展(PD):积液显著增加并超过以前25%或伴有其他病灶[7]。每一周期治疗结束后对疗效进行评价,客观有效率(ORR)=(CR+PR)例数/总例数×100%,疾病控制率(DCR)=(CR+PR+NC)/总例数×100%。
生活质量(QOL)评分以KPS评分变化为标准,如果治疗后KPS增加≥10分,并维持4周以上,则认为QOL改善;若KPS下降≥10分,则认为QOL降低;若KPS变化<10分,则认为QOL稳定。
不良事件按照WHO抗癌药物毒性反应标准分为0~IV级。所有的不良事件均需详细、及时的记录,不良事件收集到患者停止用药后一周。
1.5统计分析
采用SPSS 22.0统计软件进行数据分析。计量资料以均数±标准差(±s)的形式表示,组间比较采取t检验;有效率的比较采取2检验或Fisher确切概率法,P<0.05认为差异具有统计学意义。
2结果
2.1两组患者近期疗效比较
两组患者的疗效评价结果如表2所示。试验组的客观有效率为77.42%,疾病控制率为96.77%;对照组的客观有效率为53.33%,疾病控制率为93.33%(表3)。两组患者客观有效率比较有统计学差异(2=3.918,P=0.048),而疾病控制率比较无统计学意义(P=0.612)。
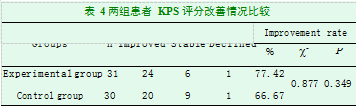
2.2两组患者生活质量改善情况比较
如表4所示,试验组患者QOL改善率为77.42%(24/31),对照组患者QOL改善率为66.67%(20/30),两组比较,差异无统计学意义(2=0.877,P=0.349),尚不能说明试验组治疗能改善患者的生活质量。
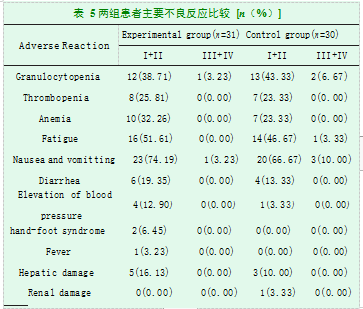
2.3两组患者不良反应观察
在治疗周期内,未出现患者死亡的情况,也未发生因胸腔置管出现的并发症,如气胸、复张后肺水肿等。如表5所示,两组患者的主要不良反应为消化道反应(恶心、呕吐、腹泻)、骨髓抑制(粒细胞减少、血小板减少、贫血)以及疲劳。试验组因加用了阿帕替尼,有四位患者出现了血压升高的情况(I-II级),有两位患者出现了II级手足综合征,余未发生明显的阿帕替尼引起的心血管不良反应。试验组和对照组分别有5名和3名患者出现了I级或II级肝功能损害,对照组有1名患者出现了I级肾功能损害,经过对症处理后,这些患者的肝肾功能损害均得以恢复。所有参与试验患者均完成了试验,未出现因不良事件而导致退出、中断服药或减少试验药物剂量等情况。两组患者不良事件的发生情况如表5所示。
3讨论
肺癌是全球发病率和死亡率最高的恶性肿瘤,因早期诊断困难,超2/3的患者确诊时已属晚期[8]。MPE是肺癌胸膜转移的结果,是晚期肺癌的常见并发症,常常给患者带来极大的痛苦,影响着患者的生活质量。胸腔灌注化疗是目前治疗恶性胸水的主要方法,其中顺铂是常用的灌注药物。化疗药物进入胸腔后,通过渗透及扩散作用直接对肿瘤细胞起杀伤作用,同时也可通过胸膜缓慢吸收入血以维持一定的有效血药浓度。但传统的化疗药物胸腔灌注不仅副作用大,而且治疗后患者复发现象频现,因此,亟需探索新的治疗方法,使肺癌合并胸腔积液患者长期受益。
研究表明,VEGF-VEGFR2通路在恶性胸水的形成中扮演着重要的角色。VEGF是目前发现的最重要的肿瘤血管生长因子,肿瘤细胞转移至浆膜腔,会引起局部VFGF浓度增高。Grove等[9]的研究发现,VEGF在癌性胸水中明显升高。Fiorelli等[5]同样证明,VEGF在MPE中的浓度显著高于良性胸腔积液。VEGF能够促进使浆膜腔新生毛细血管形成,增加液体滤过面积,使毛细血管通透性增加,同时增加穿腹膜蛋白浓度,致使恶性浆膜腔积液形成[10-12]。VEGFR2是VEGF发挥作用的主要受体,VEGF与VEGFR2结合后,促使VEGFR-2受体二聚化,从而激活C-RAF-MEK-MAP激酶途径,促进肿瘤新生血管生成[13]。
阻断VEGF/VEGFR2通路已被证明有益于恶性胸水的治疗。Kitamura等[14]和Masago等[15]采用贝伐单抗联合常规化疗的方式治疗肺癌合并胸水,证明贝伐单抗联合化疗是MPE治疗的有效方式。另一种抗血管药物恩度也被证明能够高效治疗MPE,并且具有副作用少等优点[7,16,17]。在本研究中,我们发现,新型的抗血管分子靶向药物——阿帕替尼,同样能增强常规化疗方案对恶性胸水的治疗效果。
阿帕替尼是我国自主研发的新一代小分子VEGFR-2酪氨酸激酶抑制剂,其主要作用机制是竞争性结合该受体胞内酪氨酸ATP结合位点,高度选择性地抑制VEGFR-2酪氨酸激酶活性。在我们的研究中,对照组常规使用顺铂胸腔灌注联合紫杉醇静脉滴注的方式治疗肺癌合并恶性胸水,试验组在此基础每日服用阿帕替尼。我们的研究结果显示,试验组的客观有效率明显高于对照组(P=0.048),但疾病控制率和生活质量改善情况相对于对照组并没有明显的提高。试验组和对照组的不良事件发生率可控,患者能耐受阿帕替尼联合常规化疗的治疗方式。我们的研究结果提示,阿帕替尼能在一定程度上增强化疗对MPE的治疗效果。通过文献回顾,我们分析阿帕替尼的作用的发挥可能与以下方面有关:一,阿帕替尼吸收后通过血液循环达到胸膜,通过与VEGFR2相关位点结合,阻断VEGF-VEGFR2通路作用的发挥;二,由于阿帕替尼对非小细胞肺癌治疗效果显著[18-21],因此阿帕替尼可能直接对肺癌原发灶和转移灶产生影响。其具体作用机制需在以后研究中阐明。
综上,本研究在一定程度上证明了阿帕替尼能增强化疗对MPE的治疗效果,由于阿帕替尼是一种口服的抗血管生成药物,相对于其它同类药物,具有服药方便、价格低等优势,更值得临床推广。但是本研究仍有许多不足,首先我们选取的患者均为首次治疗,未能详细报道复治患者的疗效;其次本研究只关注了ORR等近期疗效指标,对于总生存率、无疾病进展期等肿瘤试验常用终点没有足够的研究时间进行考察;最后本试验仅为一探索性试验,研究的样本量有限,研究结果的假阳性率高,把握度低,要明确阿帕替尼是否能增强化疗对MPE的治疗作用,还需要进行大样本的确证性随机对照试验以明确。
参考文献
[1]Abrao FC,de Abreu I,Viana GG,et al.Wet m1a non-small cell lung cancer:Is it possible to predict recurrence of pleural effusion?[J].Journal of thoracic disease,2018,10(2):808-815.
[2]Heffner JE,Klein JS.Recent advances in the diagnosis and management of malignant pleural effusions[J].Mayo Clinic Proceedings,2008,83(2):235.
[3]郑勤红,胡伟,廖小方,等.顺铂序贯恩度与单纯顺铂胸腔内灌注治疗恶性胸腔积液的临床对照研究[J].肿瘤学杂志,2013,19(5):386-389.
[4]Mori R,Fujimoto D,Ito M,et al.Bevacizumab for ramucirumab refractory malignant pleural effusion in non-small cell lung cancer:A case report and review of the literature[J].Oncotarget,2017,8(29):48521-48524.
[5]Fiorelli A,Vicidomini G,Di DM,et al.Vascular endothelial growth factor in pleural fluid for differential diagnosis of benign and malignant origin and its clinical applications[J].Interact Cardiovasc Thorac Surg,2011,12(3):420-424.
[6]Zhang H.Apatinib for molecular targeted therapy in tumor[J].Drug Design Development&Therapy,2015,9:6075-6081.
[7]Zhao WY,Chen DY,Chen JH,et al.Effects of intracavitary administration of endostar combined with cisplatin in malignant pleural effusion and ascites[J].Cell Biochemistry&Biophysics,2014,70(1):623-628.
[8]Torre LA,Siegel RL,Jemal A.Lung cancer statistics[J].Advances in Experimental Medicine&Biology,2016,893:1.
[9]Grove CS,Lee YC.Vascular endothelial growth factor:The key mediator in pleural effusion formation[J].Current Opinion in Pulmonary Medicine,2002,8(4):294-301.
[10]Winkler F,Kozin S,Tong R,et al.Kinetics of vascular normalisation by vegfr2 blockade governs brain tumour response to radiation:Role of angiopoietin-1 and matrix met alloproteinases[J].Aktuelle Neurologie,2005,32(Suppl 4).
[11]Tong RT,Boucher Y,Kozin SV,et al.Vascular normalization by vascular endothelial growth factor receptor 2 blockade induces a pressure gradient across the vasculature and improves drug penetration in tumors[J].Cancer Research,2004,64(11):3731-3736.
[12]Wu DW,Chang WA,Liu KT,et al.Vascular endothelial growth factor and protein level in pleural effusion for differentiating malignant from benign pleural effusion[J].Oncology letters,2017,14(3):3657-3662.
[13]Park SA,Jeong MS,Ha KT,et al.Structure and function of vascular endothelial growth factor and its receptor system[J].BMB reports,2018,51(2):73-78.
[14]Kitamura K,Kubota K,Ando M,et al.Bevacizumab plus chemotherapy for advanced non-squamous non-small-cell lung cancer with malignant pleural effusion[J].Cancer Chemotherapy&Pharmacology,2013,71(2):457-461.
[15]Masago K,Fujimoto D,Fujita S,et al.Response to bevacizumab combination chemotherapy of malignant pleural effusions associated with non-squamous non-small-cell lung cancer[J].Molecular&Clinical Oncology,2015,3(2):415.
[16]Biaoxue R,Xiguang C,Hua L,et al.Thoracic perfusion of recombinant human endostatin(endostar)combined with chemotherapeutic agents versus chemotherapeutic agents alone for treating malignant pleural effusions:A systematic evaluation and meta-analysis[J].BMC cancer,2016,16(1):888.
[17]Jie Wang X,Miao K,Luo Y,et al.Randomized controlled trial of endostar combined with cisplatin/pemetrexed chemotherapy for elderly patients with advanced malignant pleural effusion of lung adenocarcinoma[J].Journal of BUON:official journal of the Balkan Union of Oncology,2018,23(1):92-97.
[18]Xu J,Liu X,Yang S,et al.Clinical response to apatinib monotherapy in advanced non-small cell lung cancer[J].Asia-Pacific journal of clinical oncology,2018,14(3):264-269.
[19]Yang C,Feng W,Wu D.Apatinib for advanced nonsmall-cell lung cancer:A retrospective case series analysis[J].Journal of cancer research and therapeutics,2018,14(1):159-162.
[20]Song Z,Yu X,Lou G,et al.Salvage treatment with apatinib for advanced non-small-cell lung cancer[J].Oncotargets&Therapy,2017,10:1821-1825.
[21]Wu F,Zhang S,Gao G,et al.Successful treatment using apatinib with or without docetaxel in heavily pretreated advanced non-squamous non-small cell lung cancer:A case report and literature review[J].Cancer biology&therapy,2018,19(3):141-144.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/25429.html