SCI论文(www.lunwensci.com):
摘要:目的探讨类风湿性关节炎的发病机制,以期为类风湿性关节炎的治疗提供理论依据。方法检索CNKI、万方、维普、Web of science、Pub Med数据库,对近几年和类风湿性关节炎相关的文献进行总结归纳。结果文章从细胞、细胞因子、信号通路三方面来阐述。与RA发病相关的细胞:免疫细胞,滑膜细胞,破骨和成骨细胞;与RA发病相关的的细胞因子:TNF-α,IL-6,IL-8,IL-17等;与RA发病相关的的信号通路:MAPK信号通路,NF-κB信号通路,JAK-STAT信号通路,Toll样受体信号通路,Wnt信号通路。结论抑制免疫细胞活性,降低炎性细胞因子水平,开发MAPK、NF-κB、JAK-STAT、Toll样受体信号通路抑制剂,以及上调Wnt经典通路,对于RA的治疗有着积极的意义。
关键词:类风湿性关节炎;发病机制;细胞因子;信号通路
本文引用格式:谢小倩,王亚乐,罗沙沙,等.类风湿性关节炎发病机制研究进展[J].世界最新医学信息文摘,2019,19(76):109-111.
Pathogenesis of Rheumatoid Arthritis
XIE Xiao-qian,WANG Ya-le,LUO Sha-sha,ZHAO Ze-yue,LI Xiao-tian*
(School of Pharmaceutical Sciences,Zhengzhou University,100 Kexue Avenue,Zhengzhou Henan)
ABSTRACT:Aim:The pathogenesis were summarized,in order to provide a theoretical basis for the treatment of rheumatoid arthritis.Methods:CNKI,Wanfang,VIP,Web of science,and Pub Med were searched,to summarize literature that related to rheum-atoid arthritis in recent years.Results:This article is elaborated from three aspects:cells,cytokines and signaling pathways.RA-related cells:immune cells,synoviocytes,osteoclasts or osteoblasts;RA-related cytokines:TNF-α,IL-6,IL-8,IL-17,etc.RA-related signaling pathways:MAPK signaling pathway,NF-κB signal-ing pathway,JAK-STAT signaling pathway,Toll-like receptor signaling pathway,Wnt signaling pathway.Conclusion:Inhibiting the activity of immune cells,reducing the levels of inflammatory cytokines,and developing inhibitors of MAPK,NF-κB,JAK-STAT,and Toll-like receptor signaling pathways,while upregulating the Wnt pathway,has positive implications for the treatment of RA.
KEY WORDS:Rheumatoid arthritis;Pathogenesis;Cytokines;Signaling pathways
0引言
类风湿性关节炎(rheumatoid arthritis,RA)是以滑膜增生和骨侵蚀为主要特征的自身免疫病的一种,病人在病程初期表现某些关节受累,病程后期可发展为全身性的关节畸形,对病人的身体和心理造成严重损害。国内成年人发病率约为0.34%,其中女性患者数量高于男性患者[1]。RA在临床上的病理特征[2,3]主要表现为三个方面:①关节局部炎症细胞浸润引发慢性炎症。②关节滑膜细胞浸润生长导致滑膜增厚。③骨侵蚀和软骨组织受损。然而,RA的发病机制还不完全清楚,推测其是受抗原所驱动的“激发-连锁”反应[4]。
1发病因素
RA的发病机制复杂,主要发病因素有:①细胞与RA,具体为免疫细胞功能紊乱、滑膜细胞过度增殖、成骨和破骨细胞失衡[5]。②细胞因子与RA,表现为由TNF-α,IL-6,IL-8,IL-17等炎性细胞因子所引发的炎症反应。③信号通路与RA,文中与RA相关的信号通路有MAPK信号通路、JAK-STAT信号通路、NF-κB信号通路、Toll样受体信号通路、Wnt信号通路。
1.1细胞与RA
RA主要的三个病理特征为:炎症、滑膜增生、骨破坏[6]。与之相对应的参与发病的细胞有:免疫细胞、滑膜细胞、成骨细胞和破骨细胞。①免疫细胞与RA:免疫细胞产生细胞因子,细胞因子又可以引发免疫细胞生成和聚集,导致炎症持续进行。T细胞在RA的形成与发展中起重要作用,与之相关的两种T细胞为辅助性T细胞[7](Th17[8,9])和调节性T细胞(Treg)[10,11],一方面,辅助性T细胞能够分泌促炎性细胞因子激活免疫细胞引起炎症;而另一方面,调节性T细胞能够分泌免疫抑制性细胞因子如IL-10,抑制T细胞和其他免疫细胞的活性,具有免疫抑制作用,Treg的这种功能能够抑制RA的炎症反应。若机体辅助性T细胞和调节性T细胞的这种平衡被打破,则会成为诱发RA的原因之一。②滑膜细胞:包括两类,即巨噬细胞样滑膜细胞和成纤维细胞样滑膜细胞(FLS),后者具有浸润生长和增生的特点,异常增殖时导致滑膜增厚,进而侵蚀关节软骨导致关节畸形。③成骨细胞和破骨细胞[3](OB/OC):正常情况下机体OB/OC处于动态平衡状态,但是在某些细胞因子的作用下,促进了OC的生成,导致OB/OC平衡被破坏,诱发RA发病。
1.2细胞因子与RA
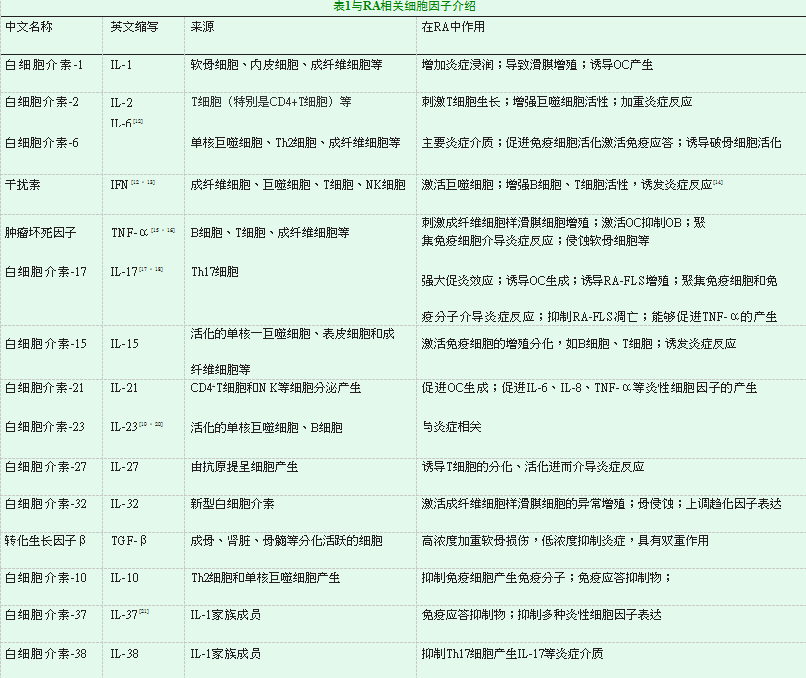
细胞因子对于RA的作用有两个方面。一方面存在促炎性的细胞因子,如促进滑膜细胞增殖的有:TNF-α、IL-17、IL-6、IL-8等;促进破骨细胞活化的有:TNF-α、IL-1、IL-6等[5]。另一方面除了这些促炎性的细胞因子外,也有一些抗炎性细胞因子可对炎症起到抑制作用,如IL-4、IL-10、IL-37、IL-38等。针对以上特征,在RA治疗中对于促炎性细胞因子应致力于研发其抑制剂或拮抗剂、而对于抗炎性细胞因子要增加其表达。关于细胞因子的来源、在RA中作用的详细介绍可见表1。
1.3信号通路与RA
与RA相关的信号通路有MAPK信号通路、NF-κB信号通路、JAK-STAT信号通路、Toll样受体信号通路、Wnt信号通路。其中MAPK、NF-κB、JAK-STAT、Toll信号通路激活可导致RA发病,而Wnt通路和细胞的分化有关,激活Wnt通路经典途径可诱导成骨细胞生成,促进受损骨关节的修复,对于RA的治疗有积极作用。
1.3.1MAPK信号通路
丝裂原活化蛋白激酶(MAPK)是介导细胞反应的重要信号系统,MAPK与细胞的增殖、分化、凋亡以及细胞的功能等密切相关[22]。在RA中,MAPK的激活可以诱发炎症。MAPK信号通路是一个三级酶联系统,存在ERK1/2、JNK/SAPK、p38、ERK5四种激活途径。其中和炎症相关的信号通路为JNK/SAPK和p38,JNK/SAPK的激活途径为MEKK2-MKK4/MKK7-JNK,p38的激活途径为MAPKKK→MKK3/MKK6→p38MAPK。NanLi[23]的研究表明使用p38化学抑制剂SB203580,JNK化学抑制剂SP600125,均可以抑制细胞的炎症水平。此外MAPK被认为是多条信号通路的交汇处,是NF-κB信号通路的上游信号,当MAPK信号通路激活时,参与介导NF-κB信号通路的激活,所以抑制MAPK信号通路可产生双重的抗炎作用,对于RA的治疗起到积极作用。
1.3.2NF-κB信号通路与RA
NF-κB信号通路广泛参与机体的非特异性免疫过程,炎症反应,其家族蛋白包括:NF-κB2 p52/p100、NF-κB1 p50/p105、c-Rel、RelA/p65和RelB[3]。激活该通路可激活免疫分子的表达,产生强大的炎症反应。NF-κB信号通路的激活过程为:一般状态下NF-κB与其抑制蛋白IκB结合不发挥作用,当激活因子如TNF-α、IL-17等细胞因子存在时,在IκB激酶(IκB kinases,IKKs)的作用下,IκB被磷酸化、泛素化、最后被酶降解,IκB降解后,转录因子NF-κB的入核信号暴露,随即进入细胞核开始转录过程[24]。
NF-κB信号通路的激活可导致T细胞活化从而介导炎症反应,还可以诱导RA-FLS异常增殖,激发破骨细胞增殖与活化,其结果导致关节畸形、骨侵蚀,从而加重RA的病情。除此以外,NF-κB激活后产生细胞因子、急性反应蛋白等激活免疫反应、提高黏附分子的表达,这些免疫分子加剧RA的炎症水平。还有很重要的一点,NF-κB信号通路产生的免疫产物(TNF-α、IL-17、IL-6等)同时可以激活NF-κB信号通路,这种正反馈作用的存在使得NF-κB信号通路一直被激活[24],当抑制NF-κB信号通路时可终止这种状态,所以研发该通路抑制剂在RA治疗中有重要的意义。
1.3.3JAK-STAT信号通路与RA
JAK-STAT信号通路具有高度保守性,可分为酪氨酸激酶相关受体、酪氨酸激酶JAK、转录因子STAT三部分。酪氨酸激酶相关受体包括:细胞因子、干扰素、生长激素等,酪氨酸激酶JAK有四种存在形式,即JAK1、JAK2、JAK3和TYK2,转录因子STAT存在七种类型,即STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6[26]。该信号通路激活途径为:酪氨酸激酶相关受体与JAK激酶结合后诱导受体二聚化,二聚化后的受体能够激活JAK,激活后的JAK将STAT磷酸化,磷酸化的转录因子STAT形成二聚体暴露出入核信号,进入细胞核内开始转录过程[25]。
JAK-STAT信号通路在RA中的作用。该信号通路激活过程中产生的STATS,能够激活免疫细胞活性尤其是T细胞,抑制FLS凋亡,这一系列作用导致RA滑膜持续增生,表现为进行性的炎症和软骨侵蚀。且有研究表明STAT3可增加RA患者的心血管疾病风险[27]。此外,RA发病后所产生的大量细胞因子如IL-6、IL-8、IFN等,能够重新激活该通路,加重炎症反应。针对这种情况,国外已经研发出了JAK-STAT信号通路的抑制剂,如辉瑞公司2012年上市的用于治疗RA的药物Tofacitinib,为非选择性JAK抑制剂,可抑制JAK1、JAK2、JAK3,但是存在很大毒副作用;其他还在研发阶段的特异性针对JAK2的抑制剂有AC-430,特异性针对JAK3的抑制剂有VX-509、R-348[28]等。
1.3.4Toll样受体信号与RA
Toll样受体(TLRs)主要参与机体固有免疫过程,也是连接固有免疫和后天获得性免疫的重要途径。TLRs所识别的配体根据来源可分为外源和内源,外源性配体如病原微生物、脂多糖等;内源性配体主要来自机体自身细胞,如热休克蛋白[29]。TLRs的激活途径为:TLR识别配体后与其结合,形成二聚体复合物,TLRs和聚集的衔接蛋白相结合,通过MYD88依赖型与MYD88非依赖型两种途径激活下级酶联反应[30]。值得注意的是,MYD88依赖型途径被认为是NF-κB通路的上游信号参与激活NF-κB信号,而MYD88非依赖型信号转导途径可产生IFN,IFN重新激活JAK-STAT信号通路[29]。所以机体的信号通路是相互关联的复杂的信号通路网络,仅抑制某个信号通路难以达到非常好的抗炎效果,或许应关注多个信号通路的交互位点,以达到能够同时抑制多个信号通路,增强抗炎效果。目前Toll受体抑制剂应用于RA治疗的研究在国内还未见报道。
1.3.5Wnt信号通路与RA
Wnt信号通路对于干细胞和胚胎的发育有着调控作用,然而也有研究表明Wnt信号通路可调节骨细胞的生长、分化、增殖、凋亡[3,31]。Wnt信号通路分为Wnt/β-catenin经典通路;Wnt/Ca2+信号通路和Wnt/JNK信号通路。三个途径相互协调可以调节破骨成骨细胞的动态平衡,当破骨细胞和成骨细胞平衡被打破则诱发骨侵蚀和骨破坏,是RA诱发的因素之一。Wnt通路经典途径可诱导成骨细胞生成,促进受损骨关节的修复,可以缓解软骨损伤和骨侵蚀作用。此外,刘兴振等[3]提出了Wnt信号通路中的一种保守蛋白即巢乱蛋白(Dvl),该蛋白激活Wnt/β-catenin信号通路的同时,还能够与p65蛋白结合抑制NF-κB通路。因此,巢乱蛋白既有助于成骨细胞的形成,又通过下调NF-κB通路抑制炎症反应,这两方面的作用意味着该蛋白对于RA的治疗具有很大的潜力。
2结语
本文从细胞水平、细胞因子、信号通路对RA的发病机制进行阐述和解释。RA的病理特征主要有三方面,所以其治疗方法也要针对三个病理特征进行,即抑制炎症反应,抑制滑膜细胞增殖,抑制软骨损伤和骨侵蚀。细胞因子,TNF-α、IL-6、IL-8、IL-17有很强的促炎效应,应研发其抑制剂,同时上调抑制免疫活性的细胞因子水平,如IL-4、IL-10、IL-37、IL-38等。信号通路与RA:MAPK信号通路中JNK和p38途径的激活与炎症相关,MAPK也可介导NF-κB信号通路的激活;NF-κB信号通路激活可以诱发炎症、诱导FLS异常增殖、诱导破骨细胞生成;JAK-STAT信号通路激活抑制RA-FLS凋亡、诱发炎症反应;Toll样受体激活主要介导炎症反应,也参与NF-κB、JAK-STAT信号通路的激活,引发连锁反应;Wnt信号通路中Wnt/β-catenin经典通路上调可以促进骨生成。针对这些信号通路的不同机制,在RA的治疗中应研发MAPK、NF-κB[32]、JAK-STAT[33]、Toll样受体信号通路抑制剂,并且激活Wnt/β-catenin经典通路,从多角度进行研究,针对信号通路网的交汇蛋白进行研究,推动RA治疗药物的发展。
参考文献
[1]栾仲秋,李秋红,王继坤,等.类风湿关节炎的中医药治疗概况[J].中国中医药科技,2017,(01):123-124.
[2]李渊博,许鹏.高迁移率族蛋白1(HMGB1)与类风湿性关节炎发病的关系[J].细胞与分子免疫学杂志,2016,(08):1128-1132.
[3]刘兴振,范洁,赵东宝.Dvl交叉调控Wnt及NF-κB信号通路在类风湿性关节炎骨侵蚀中的作用研究进展[J].中国现代应用药学,2015,(11):1404-1408.
[4]李颖,汪悦,覃仕化,等.类风湿性关节炎的研究进展[J].中国矫形外科杂志,2011,(07):581-584.
[5]宛春甫,刘玉华,李志华,等.类风湿性关节炎的发病因素研究进展[J].疑难病杂志,2005,(05):317-319.
[6]B.Auid-Orcid http orcid org X.Williams,A.Dharmapatni,T.Crotti.Intracellular apoptotic pathways:a potential target for reducing joint damage in rheumatoid arthritis[J].Inflammation Research,2018:67(3):219-231.
[7]姜姝姝,高梓珊,甘君学,等.Th17-STAT3正反馈通路在类风湿性关节炎促炎机制中的研究进展[J].辽宁中医杂志,2015,(04):897-901.
[8]S.M.Paulissen,J.P.van Hamburg,W.Dankers,et al.The role and modulation of CCR6+Th17 cell populations in rheumatoid arthritis[J].Cytokine,2015:74(1):43-53.
[9]G.Azizi,Abbas Jadidi-Niaragh F Fau-Mirshafiey,A.Mirshafiey.Th17 Cells in Immunopathogenesis and treatment of rheumatoid arthritis[J].International Journal of Rheumatic Diseases,2013:16(3):243-53.
[10]Y.Yang,X.Zhang,M.Xu,et al.Quercetin attenuates collagen-induced arthritis by restoration of Th17/Treg balance and activation of Heme Oxygenase 1-mediated anti-inflammatory effect[J].International Immunopha rmacology,2017:54:153-162.
[11]R.Byng-Maddick,M.R.Ehrenstein.The impact of biological therapy on regulatory T cells in rheumatoid arthritis[J].Rheumatology(Oxford),2015:54(5):768-75.
[12]C.Diaz-Torne,M.D.A.Ortiz,P.Moya,et al The combination of IL-6 and its soluble receptor is associated with the response of rheumatoid arthritis patients to tocilizumab[J].Seminars in Arthritis and Rheumatism,2017
:S0049-0172(17)30281-0.
[13]Bi-Sheng de Groen Ra Fau-Liu,Andre Liu Bs Fau-Boonstra,A.Boonstra.Understanding IFNlambda in rheumatoid arthritis[J].Seminars in Arthritis and Rheumatism,2014:16(1):102.
[14]王景红,夏坤,张志千,等.骨关节炎相关细胞因子及生物标志物的研究进展[J].中国实验方剂学杂志,2015,(10):225-230.
[15]Joachim R.Kalden,Hendrik Schulze-Koops.Immunogenicity and loss of response to TNF inhibitors:implications for rheumatoid arthritis treatment[J].Nature Reviews Rheumatology,2017,13:707.
[16]N.S.Lai,H.C.Yu,C.H.Tung,et al.The role of aberrant expression of T cell miRNAs affected by TNF-alpha in the immunopathogenesis of rheumatoid arthritis[J].Arthritis Research&Therapy,2017,19(1):261.
[17]Iifg da Silva,H.D.Angelo,E.Rushansky,et al.Interleukin(IL)-23 Receptor,IL-17A and IL-17F Gene Polymorphisms in Brazilian Patients with Rheumatoid Arthritis[J].Archivum Immunologiae Et Therapiae Experiment alis,2017,65(6):537-543.
[18]B.W.Kirkham,Kristian Kavanaugh A Fau-Reich,K.Reich.Interleukin-17A:a unique pathway in immune-mediated diseases:psoriasis,psoriatic arthritis and rheumatoid arthritis[J].Immunology,2014,141(2):133-42.
[19]Wida Razawy,Marjolein van Driel,Erik Lubberts.The role of IL-23 receptor signaling in inflammation-mediated erosive autoimmune arthritis and bone remodeling[J].European journal of immunology,2018:48(2):220-229.
[20]G.Hamdy,H.Darweesh,E.A.Khattab,et al.Evidence of association of interleukin-23 receptor gene polymorphisms with Egyptian rheumatoid arthritis patients[J].Human Immunology,2015:76(6):417-20.
[21]L.Yang,J.Zhang,J.Tao,et al.Elevated serum levels of Interleukin-37 are associated with inflammatory cytokines and disease activity in rheumatoid arthritis[J].APMIS,2015123(12):1025-31.
[22]陈晓俊,王健英,金素安,等.中药影响类风湿性关节炎信号通路的研究进展[J].中华中医药学刊,2016,(07):1735-1739.
[23]Nan Li,Qiang Xu,Qingping Liu,et al.Leonurine attenuates fibroblast-like synoviocyte-mediated synovial inflammation and joint destruction in rheumatoid arthritis[J].Rheumatology,2017,56(8):1417-1427.
[24]吕邵娃,王秋实,赵爽,等.中药调控类风湿性关节炎核因子κB信号通路的研究进展[J].细胞与分子免疫学杂志,2015,(11):1580-1583.
[25]S.Banerjee,A.Biehl,M.Gadina,et al.JAK-STAT Signaling as a Target for Inflammatory and Autoimmune Diseases:Current and Future Prospects[J].Drugs,2017,77(5):521-546.
[26]陈呢喃,张冬青.JAK—STAT信号通路在类风湿关节炎中的研究进展[J].现代免疫学,2013,(5):425-428.
[27]M.Nadali,R.Pullerits,K.M.E.Andersson,et al.High Expression of STAT3 in Subcutaneous Adipose Tissue Associates with Cardiovascular Risk in Women with Rheumatoid Arthritis[J].International Journal of Molecular Sciences,2017:E2410.
[28]纪前前,郭伟伟,张倩倩,等.JAK抑制剂在类风湿性关节炎治疗中的研究进展[J].中国药房,2016,27(5):711-713.
[29]吕社民,孟列素,朱文华.Toll样受体参与类风湿性关节炎发病机制的研究进展[J].西安交通大学学报(医学版),2014,(04):423-428.
[30]王欢,王庆甫,殷岳杉,等.Toll样受体在骨关节炎中的作用研究新进展[J].长春中医药大学学报,2016,32(6):1265-1268.
[31]熊雪婷,许碧莲.Wnt信号通路在类风湿性关节炎发病机制中的研究进展[J].中国药理学通报,2014,(01):13-16.
[32]H.Auid-Orcid http orcid org Hong,Y.Zeng,W.Jian,et al.CDK7 inhibition suppresses rheumatoid arthritis inflammation via blockage of NF-kappaB activation and IL-1beta/IL-6 secretion[J].Journal of Cellular and Molecular Medicine,2017,22(2):1292-1301.
[33]D.M.Schwartz,Y.Kanno,A.Villarino,et al.JAK inhibition as a therapeutic strategy for immune and inflammatory diseases[J].NATURE REVIEWS DRUG DISCOVERY,2015,17(1):78.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/20176.html