SCI论文(www.lunwensci.com):
摘要:疫苗是现代社会公共健康保障的主要技术支柱之一。近年来,疫苗安全问题受到越来越多的关注,促进我国疫苗生产规范不断完善。本文基于《药品生产质量管理规范(2010年修订)》,对比美国FDA版cGMP,结合《中华人民共和国疫苗管理法(征求意见稿)》,从疫苗的生产质量、法律惩处、经济效益等方面,探讨中国疫苗可持续发展的现状及面临的挑战,并从法律、企业、从业人员和公众宣传等角度提出了可能的整改措施以及对策。
关键词:疫苗;药品GMP;公共健康;可持续发展
本文引用格式:殷丹静,张新宇.中国疫苗可持续发展所面临的挑战[J].世界最新医学信息文摘,2019,19(55):205-207.
0引言
疫苗作为现代社会公共健康保障的主要技术支柱,是减轻社会疾病负担的重要工具。疫苗安全问题受到越来越多的关注。疫苗的可持续生产,是全球发展中国家都面临的巨大挑战。近年来,我国疫苗生产规范不断完善,逐渐接近发达国家的标准,但仍存在亟待改进之处。
本文基于《药品生产质量管理规范(2010年修订)》(简称《2010版药品GMP》),对比美国FDA版“Current Good Manufacture practices”(cGMP),从疫苗生产过程中的人员职责、质量管理、生产记录等方面分析我国在疫苗生产规范上的进步和不足之处。本文将从法律惩处、经济效益、监管力度、公众宣传等角度,结合2018年11月最新推出的《中华人民共和国疫苗管理法(征求意见稿)》(简称《疫苗管理法(征求意见稿)》),简要分析中国疫苗生产中所面临的挑战,并就现行处理措施提出进一步改进方案,以实现可持续性疫苗生产。
1中国疫苗生产质量管理规范的进展
Good Manufacturing Practice(GMP)是国际通用的生物制药生产质量管理规范。实行《2010版药品GMP》使我国向国际化质量管理进一步靠拢。从1998版药品GMP的87条规定扩展至2010年的313条正式规定,我国的药品生产法规逐步完善。企业需更为重视生产人员的培训和任用,并对质量管理部门的职责有了进一步明确。例如批间一致性和生产记录原始性问题,2010版比《药品生产质量管理规范(1998年版)》(简称《1998版药品GMP》)有了更为清晰完整的说明,因此疫苗事件爆发后,监管部门能够及时反应判定其违反药品生产质量规范。相比于美国食品药品监督管理局(FDA)的cGMP规定,我国的质量管理规范在人员职责、质量管理、生产记录方面还有更多的提升空间。具体对比如表1所示。
2中国疫苗生产质量现状
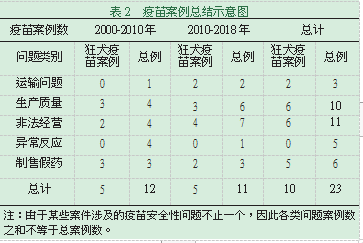
中国人用疫苗生产,从替外国品牌代工,到产生自主知识产权的生产,到产品质量逐渐国际接轨,整个过程充满挑战。近年来,随着对疫苗安全关注度的增加、疫苗监管制度的的改进、企业科技水平的提高,中国疫苗生产质量在不断纠错的过程中逐步改进。21世纪以来,我国的疫苗相关案件中,问题主要存在于运输问题、生产质量问题、非法经营、出现异常反应、制售假药等方面,狂犬疫苗问题尤其突出。表2统计了2000年以来,受害者达2人以上并被广泛报道的具有较大社会影响力的23例疫苗案件。
其中,2000-2010年受害人数大于两人且具有较大社会影响力的疫苗案件共计12例,涉及狂犬疫苗案的共计5例。2011-2018年此类案件共计11例,涉及狂犬疫苗案的共计5例。近十年与过去十年案件率并无明显下降,既可能是疫苗质量问题改进不明显,也可能由于近年来的监管标准和力度提高、透明度曝光率提高所致。2000-2018年涉及两种疫苗问题的有6例,涉及三种疫苗问题的有3例。值得注意的是,在疫苗案件总例中,非法经营问题和生产质量问题在近年案件中超过半数,为主要疫苗安全问题。运输问题(8%到18%)、生产质量问题(33%到55%)和非法经营问题(33%到67%)在疫苗案件中的比例呈明显上升趋势,而异常反应问题(33%到9%)的比例则呈下降趋势,制售假药问题(25%到27%)变化不大。其中,运输问题在2018年《疫苗管理法(征求意见稿)》第五章疫苗流通中已有体现,疫苗生产相关规定在第三章疫苗生产和批签发中又一次明确生产质量管理及文件过程记录应符合相关规定,以确保生产过程持续合规。异常反应问题在第七章异常反应监测与补偿中确立了应对方案,具体补偿办法应由各地人民政府制定完成。正式施行《疫苗管理法》将是我国推进疫苗可持续发展的一大里程碑。
在这23例疫苗案中,近半数的疫苗安全问题与狂犬疫苗相关,可能与狂犬疫苗生产工艺复杂精细我国自主产权的狂犬病疫苗生产刚刚起步有关。狂犬病是急性传染病,出现临床症状后致死率近100%,迄今仍缺乏有效的临床治疗手段[1],亚洲和非洲为高发地区。世卫组织、联合国粮农组织、国际兽疫局等于2017年世界狂犬病日发布《2030年零死亡:战略计划》,旨在到2030年实现由狗传播的人类狂犬病零死亡[2]。狂犬病也是疫苗可预防的病毒性疾病,因此狂犬疫苗的需求量及重要性不言而喻。欧美发达国家对狂犬疫苗的生产、接种等管理已相对成熟,而中国首家拥有自主知识产权的冻干人用狂犬病疫苗于2014年方才上市[3]。
3中国实现疫苗可持续生产面临的挑战和可行对策
对于发展中国家而言,使疫苗生产达到国际化要求、实现可持续生产是一项需要国家和企业共同努力的过程。Julie Milstien等人[4]综合分析了发展中国家在实现国际化GMP标准时所面临的挑战,提出强有效的国家监管部门应有充足的技术、资源,并对企业的疫苗生产过程进行严格监督;而疫苗生产企业,走向国际市场,实现高标准化的GMP生产则是一项重要因素。目前我国实现可持续疫苗生产所面临的挑战以及改进措施主要有以下方面。
3.1法律法规。法律法规是保障疫苗安全的依据。《2010版药品GMP》要求自2011年3月1日起,新建药品生产企业应符合《2010版药品GMP》,现有疫苗等无菌药品的生产应在2013年12月31日前达到《2010版药品GMP》要求。该规范从出台到全面执行的几年时间内,我国药品生产质量管理有进步,也有不足。国家市场监督管理总局于2018年11月11日发布公告,就《疫苗管理法(征求意见稿)》公开征求意见,其中就职责分工、追溯体系、疫苗流通、科普宣传等都提出了相关规定,并对疫苗研制和注册审批等具体流程做出规定,体现出我国对优化疫苗监管、切实保障人民群众疫苗安全的决心。
3.1.1立法:尽管疫苗不良反应是无法完全避免的,但制定严格的法律法规加强疫苗安全监管(“有法可依”),有利于减少问题疫苗。DeLong,G[5]研究了免除制药公司责任后对疫苗生产安全的影响,发现当消费者失去起诉权利、制药商无需对不良反应事件负责后,疫苗安全性大大降低,不良反应事件大量增加。
立法时,疫苗伪劣药区分问题需进一步引起重视。据《中华人民共和国药品管理法》,药品所含成分与国家药品标准规定的成分不符的、以非药品冒充药品或者以他种药品冒充此种药品的,为假药(第48条);药品成分的含量不符合国家药品标准的,为劣药(第49条)。劣药处罚力度弱于假药。而美国的《联邦食品、药品和化妆品法案》中,把不合格药品分为伪劣药和违标药品。经过具体比较,美国将我国的假药和劣药均归为伪劣药,而违标药品指的是标签有问题或不符合规定者[6],该分类标准值得借鉴。而新近公布的《疫苗管理法(征求意见稿)》,体现了此种借鉴。其中第十章法律责任规定,当疫苗存在质量问题或者其他安全隐患,未采取召回措施时,属于第89条中严重违法行为处罚。因而,该疫苗管理法的推行将为我国疫苗安全管理起良好的引导作用。为使后续的疫苗监管更为科学,有关法律规定需进一步规范和健全。我国在相关法律条文上的改进,可以看到我国在疫苗管理上的进步,显示出我国疫苗监管正与国际接轨的积极走向。
3.1.2执法:近年来,我国的药品质量生产管理规范不断修正,《2010版药品GMP》中的具体规范内容已十分接近国际标准。关键是企业违规后的“有法必依,执法必严,违法必究”问题。企业内部的监督审核系统和民众的监督权力应明确,建立透明而完善的监督体系,提高医疗卫生人员的自觉性,明确非法经营的危害性。面对疫苗事件,管理部门的应急机制要响应迅速,发现问题及时处理,事后及时启动疫苗补偿机制和召回制度,尽快完成补种工作[7],实现企业整改和疫苗补种两手抓。有效的执法力度,才能使企业对疫苗法规有足够的重视。2018年吉林疫苗案,除对相关人员的行政处罚和刑事追究外,相关部门开出的处罚额创我国迄今疫苗案的最高记录:91亿元。如此天价罚单全球亦罕见,体现了监管部门的执法决心。希望为众多制药企业敲响警钟,真正尊重疫苗法规。
3.2企业优化。企业作为疫苗生产的主体,其GMP水平直接关系到疫苗可持续发展和安全,而目前我国疫苗生产企业的水平良莠不齐,面临巨大挑战。
3.2.1生产控制:根据《2010版药品GMP》第二章第三节规定,“生产全过程应当有记录,偏差均经过调查并记录”。GMP规定中并未包含具体的药品生产中可容许的偏差数字,需要企业自身设立合理的标准并认真执行。疫苗作为一种极易失效的用于注射的生物制品,其质量控制应严格规范。2009年大连某公司在狂犬病疫苗中非法添加核酸作为佐剂[8],核酸在当时尚未进入人体临床试验阶段,无法确定其对人体是否会造成损害。美国的生产工艺在申报时需向FDA证明其在可靠工艺范围内的波动程度,以保证终产品质量达标。我国《2010版药品GMP》在第二百四十八条规定中也明确表示企业应有偏差处理的相应记录,任何偏差都应评估对产品质量的潜在影响,以得到持续稳定的生产结果。《疫苗管理法(征求意见稿)》在第三章疫苗生产和批签发中又一次明确生产质量管理及文件过程记录应符合相关规定,以确保生产过程持续合规。凡与被批准的生产工艺不相符的部分均应看做违反生产管理规范,关于某工艺在设计范围(design space)和目标运行范围(target operating range)内的生产效果验证,应在生产前进行,而非在事故发生之后进行补救分析。
3.2.2冷链运输:疫苗效价不合格问题是疫苗检定过程中的常见问题。严格冷链存储运输在保证疫苗效用上极为重要。
2007年的山西疫苗案和2016年的山东疫苗案中均暴露出严峻的疫苗运输储存问题。根据2013版《药品经营质量管理规范》第四十九条规定,运输储存疫苗应配备符合其储存要求的设备设施。不具经营资格的人员以低价进购疫苗后将疫苗售往各地,在缺乏相关技能培训和运输条件的情况下极难保证疫苗的有效性,同时严重违反了我国药品质量管理规范。为促进疫苗流通规范,陈泽等人[9]提议需不断完善《疫苗流通和预防接种管理条例》,完善疫苗研发,加强对冷链系统接口环节的监督和管理。运输问题在《疫苗管理法(征求意见稿)》第五章疫苗流通中已有体现,有利于我国对疫苗运输流通的严格监管。提高事故处理反应能力,从根源上解决存储、运输问题。
3.2.3经济效益:疫苗的发展过程长耗时、高风险、多资源需求,疫苗研发的成功和生产工艺的延续需要多方面因素的共同配合。常规疫苗价格低廉,在保持较低价格时往往无法获利太多[10],因而部分企业试图通过违反GMP、降低生产成本的方式来提高利润。正确的方法,则应从扩大市场范围、提高需求量和提高品质进军高端疫苗市场的角度,来提高利润空间。欧美的疫苗和生物药品企业已经开始迈向生物制造
4.0模式。国产企业应坚持自主创新、优化细胞系和工艺、提高自动化、开发产高附加值的新型疫苗和药品,以实现可持续性疫苗生产。通过优化细胞系和工艺,在提升疫苗品质的基础上降低成本提高产量;通过开发新疫苗,扩大市场,提高需求量,将原有市场延伸到海外。可行的新疫苗开发方向包括:①针对具有挑战性的传染病例如HIV和HPV等;②对不断出现的新型传染病作出更快速的反应;③更好地保护新生儿、免疫系统受损的人群、孕妇和老年人等弱势群体[11]。以上方法不仅有利于实现能疫苗的可持续发展,更让国内生物药品市场不断产业升级,推进中国早日实现生物制造4.0。
3.3专业人员培训。监管部门和企业从业人员的水平决定了我国疫苗生产发展的水平。对比《2010版药品GMP》第三章与《1998版药品GMP》第二章,我国对生产人员学历要求与培训要求都有所提高,已十分接近美国FDA cGMP规范。生产人员和监督审查人员除需符合一定的学历、经验、能力要求之外,还需进行系统的GMP培训,以保证生产质量和检查的公平公正。尽管《2010版药品GMP》强调系统培训,《疫苗管理法(征求意见稿)》第九章中也规定对疫苗实行全生命周期监督管理,建立职业化检查队伍,但我国的检查人员由于并非专职从事检查工作,水平参差不齐[12],生产人员水平也面临类似的培训问题。
从业人员水平无法与生物制药行业要求相匹配,是欧美企业和监管部门也长期面临的问题。欧美政府通过与公立高校合作,成立专门的培训机构,并面向全世界生物制药行业的从业人员进行GMP培训。比如美国北卡州立大学的生物制造培训教育中心(BTEC)和爱尔兰基于都柏林大学、都柏林三一学院、都柏林城市大学和斯莱戈技术学院的国家生物加工研究与培训研究所(NIBRT)等培训机构,为包括美国FDA、世卫组织和全球前十大药厂在内的从业人员进行专业培训。高水平的培训有效保障了发达国家生物制药从业人员的GMP水平,因而部分来自中国等亚洲国家的从业人员,也不远万里前往参加培训。如果中国相关部门和高校也能效仿此模式,成立专业培训机构,既有利于解决从业人员培训问题,又能有效推动生物制药产业的发展和升级,甚至可以填补亚太地区缺乏高质量生物制药培训的现状。
3.4公众宣传教育。目前,民众对疫苗的了解往往来自于媒体报道,极少部分来自于正规的学术专业普及,造成了信息链缺失,使民众缺乏对疫苗的正确认识。一旦听闻疫苗事故,容易听信谣言,甚至出现抵制疫苗等现象[13]。近年来在美国,由于误信疫苗有害论已经导致麻疹、水痘等曾经有效控制的疾病在部分地区再次爆发。因此科学、客观、公正的疫苗宣传教育极为重要。
近来,国家药监局网站针对近几起疫苗事件开辟了疫苗科普的专栏。《疫苗管理法(征求意见稿)》第一章第11条中也规定各级人民政府、新闻媒体等应当加强疫苗安全宣传教育。百度网站也设立了快捷疫苗查询点,便于关注自身注射疫苗来源的民众查询。然而,由于这些网站浏览程度并不高,仅仅在网站上开辟专栏并不能满足科普的需要。我国还可进一步采取的措施有:①举行线下医务人员科普交流,许多未受过教育的老人更愿意相信面对面交授提问的形式,更接近基层民众。②利用自媒体的方式建立官方的知识普及渠道,及时透明地发布信息,这种方法受众更多,更易降低谣言引起的恐慌。③加强对从业人员的培训,及时补种检查,不能将注射此效价不合格疫苗等同于无害论处。
疫苗是保持公共健康必不可少的医疗手段,有必要明确疫苗的重要性。民众应以积极的态度对待疫苗,明确疫苗的关键地位;国家应完善法律,加强监管,建立健全培训机构;推动企业提高国内疫苗研发生产技术创新、改善疫苗生产工艺、保证疫苗生产质量、严格遵守《2010版药品GMP》,在《疫苗管理法(征求意见稿)》的基础上,坚决防范不合格、不安全的疫苗流通到公共市场,实现我国疫苗生产的可持续发展。
参考文献
[1]李岩异,戴碧璇,谭丽霞,等.狂犬疫苗的研究进展[J].生物产业技术,2017(01):100-104.
[2] World Health Organization,Food and Agriculture Organization of the United Nations&World Organisation for Animal Health.(2018).Zero by 30:the global strategic plan to end human deaths from dog-mediated rabies by 2030.World Health Organization.
[3]蔡勇,周蓉,李声友,等.国产冻干人用狂犬病疫苗(人二倍体细胞)的安全性及免疫原性观察[J].中国生物制品学杂志,2015,28(05):510-513+517.
[4]Milstien Julie,Costa Alejandro,Jadhav Suresh,Dhere Rajeev.Reaching international GMP standards for vaccine production:challenges for developing countries.[J].Expert Review of Vaccines,2009,8(5):559-66
[5]DeLong,G.(2018).Is“Delitigation”Associated with a Change in Product Safety?The Case of Vaccines[J].Review of Industrial Organization,2018,52(1),1-53
[6]张彧,褚淑贞.我国《药品管理法》与美国相关法规中关于假劣药界定的比较分析及启示[J].中国药房,2013,24(41):3849-3851.
[7]徐岷田,孙曰快,李永超,等.非法经营预防用生物制品案例分析与执法探讨[J].中国公共卫生管理,2003(02):171-172.
[8]药监局:大连金港安迪狂犬疫苗涉嫌故意造假[J].中国工作犬业,2009(03):63.
[9]陈泽,陈涛安.疫苗流通和预防接种条例、规范、办法的改进探讨[J].中国卫生产业,2015,12(24):34-37.
[10]E.S.Pronker,E.Claassen,A.D.M.E.Osterhaus.Development of new generation influenza vaccines[J].Vaccine,2012,30(51):7344-7347
[11]Rino Rappuoli,Ennio De Gregorio.Editorial overview:Vaccines:novel technologies for vaccine development[J].Current Opinion in Immunology,2016,41:v-vii
[12]毕军,邹毅.中美药品GMP检查体系对比分析[J].中国药事,2013(6):578-583.
[13]刘晓欣,林瑞超,杨春宁,等.中国疫苗安全监管现状、问题及对策[J].中国公共卫生管理,2017,33(02):192-195.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/16690.html