SCI论文(www.lunwensci.com):
摘要:目的探讨miR-375作为肥胖诊治生物标志物的价值。方法采用实时荧光定量聚合酶链反应(real time PCR,RT-PCR)检测高脂饮食诱导下不同生命时期(肥胖程度)小鼠代谢性组织、血清中miR-375的表达水平。结果(1)在饲养12周后,高脂组小鼠体重:37.56±3.16g,低脂组小鼠体重:29.09±2.98g,高脂组的小鼠体重超过低脂组的20%,肥胖模型成功。(2)在饲养的不同时期,两组小鼠血清及代谢组织中的miR-375的表达水平是动态变化的;miR-375在不同组织的表达水平不同(P<0.05),在胰腺、血清中特异性表达;在饲养的第3、6、9、12周,miR-375在高脂组小鼠的胰腺中的表达水平较低脂组的增高(P<0.01);而在饲养的第6、9周,miR-375在高脂组小鼠血清中表达水平较低脂组的降低(P<0.05);在饲养的不同时期,miR-375在两组小鼠的小肠不同阶段的表达水均不同(P<0.01)。结论1.60%的高脂饲料能在较短时间内建立C57BL/6小鼠的肥胖模型。2.miR-375在机体不同组织的表达程度不同,在血清、胰腺中表达有特异性,在不同程度肥胖的诊治中有重要的价值。
关键词:MiR-375;肥胖;miRNA
本文引用格式:陈彦辉,吴亚,方圆圆,等.MiR-375在不同程度肥胖中的表达水平及意义[J].世界最新医学信息文摘,2019,19(59):1-5,8.
Expression and Significance of miR-375 in Different Degrees of Obesity
CHEN Yan-hui,WU Ya,FANG Yuan-yuan,YANG Li-qi*
(Second Affiliated Hospital of Anhui Medical Universit,Hefei Anhui)
ABSTRACT:Objective To explore the value of miR-375 as a biomarker for the diagnosis and treatment of obesity.Methods RT-PCR was used to detect the expression of miR-375 in metabolic tissues and serum of mice at different life stages(degree of obesity)induced by diet.Results(1)At the 12th week,the weight of the mice in the high fat group was 37.56±3.16g,that in the low fat group was 29.09±2.98g.The weight of the mice in the high fat group was more than 20%of the low fat group,and the obesity model was successful.(2)The expression level of miR-375 in different tissues was different(P<0.05),and it was specifically expressed in pancreas and serum.At the 3rd,6th,9th and 12th week,the expression of miR-375 in the pancreas of the high fat group group was higher than that of the low fat group(P<0.01).At the 6th and 9th week,the expression of miR-375 in the serum of the high fat group was lower than that of the low fat group(P<0.05).In different life stages,the expression of miR-375 in different intestinal segments of the two groups was different(P<0.01).Conclusions 1.60%high fat diet could establish obesity model of C57BL/6 mice in a short time.2.miR-375 is expressed differently in different tissues.Specific expression of miR-375 in serum and pancreas and miR-375 is of great value in the early diagnosis of obesity and metabolic syndrome.
KEY WORDS:MiR-375;Obesity;MiRNA
0引言
肥胖是可损害健康的异常或过量脂肪累。随着世界经济的发展,肥胖的流行趋势愈发严峻[1],肥胖还会增加糖尿病等疾病的发生风险,儿童期肥胖能够诱发成年期的肥胖[2],但儿童期肥胖防治效果优于成人,所以预防肥胖及其诱发的疾病应首先防治儿童肥胖症。寻找发现并研究新的与肥胖相关的生物标志物,将为肥胖及其诱发的疾病的防治开拓新的思路。MicroRNA-375(MiR-375)是一种非编码、单链的小RNA,具有高度内源性、保守性的特点,最早发现于胰岛β细胞。过表达miR-375会降低胰岛分泌功能,相反的话则促进胰岛素的分泌[3],在miR-375基因敲除小鼠模型中,胰岛α和β细胞的数量减少[4],miR-375在胰腺发育及胰岛素分泌中起着很重要的作用。而通过对糖尿病患者与正常人群的对照研究研究发现,miR-375在糖尿病患者中显著增加,且表达有特异性[5],miR-375在糖尿病诊治中有重要的价值[6,7]。近年来,研究者还发现,miR-375在胃癌组织标本中的表达较癌旁组织标本显著下降[8,9];miR-221/miR-375[10]的比值在检测诊断头颈部鳞状细胞癌方面,其灵敏度、特异度分别达到92%和93%;外周血中的miR-375在单独诊断肝细胞癌方面,其灵敏度和特异度分别达到100%和96%[11],miR-375已被证明是一种抑癌基因,并大有希望成为新的肿瘤标志物及治疗靶点。而在诱导3T3-L1前脂肪细胞分化成熟过程中,前脂肪细胞中miR-375呈现高水平[12,13],过表达的miR-375能促进脂肪分化,相反的抑制miR-375的表达,成脂分化受抑制。MiR-375在脂肪形成过程中的急剧增加,并加速了细胞内TG的积累,是一种促进脂肪细胞分化的新分子。本研究在高脂饮食诱发的小鼠肥胖动物模型中,通过检测不同生命阶段小鼠的血清及各代谢性组织中miR-375的表达水平及各代谢指标的变化,研究miR-375在肥胖及相关代谢性疾病中的诊治价值。
1材料与方法
1.1主要材料
3周龄雄性SPF级C57BL/6小鼠,购于北京维通利华实验动物技术有限公司,60%高脂饲料(TP23300)和10%低脂对照饲料(TP23302)购于南通特洛菲饲料科技有限公司,生化试剂盒及miR-375引物均购于Servicebio公司,卓越金采®血糖仪购于罗氏,Trizol LS、Trizol购于ambion公司,RevertAid First Strand cDNA Synthesis Kit购于Thermo公司,FastStart Universal SYBR Green Master(Rox)购于Roche公司。
1.2实验方法
1.2.1小鼠肥胖模型的建立
对48只3周龄C57BL/6小鼠进行随机分两组:高脂饮食组、低脂对照组,并对小鼠进行编号,饲养于标准条件下的级动物房(温度:20~26℃;湿度:40~70%;光暗每12小时交替),不限制摄水、进食。每日对小鼠精神状态、活动情况、毛色、进食、饮水量等进行观察。每周同一时间对小鼠体重、体长等进行测量。
1.2.2标本采集
每隔3周随机从高脂组、低脂组分别选取6只小鼠,空腹12小时后进行剖杀。采用摘除眼球采血,用无RNA酶EP管接住流出的血液,静置1小时后,4℃3000r/min离心10分钟离心分离血清,取上层血清于新的无RNA酶2 mL EP管,冻存于-80℃冰箱。采用颈椎脱臼法处死小鼠,测量小鼠腹围,解剖并留取小鼠的小肠上段、小肠中段、小肠下段肠段及肌肉,游离并取出肝脏、胰腺、附睾脂肪、双肾周脂肪,对其称重并记录,对所取组织迅速装入无RNA酶EP管,置于液氮中保存,再转到-80℃冰箱保存备用。
1.2.3腹腔注射葡萄糖耐量试验(IPGTT)
饲养12周后,两组小鼠禁食水12小时后,分别于腹腔内注射50%葡萄糖溶液(含糖量为2g/kg),分别于注射后0、15、30、60、90、120分钟尾静脉采血(剪尾法)用罗氏血糖仪检测末梢血糖值。
1.2.4血清生化测定
按照生化按试剂盒说明书进行操作,全自动生化分析检测指标结果是仪器自动生成样本浓度,再按照说明书上的公式将样本吸光度换算成浓度,自动导出结果。
1.2.5miR-375的检测
按照Trizol LS、Trizol说明书分别抽提血清及各代谢组织细胞中的总RNA,紫外分光光度计检测提取的RNA浓度及纯度,-80℃冻存备用。反转录试剂盒说明书合成miR-375的cDNA。实时定量PCR试剂盒分析miR-375水平。以U6作为内参照,引物购自Servicebio公司。miR-375-RTCTCAACTGGTGTCGTG GAGTCGGCAATTCAGTTGAG TCACGCGA,miR-375-S:ACACTCCAGCTGG GTTTGTTCGTTCGGCTC。结果采用ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本);B=CT(目的基因,对照样本)-CT(内标基因,对照样本);K=A-B;表达倍数=2-K。
1.3实验数据统计分析
实验数据用Excel 2013进行初步统计、分析,采用SPSS 10.0统计软件分析数据,计量资料符合正态分布,结果采用“平均值±标准差”表示,对两组小鼠的体重、身长、血清生化、miR-375表达量等结果的比较使用独立样本t检验,对同一饲养组内不同组织标本之间miR-375表达量比较使用配对t检验,以P<0.05认为有统计学意义。
2结果
2.1体重变化
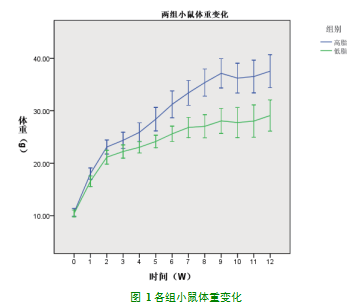
本实验以高脂组小鼠体重超过低脂组小鼠体重的20%为肥胖造模成功的标准。入组时,高脂组小鼠体重:10.34±0.87g,低脂组小鼠体重:10.57±0.69g,两组无统计学差异,高脂组小鼠饲养4周后,体重较低脂组增加明显(P<0.05),之后每周测定小鼠体重,体重差异逐渐增加,在饲养12周,高脂组小鼠体重:37.56±3.16g,低脂组小鼠体重:29.09±2.98g,高脂组的小鼠体重超过低脂组的20%,肥胖模型成功(图1)。
2.2各组小鼠腹围变化
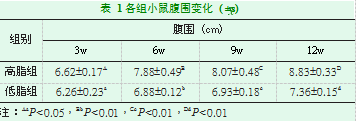
饲养3周后,高脂组小鼠腹围较低脂组的增加(P<0.05),之后每3周测定小鼠腹围,两组小鼠腹围差异持续存在(表1)。
2.3各组小鼠体内脂肪及脏器质量变化
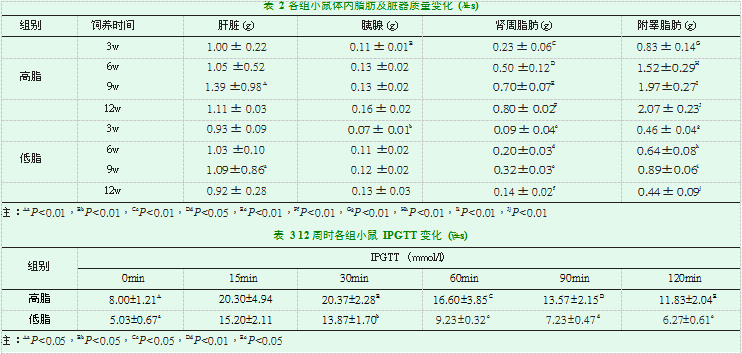
在不同饲养时间点解剖小鼠发现,高脂组小鼠肝脏外观较低脂组增大,色泽偏黄,但两组小鼠肝脏质量仅在第9周有差异(两组小鼠均第9周小鼠肝脏最重)。在饲养早期(3周),高脂组小鼠的胰腺质量较低脂组的增加较快(P<0.05),但随着饲养时间的增加,两组小鼠的胰腺质量并无统计学差异。至于脂肪,高脂组小鼠开腹后可见覆盖一层厚厚的白色脂肪,且随着饲养时间的增加而愈发明显,而低脂组小鼠的相对较少,其中肾周脂肪、附睾脂肪在喂养3周后,高脂组小鼠的较低脂组的增加明显(P<0.01),且高脂组的小鼠的肾周、附睾脂肪质量随着饲养时间呈进行性增加,但低脂饮食组附睾脂肪质量以饲养第9周最大(表2)。
2.4腹腔注射葡萄糖耐量试验(IPGTT)
高脂组小鼠空腹血糖高于6.8mmol/l,且IPGTT较低脂组亦升高明显(P<0.05),高脂组小鼠诊断肥胖合并糖尿病及糖耐量异常(表3)。
2.5各组小鼠代谢性物质变化
饲养3周后,两组小鼠的各个生化指标存在明显异常,TG(Triglyceride,甘油三酯)、LDL(low density lipoprotein,低密度脂蛋白)、TC(Total Cholesterol,总胆固醇)在高脂组小鼠明显高于低脂组(P<0.01),但HDL(high density lipoprotein,高密度脂蛋白)在高脂组小鼠的明显低于低脂组(P<0.01),且随着饲养时间的增加,差异持续存在。随着饲养时间的增加,各项生化指标趋于平稳,在低脂组尤为明显。但GLU(glucose,葡萄糖)在饲养初期,两组无统计学差异,随着饲养时间的延长,特别是9周以后,高脂组的空腹GLU明显高于低脂组的(P<0.01),并且差距持续增加。两组GSP(Glycated serum protein,糖化血清蛋白)无特殊变化(表4)。
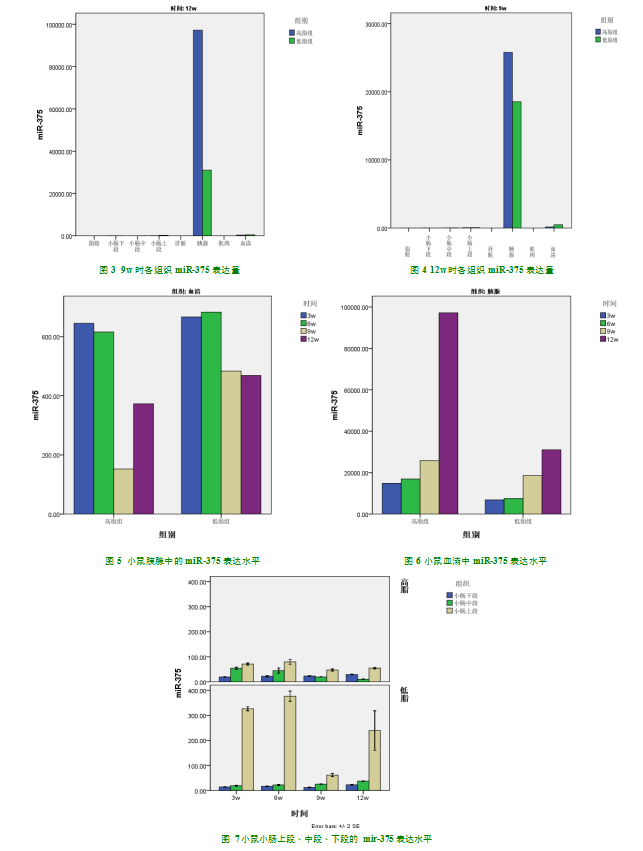
2.6miR-375表达水平
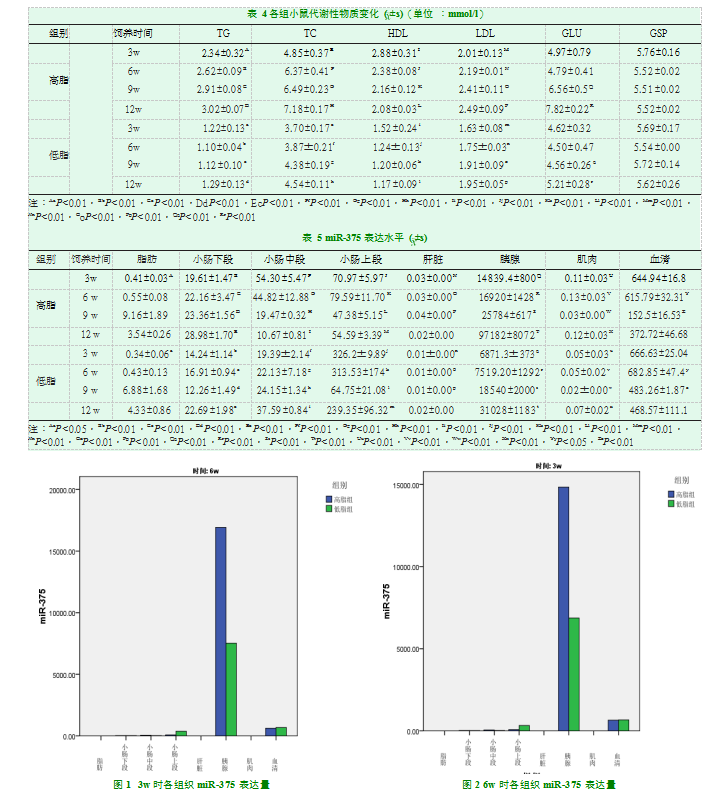
随着饲养时间的延长,不同饲养组别小鼠、不同生命阶段、不同代谢性组织、血清中的miR-375表达水平呈动态变化,部分组织的表达量随着饲养时间的延长增加,部分组织的表达量随着饲养时间的延长降低(表格5)。miR-375表达有明显的组织特异性,无论是在哪个生命阶段、哪种饲养条件下,即便是在同一只小鼠的不同组织器官中miR-375的表达水平存在着明显的差异,胰腺中的miR-375持续呈高表达状态,其次为血清、肠道组织,而肌肉、肝脏甚至是脂肪中的miR-375的表达水平均不高(表5,图1-4)。
两组小鼠胰腺中的miR-375表达水平均最高,高脂组小鼠胰腺的miR-375表达水平较低脂组的高(P<0.01),并且随着饲养时间的延长,高脂组小鼠胰腺的miR-375表达水平升高趋势愈发明显(图5)。miR-375在两组小鼠的血清中稳定表达,但与胰腺不同的是,miR-375在低脂组的表达较高脂组反而呈现高水平(P<0.01)(图6)。
本实验通过对小鼠小肠不同部位(上段、中段、下段)的miR-375的表达水平进行检测,发现不同饲养组、同一饲养组乃至同一只小鼠不同部位小肠的miR-375的表达量有不同(图7)。总体而言,高脂组小肠上段的miR-375的表达水平较低脂组的高,但在小肠中段及下段则成相反的现象(P<0.01)。随着饲养时间的延长,高脂组、低脂组小鼠的小肠下段miR-375的表达水平均有升高,而在小肠中段,高脂组小鼠的小肠的miR-375的表达水平呈下降趋势,但在低脂组的呈上升趋势。
3讨论
近年来,肥胖的流行趋势愈发严峻[14]。肥胖系一种多因素疾病,常见的有饮食因素、活动因素、遗传因素,近年来研究发现,宫内生长发育及生长发育轨迹、肠道菌群及维生素D的缺乏在肥胖的发生发展中亦起到重要的作用[15]。但是长期高脂高热量食物的摄入及活动减少是导致现代生活方式下肥胖发生的重要诱因,所以由高脂饮食诱导的肥胖动物模型得到了广泛的应用[16]。本实验釆用60%高脂饲料持续诱导同批次3周龄雄性C57BL/6小鼠,构建食源性肥胖模型,研究肥胖的发生机制。两组小鼠在相同饲养环境下,饲养12周后,高脂组小鼠体重:37.56±3.16g,低脂组小鼠体重:29.09±2.98g,高脂组体重超过低脂组29%,按照高脂组的小鼠体重超过低脂组的20%的标准,肥胖模型造模成功。
脂肪组织是机体的能量贮存器官,肥胖是机体脂肪组织的过度累积。依据脂肪组织在体内积聚的部位的不同,可将肥胖划分为皮下脂肪型肥胖以及腹型肥胖,而脂肪在腹腔内肠系膜、内脏器官以及主动脉周围囤积的肥胖成为腹型肥胖。在小鼠肥胖模型造模过程中,我们发现,随着饲养时间的延长,高脂组小鼠的体重较低脂组小鼠的增加愈发明显,但是高脂组小鼠的均体长与低脂组小鼠的差值却逐渐趋于稳定。而反应肥胖的另一个指标:腹围,却在两组小鼠体长稳定后差异愈发明显,同时监测两组小鼠腹腔脂肪,高脂组小鼠脂肪在体长稳定期增加的更迅速。有趣的是,两组的生化指标(TC)在此阶段差距亦有增加,并且,高脂组小鼠GLU及IPGTT在此阶段出现异常。可见腹型肥胖与血压、血脂、血糖的增高关系较为密切[17]。在本实验中,虽每次剖杀小鼠均有对小鼠血清的GLU及GSP进行检测,但未做到每次均有IPGTT,故在第9周出现高脂组小鼠的GLU升高,并无糖代谢的进一步检查,单纯的依靠GSP水平并不能及时、精确反应糖代谢的异常。肥胖的发生过程系机体逐渐突破自我调节能力,从代偿至失代偿的过程,在达到失代偿期,可伴有代谢指标的明显异常。另外,在造模过程中,高脂组小鼠的肝脏外观上虽较低脂组的增大,但两组小鼠的肝脏质量仅在饲养第9周存在差异,但高脂组小鼠肝脏色泽偏黄,低脂组小鼠的却呈鲜红色,高脂组小鼠肝脏脂肪堆积过度,亦可能是代谢指标明显异常的原因。
MiR-375最早发现于胰岛β细胞,在动物的胰岛中稳定表达并具有组织特异性,本实验通过RT-PCR手段检测高脂饮食诱导下生命不同阶段小鼠的外周血清、脂肪、肌肉、肝脏、胰腺和小肠等重要代谢性组织中miR-375的表达水平,发现miR-375在不同组织miR-375丰富度不同,在胰腺中表达水平最高,具有组织特异性[18]。尽管,所有小鼠胰腺的miR-375表达水平均很高,但不同饲养组小鼠胰腺的miR-375表达水平之间却存在差异,而且这种差异在小鼠代谢指标异常后更加明显,miR-375参与糖代谢的调节[19],并能反应机体代谢的异常程度,miR-375在肥胖相关代谢性相关疾病的诊断中有一定价值。
在体外诱导前体脂肪细胞分化成熟的过程中,无论是小鼠还是人类的前体脂肪细胞,miR-375的表达水平均升高[12][20],而在体内研究中,在ob/ob肥胖小鼠动物模型中,肥胖小鼠血清miR-375表达量显著升高[4],但在对比正常妊娠女性、妊娠期肥胖女性及妊娠合并肥胖女性的血浆中miR-375含量发现,miR-375在糖耐量正常的妊娠肥胖及妊娠合并肥胖的孕母中呈现低表达,而且miR-375在鉴别妊娠合并肥胖时,有较高的准确性,在本实验中,miR-375可在血清中稳定表达,在各代谢性组织中,表达水平仅次于胰腺,高脂组的血清miR-375表达水平较低脂组的低,这与Carreras-Badosa G等[21]的结果相符,这可能系血清中的miR-375的来源并不固定于胰岛,循环中很大部分的miR-375可能来源肾上腺、甲状腺、肺和胃肠道等神经内分泌细胞[22],而且在机体有无合并代谢综合征状态下,各组织分泌到血清的miR-375含量不同。
肠上皮细胞系暴露于肠腔的单层细胞,由肠道上皮干细胞、吸收细胞、肠内分泌细胞、杯状细胞等多种细胞类型组成[23],对机体有着重要的功能,包括屏障完整性,防止肠道腔内存在的有害毒素的侵袭,营养物质的消化和吸收,以及调节全身能量平衡的激素的产生[24]。不同的饮食诱导的小鼠的肠道细胞的分化倾向不同,肠壁细胞的优势细胞种类不同[25]。Liu S[26]等人发现小肠上皮细胞中含有丰富的microRNA(miRNA),并能分泌到肠道中并稳定存在,肠道上皮细胞miRNA表达受抑制或其受剖坏均会导致肠道菌群的变化。另有研究表明粪便miRNA移植可以帮助恢复肠道菌群[27]。而Knudsen[28]等人在研究转基因小鼠小肠肠隐窝及绒毛肠内分泌细胞miRNA表达水平发现miR-375表达程度无论在小鼠十二指肠还是在空肠的内分泌细胞表达较非内分泌细胞都增加明显,不同肠壁细胞的miR-375表达程度不同,且miR-375在肠内分泌细胞功能中起重要作用。而肠道上皮的miRNA的表达可以调节菌群的变化。在本实验中,在不同饲养组、同一饲养组乃至同一只小鼠不同部位小肠的miR-375的表达量均有不同。总体而言,高脂组小肠上段的miR-375的表达量较低脂组的较高,但在小肠中段及下段则成相反的现象(P<0.05)。随着饲养时间的延长,高脂组、低脂组小鼠的小肠下段miR-375的表达水平均有升高,而在小肠中段,高脂组小鼠的小肠的miR-375的表达水平呈下降趋势,但低脂组的呈上升趋势,这说明在不同饲养组、不同饲养时间、不同肠段的肠道内分泌细胞含量不同。多肽YY(peptide YY,PYY)的分泌是由肠内分泌细胞中的L细胞分泌的大小为36个氨基酸的多肽,在回肠末端、结肠、直肠含量最丰富[29,30],PYY可通过影响下丘脑控制小鼠的进食量,进而影响小鼠的能量摄入及体重[31]。胰高血糖素样肽-1(Glucagon-like peptide-1,GLP-1)也由L细胞分泌,主要富集在回肠及结肠,可以增强饱腹感减少能量摄入[32]。随着饲养时间的延长,低脂组小肠下段的(回肠)miR-375表达水平升高,故miR-375可能通过增加PYY、GLP-1的分泌,减缓低脂组小鼠体重的增加。而肠道菌群的存在已被证明对小肠的miRNA表达谱有影响[33],故肠道菌群失调亦可能通过调节miR-375表达水平,影响肥胖的发生。
4结论
1)60%的高脂饲料能在较短时间内建立C57BL/6小鼠的肥胖模型。
2)miR-375在机体不同组织的表达程度不同,在血清、胰腺中表达有特异性,在不同程度肥胖的诊治中有重要的价值。
参考文献
[1]Ng,Marie,Fleming,et al.Global,regional,and national prevalence of overweight and obesity in children and adults during 1980鈥3:a systematic analysis for the Global Burden of Disease Study 2013[J].Lancet,2014,384(9945):766-781.
[2]Colquitt JL,Loveman E,O’Malley C,et al.Diet,physical activity,and behavioural interventions for the treatment of overweight or obesity in preschool children up to the age of 6 years[J].Cochrane Database of Systematic Reviews,2016,3(3):CD012105.
[3]miR-375通过靶向PDK1抑制胎猪胰腺干细胞的增殖和分化[D].In:西北农林科技大学,2016.
[4]Poy MN,Jean H,Mirko T,et al.miR-375 maintains normal pancreatic alpha-and beta-cell mass[J].Proc Natl Acad Sci U S A,2009,106(14):5813-5818.
[5]Lei K,Junjie Z,Wenxia H,et al.Significance of serum microRNAs in pre-diabetes and newly diagnosed type 2 diabetes:a clinical study[J].Acta Diabetologica,2011,48(1):61-69.
[6]Hongmei Z,Siu Wai L.Identification of microRNA biomarkers in type 2 diabetes:a meta-analysis of controlled profiling studies[J].Diabetologia,2015,58(5):900-911.
[7]Villard A,Marchand L,Thivolet C,et al.Diagnostic Value of Cell-free Circulating MicroRNAs for Obesity and Type 2 Diabetes:A Meta-analysis[J].J Mol Biomark Diagn,2015,6(6).
[8]张伟,田文妍,陈卫昌.miR-375在胃癌中的表达及其与临床病理特征的相关性[J].苏州大学学报(医学版),2011,31(6):955-957.
[9]Zhang X,Yan Z,Zhang J,et al.Combination of hsa-miR-375 and hsa-miR-142-5p as a predictor for recurrence risk in gastric cancer patients following surgical resection[J].Annals of Oncology,2011,22(10):2257-2266.
[10]Michele A,Christensen BC,Kelsey KT,et al.MicroRNA expression ratio is predictive of head and neck squamous cell carcinoma[J].Clinical Cancer Research An Official Journal of the American Association for Cancer Research,2009,15(8):2850.
[11]Li LM,Hu ZB,Zhou ZX,et al.Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocarcinoma[A].In:中国小核酸技术与应用学术会议,2010.
[12]Hong-Yan L,Ge-Bo W,Shui-Dong F,et al.MicroRNA-375 promotes 3T3-L1 adipocyte differentiation through modulation of extracellular signal-regulated kinase signalling[J].Clinical&Experimental Pharmacology&Physiology,2011,38(4):239-246.
[13]张星星,李杨,周见至,等.3T3-L1前脂肪细胞分化过程中miRNAs基因的表达变化[J].中国药房,2013,(5):401-404.
[14]顾景范.《中国居民营养与慢性病状况报告(2015)》解读[J].营养学报,2016,38(6):525-529.
[15]张亚茹,杨琍琦.儿童肥胖症的研究进展[J].医学综述,2015,21(3):475-477.
[16]Bray GA,Popkin BM.Calorie-sweetened beverages and fructose:what have we learned 10 years later[J].Pediatric Obesity,2013,8(4):242-248.
[17]余佩玲,邹劲涛,胡世红.腹型肥胖与血压、血糖、胰岛素及血脂关系的研究[J].广西医科大学学报,2001,18(3):371-373.
[18]Poy MN,Lena E,Jan K,et al.A pancreatic islet-specific microRNA regulates insulin secretion[J].Nature,2004,432(7014):226-230.
[19]Kinoshita T,Nohata N,Yoshino H,et al.Tumor suppressive microRNA-375 regulates lactate dehydrogenase B in maxillary sinus squamous cell carcinoma[J].International Journal of Oncology,2012,40(1):185.
[20]Kraus M,Greither T,Wenzel C,et al.Inhibition of adipogenic differentiation of human SGBS preadipocytes by androgen-regulated microRNA miR-375[J].Molecular&Cellular Endocrinology,2015,414(C):177-185.
[21]Gemma CB,Alexandra B,Francisco-Jose O,et al.Altered Circulating miRNA Expression Profile in Pregestational and Gestational Obesity[J].J Clin Endocrinol Metab,2015,100(11):2015-2872.
[22]Mathieu L,Karolin H,Neil R,et al.miR-375 gene dosage in pancreaticβ-cells:implications for regulation ofβ-cell mass and biomarker development[J].Journal of Molecular Medicine,2015,93(10):1159-1169.
[23]Clevers H.The intestinal crypt,a prototype stem cell compartment[J].Cell,2013,154(2):274-284.
[24]Velasquez-Manoff M.Gut microbiome:the peacekeepers[J].Nature,2015,518(7540):3-11.
[25]Peck BC,Mah AT,Pitman WA,et al.Functional Transcriptomics in Diverse Intestinal Epithelial Cell Types Reveals Robust MicroRNA Sensitivity in Intestinal Stem Cells to Microbial Status[J].J Biol Chem,2017,292(7):2586-2600.
[26]Liu S,da Cunha AP,Rezende RM,et al.The Host Shapes the Gut Microbiota via Fecal MicroRNA[J].Cell Host Microbe,2016,19(1):32-43.
[27]Goodrich JK,Waters JL,Poole AC,et al.Human genetics shape the gut microbiome[J].Cell,2014,159(4):789-799.
[28]Knudsen LA,Natalia P,Schwartz TW,et al.The MicroRNA Repertoire in Enteroendocrine Cells:Identification of miR-375 as a Potential Regulator of the Enteroendocrine Lineage[J].Endocrinology,2015,156(11):3971-3983.
[29]Nilsson O,Bilchik AJ,Goldenring JR,et al.Distribution and immunocytochemical colocalization of peptide YY and enteroglucagon in endocrine cells of the rabbit colon[J].Endocrinology,1991,129(1):139-148.
[30]Tatemoto K,Jörnvall H,Mcdonald TJ,et al.Isolation and primary structure of human PHI(peptide HI)[J].Febs Letters,1984,174(2):258-261.
[31]Yan-Chuan S,Zhou L,Jackie L,et al.PYY3-36 and pancreatic polypeptide reduce food intake in an additive manner via distinct hypothalamic dependent pathways in mice[J].Obesity,2013,21(12):E669-E678.
[32]Flint A,.,Raben A,Astrup A,et al.Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans[J].Journal of Clinical Investigation,1998,101(3):515-520.
[33]Guillaume D,Thi Thu NH,Yutao Y,et al.Microbiota modulate host gene expression via microRNAs[J].Plos One,2011,140(5):S-663-S-663.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/16626.html