SCI论文(www.lunwensci.com):
摘要:冠心病是全球人口死亡的主要原因,对人民健康产生了巨大的威胁。高脂血症则是冠心病的重要危险因素之一,也是其重要病理基础。他汀类药物是目前全球公认的可有效降低冠心病发病率和死亡率的一线药物,ApoE 是一种多态蛋白质,参与脂质的储存、运输及排泄,具有明显的多态性,因此人群中的血脂水平差异可能部分与APOE 的基因多态性相关。有机阴离子转运体 (OATP1B1) 主要存在于人体肝脏的基底膜外侧,可将他汀类药物由血液转运至肝细胞内,编码基因是 SLCO1B1。因此,人群中药物作用的个体差异可能是 SLCO1B1 的基因多态性改变 OATP1B1 的转运功能引起。探讨人群基因多态性可以更好地了解心血管疾病的发病机制, 寻找相关疾病的潜在治疗靶点,指导个体化用药。
关键词:ApoE;SLCO1B1;他汀类药物
本文引用格式:田余, 赵瑞平. ApoE 及SLCO1B1 基因多态性与他汀类药物的研究进展[J]. 世界最新医学信息文摘,2018,18(72):153-155.
Research Progress of ApoE and SLCO1B1 Gene Polymorphisms and Statins
TIAN Yu1, ZHAO Rui-ping2*
(1. Inner Mongolia Medical University, Hohhot Inner Mongolia; 2. Department of Cardiology, Baotou Central Hospital, Baotou Inner Mongolia)
ABSTRACT: Coronary heart disease is the main cause of global population death and poses a great threat to people’s health. Hyperlipidemia is an important pathological basis of this type of disease and one of the important risk factors for coronary heart disease. Statins are currently recognized as the first-line drugs that can effectively reduce the incidence and mortality of coronary heart disease. Apolipoprotein E (ApoE) is a polymorphic protein involved in the storage, transportation, and excretion of lipids. As a result, differences in lipid levels in the population may be related to ApoE gene polymorphisms. The organic-anion transporter( OATP1B1) is mainly found on the outer side of the basement membrane of the human liver. It transports statins from the blood to the liver cells, it’s coding gene is SLCO1B1. Therefore, individual differences in drug response within the population may be caused by SLCO1B1 gene polymorphisms that alters the transport function of OATP1B1. Exploring population gene polymorphisms can better understand the pathogenesis of cardiovascular diseases and find potential therapeutic targets for related diseases and guide individualized medication.
KEY WORDS:ApoE; SLCO1B1; Statins
0引言
根据我国流行病学调查,中国成人血脂异常总体患病率在 2012 年高达 40.40%,较 10 年前呈大幅度上升,而血清总胆固醇(TC)水平的升高将导致未来中国心血管病事件增加约 920 万 [1]。低密度脂蛋白胆固醇(LDL-C)或 TC 升高为特点的血脂异常是动脉粥样硬化性心血管疾病(ASCVD)重要的危险因素,因此降低 LDL-C 水平,可显著减少 ASCVD 的发病及死亡危险 [1]。LDL-C 每降低 1mmol/L(38mg/dL), 患主要心血管事件的风险可降低 20%,全因死亡率可降低10%, 而非心血管事件引起的死亡率并未增加。他汀类药物又称为 3- 羟甲基 -3- 甲基戊二酰辅酶 A (HMGCoA) 还原酶抑制剂,近 20 多年来的众多大规模临床试验结果显示,他汀类药物在 ASCVD 一级和二级预防中均能显著降低心血管事件风险,是防治此类疾病最为重要的药物。然而不同的他汀在化学结构上虽有相似之处,但它们在药代动力学 ( 吸收、结合血浆蛋白、代谢和溶解度 )、与其他药物相互作用、药物疗效以及他汀导致的不良反应方面存在个体间的差异,而这些差异部分是归因于常见药物基因的遗传与变异,载脂蛋白 E(ApoE)和 SLCO1B1 基因则是近年来研究最多的热点基因。
1他汀类药物
冠心病 (CHD) 及其并发症是造成世界人口死亡的主要原因,他汀类药物在 CHD 的一级和二级防治中不可或缺的地位已得到临床试验的证实。目前市面上已有十余种他汀类药物,通过发挥多种作用使患者受益。
1.1他汀的作用
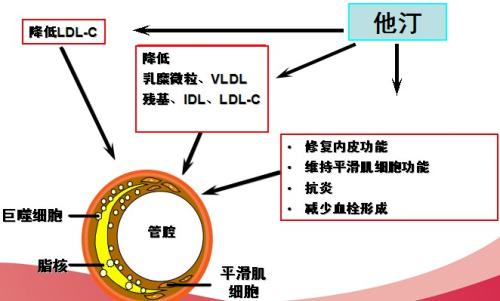
1.1.1降低 TC、LDL-C 和甘油三酯 (TG),轻度上调 HDL-C
他汀类药物是通过抑制 HMG-CoA 还原酶活性来抑制甲羟戊酸合成,从而减少胆固醇的合成,上调肝细胞膜上 LDL受体数目,增加 LDL 受体介导的 LDL 和 IDL( 中间密度脂蛋白 ) 的清除,从而使 LDL-C 和极低密度脂蛋白(VLDL)的合成下降 [2]。他汀类药物可降低 55% 的 LDL-C 的水平,降低20-30% 的心血管事件 [3]。同时,普伐他汀和辛伐他汀还可降低 TG 水平 [4,5]。他汀还有上调 HDL-C 水平的作用 [6] 且瑞舒伐他汀和辛伐他汀的效果优于阿托伐他汀 [7]。
1.1.2改善内皮细胞功能,提高内皮 NO 含量,控制和减慢斑块进展 [4]
他汀类药物可通过激活内皮细胞上的NO 合成酶(eNOS) 的磷酸化,使大量的 NO 合成并释放来改善内皮功能。Zemankova L 等人的研究证实,阿托伐他汀能够通过增加内皮糖蛋白从而使 eNOS 表达,从而使小鼠的动脉粥样硬化斑块保持稳定甚至减少 [8];同时,Leenders Geert J 等人的最新实验表明,他汀类药物降低了细胞渗透性,减少了不利的炎性细胞的转运,从而调节血管内皮屏障功能来促进心肌梗死后的血管内皮愈合 [9]。
1.1.3减少氧化应激和炎症
他汀能够抑制许多炎症因子的表达和降低许多血清炎症标志物,对炎症反应过程各阶段有抑制作用,如降低 C 反应蛋白(CRP)浓度、抑制白细胞 - 内皮细胞黏附和影响许多炎症因子产生等 [10]。
1.1.4温和的降压作用
他汀类药物本身也有降低血压的作用,尤其在控制不佳的高血压患者身上作用明显。一些动物研究表明,瑞舒伐他汀不仅可以使大鼠的自发性高血压降低,还可使 CRP 所诱导的内皮功能障碍和高血压也降低,这些似乎与他汀的内皮保护和抗氧化作用有关 [11,12]。
1.2 他汀的不良反应
虽然他汀的治疗是有效的,但仍存在一小部分患者的依从性较差,主要与他汀引起的副作用有关。在文献中,有许多着重探讨他汀类药物临床疗效与他汀不良反应的研究。
1.2.1肌肉相关问题
他汀引起的副作用中最重要、最常见的是导致肌病、肌痛、肌炎,罕见的还可引起横纹肌溶解症,通常肌痛症状发生在他汀类药物治疗后的前 6 个月,而在剂量降低或停药后消失。观察性研究表明,10%-15% 的患者在治疗期间可能会有肌肉疼痛 [4,13]。此类症状的发生具有重要的临床意义,因为它们可能影响患者的生活质量,并导致对可能挽救生命的药物的依从性下降。虽然肌病发展的确切机制尚不明确,但更广泛地认为临床疗效和不良反应的发展与他汀类药物的肝内运输和血浆浓度有关。
1.2.2增加糖尿病的风险
一项荟萃分析发现,他汀类药物的长期使用与糖尿病的发病率有显著的相关性 [14]。尽管有此项重要的发现,但文中作者强调了他汀类药物在保护高脂血症患者严重心脏疾病方面的重要作用,进一步表明他汀类药物的益处远超过了糖尿病增加的风险,因此无论糖尿病或非糖尿病患者,有高脂血症者均应服用他汀类药物。
1.2.3引起肝酶的异常
Naci H 等人的 meta 分析中表明高剂量的氟伐他汀、阿托伐他汀、洛伐他汀和辛伐他汀与高转氨酶升高的几率有关 [15]。
1.2.4其他可能的副作用包括认知丧失、神经病变、胰腺、肝脏和性功能障碍 [4,16,17]。
2载脂蛋白 E(ApoE)
ApoE 是一种血浆蛋白,参与脂质代谢和胆固醇及甘油三酯的转运。人类 APOE 基因位于 19q13.2 染色体上,有两个常见的非同义多态性 (rs429358 和 rs7412),它们共同产生三个不同的 ApoE 等位基因 (2,3,4); 这些等位基因依次形成六种可能的基因类型 :e2/e2, e2/e3, e2/e4, e3/e3, e3/e4, e4/e4[18,19]。ApoE 基因多态性已被证实影响了 ApoE 基因转录和血清 TC、TG 水平,从而改变动脉粥样硬化的进展,是 CAD 的重要病理基础。近年来,各种基因流行病学的研究多集中在 ApoE 基因多态性与 CAD 及他汀疗效之间的关系。
2.1 ApoE 基因多态性与冠心病
大量中外研究表明 ApoE 基因的 e4 等位基因是中国人口患 CHD 的独立危险因素。Song Y 研究发现,与 e3 纯合子相比含 e2 等位基因的个体具有较低的 TC 水平和较高的 TG 水平,而含 e4 等位基因的个体似乎有较高的 TC 和 LDL-C 水平 [19], 这些血脂水平的差异导致 e4 携带者患 CHD 的风险比其他等位基因高;一项包含 40 余项研究的 meta 分析表明 e4 等位基因携带者患 CHD 的风险比其他等位基因的人群高出2.11 倍 [20];此外,e2/e4 基因型、e3/e4 基因型和 e4/e4 基因型的人群与 e3/e3 基因型人群相比,CHD 的发病率显著升高。
2.2 ApoE 基因多态性与他汀类药物疗效
多数研究表明,携带 e2 等位基因的人群服用他汀类药物的降脂疗效更明显,相反的,携带 e4 等位基因的人群降脂疗效最差。Kirac D 等人的研究中,100 名 CAD 患者使用 40mg阿托伐他汀治疗 2 个月,重复进行生化测定,采用 RT-PCR 方法测定 ApoE 基因型,根据治疗后 LDL-C 水平,患者被分为无效组和有效组,发现 ApoE 的e4 突变型主要见于无效组[21]。这一结论与 Zintzaras E 等人的实验结论相似,e2 等位基因携带者对他汀类药物治疗 TC 和 LDL-C 有更好的降脂疗效,比e3/e3 纯合子和e4 携带者更好[22]。然而,存在一些不同的观点。Hu M 等人研究表明,在中国人群中 ApoE 基因多态性仅与血脂基线水平相关,而与瑞舒伐他汀的降脂效果无关 [23]。
3 SLCO1B1
他汀类药物首先通过门静脉输送到肝细胞膜的磷脂双层膜上,从而降低胆固醇在肝脏的合成,这种输送主要依靠有机阴离子转运多肽 1B1(OATP1B1) 转运体的作用,这种输送作用是在人类肝细胞的基底外侧膜上表达的。OATP1B1 由SLCO1B1( 染色体 12p12.2) 编码,对许多内源性及外源性物质的肝吸收和清除至关重要,其中包括胆汁酸、甲状腺激素和甲氨喋呤,还可以运输许多他汀类药物,包括阿托伐他汀、角伐他汀、普伐他汀和瑞舒伐他汀。SLCO1B1 具有高度多态性是对他汀类药物反应的重要预测因子,因为它们能够诱导血浆药物浓度的变化。近年来研究多集中在 c.521T>C 和c.388A>G 两个位点与他汀类药物相关性,并且结论颇具争议。SLCO1B1 521T>C 有 TT(野生型)、TC(杂合突变)、CC(纯合突变)三种基因型。SLCO1B1 388A>G 有 AA(野生型)、AG(杂合突变)、GG(纯合突变)三种基因型。
3.1SLCO1B1 与血浆药物浓度
SLCO1B1 c.521T>C (SLCO1B1*5,rs4149056) 导致第 174个位置上发生丙氨酸替代,导致转运体活性降低,使他汀类药物的血浆浓度升高,减弱了降低 LDL-C 的效果。有研究证实,SLCO1B1 c.521T>C 突变型确实会对辛伐他汀的药代动力学产生影响,但影响较小 [24];而对阿托伐他汀和瑞舒伐他汀的药代动力学影响较大,且与亲水性的瑞舒伐他汀相比, 对亲脂性的阿托伐他汀的影响更大 [25]。Alice C. Rodrigues 的研究证实,针对 SLCO1B1 388A>G 位点,纯合突变 GG 基因型增强了阿托伐他汀的降脂疗效 [26]。SLCO1B1 c.521T>C 含 C 等位基因较野生型 TT 基因型的人群服用普伐他汀降总胆固醇作用较弱,瑞舒伐他汀 CC 突变型与野生型 TT 相比药物消除作用更慢(参考文献)。
3.2SLCO1B1 与他汀所致肌病
之后的一项研究证明了突变型 CC 基因型对辛伐他汀的血浆药物浓度高于野生型 TT 基因型,表明了在辛伐他汀治疗期间,521C 等位基因可能增加他汀不良反应的风险,同时降低辛伐他汀的降胆固醇效果 [27]。血浆药物浓度、SLCO1B1 基因多态性与他汀所致肌病有很大关系,Link E 研究中,175例接受辛伐他汀治疗(80mg/ 日)的患者,SLCO1B1 521C 携带者发生他汀类肌病几率更高;TC 和 CC 基因型患他汀所致肌病的风险分别为野生型的4.5 和 16.9 倍 , 而在接受辛伐他汀治疗(40mg/ 日)的患者,TC 和 CC 基因型患他汀所致肌病的风险分别为野生型的2.6 和5.2 倍[28,29]。Liu Ju-E 研究表明, 在中国人群中,SLCO1B1 521T>C 与冠状动脉疾病明显相关,且SLCO1B1 521C 突变型等位基因增加了瑞舒伐他汀所致肌毒性的风险,然而在本研究中,SLCO1B1 521T>C 多态性与辛伐他汀及阿托伐他汀所致肌毒性没有显著关系,SLCO1B1388A>G 位点的基因多态性与他汀所致肌毒性之间没有显著的关系 [30]。
4结论
综上所述,关于基因多态性与他汀类药物的研究仍在探索和研究阶段,一些学者的研究对象中包含了许多混杂因素,例如在临床诊断、共病、多药、环境因素、其他药物相关基因、代谢酶和药物干预方面可能有显著差异,因此会对结果产生偏倚,今后的研究中应该尽量多的增加基线资料的比较,减少混杂因素的干扰,从而使结论更加可靠。另外,基因多存在种族差异性,在未来研究中,大样本含量的研究是必要的,不同地域、人种、人群、少数民族的基因多态性同样需要进一步对比研究。他汀类药物是心血管疾病药物治疗的基石,相信未来会设计一个可高度预测的遗传模型对他汀类药物疗效性和安全性进行可靠的预判,从而更好的指导他汀类药物个体化治疗,实现精准医疗,使基因检测服务于心血管疾病的防治。
参考文献:
[1]诸骏仁 . 中国成人血脂异常防治指南 _2016 年修订版 .
[2]李琦文 . HMG-CoA 还原酶抑制剂 - 他汀类药物的作用及机制 [J]. 中国现代药物应用 , 2014,(17):228-229.
[3]Postmus I, Trompet S, Deshmukh HA, et al. Pharmacogenetic meta-analysis of genome-wide association studies of LDL cholesterol response to statins[J]. Nat Commun,2014,5:5068.
[4]Arrigoni E, Del M R, Fidilio L, et al. Pharmacogenetic Foundations of Therapeutic Efficacy and Adverse Events of Statins:[J]. International Journal of Molecular Sciences, 2017, 18(1).
[5]Paoletti R, Fahmy M, Mahla G, et al. Rosuvastatin demonstrates greater reduction of low-density lipoprotein cholesterol compared with pravastatin and simvastatin in hypercholesterolaemic patients: a randomized, double-blind study[J]. Journal of Cardiovascular Risk, 2001, 8(6):383.
[6]Fergus M T, Peter J. Effects of Statins on High-Density Lipoproteins: A Potential Contribution to Cardiovascular Benefit[J]. Cardiovascular Drugs & Therapy, 2008, 22(4):321-338.
[7]Barter P J, Brandrupwognsen G, Palmer M K, et al. Effect of statins on HDL-C: a complex process unrelated to changes in LDL-C: analysis of the VOYAGER Database[J]. Journal of Lipid Research, 2010, 51(6):1546.
[8]Zemankova L, Varejckova M, Dolezalova E, et al. Atorvastatin-induced endothelial nitric oxide synthase expression in endothelial cells is mediated by endoglin[J]. Journal of Physiology & Pharmacology An Official Journal of the Polish Physiological Society, 2015, 66(3):403.
[9]Leenders Geert J,Smeets Mirjam B,van den Boomen Maaike et al. Statins Promote Cardiac Infarct Healing by Modulating Endothelial Barrier Function Revealed by Contrast-Enhanced Magnetic Resonance Imaging[J].Arterioscler. Thromb. Vasc. Biol., 2018, 38(1): 186-194.
[10]Halcox J P, Deanfield J E. Beyond th e laboratory: clinical implications for statin pleiotropy[J]. Circulation, 2004, 109(21):II42.
[11]Strazzullo P, Kerry S M, Barbato A, et al. Do Statins Reduce Blood Pressure? A Meta-Analysis of Randomized, Controlled Trials[J]. Hypertension, 2007, 49(4):792-798.
[12]Sicard P, Delemasure S, Korandji C, et al. Anti-hypertensive effects of Rosuvastatin are associated with decreased inflammation and oxidative stress markers in hypertensive rats[J]. Free Radical Research, 2008, 42(3):226-36.
[13]Harper CR, Jacobson TA. The broad spectrum of statin myopathy: from myalgia to rhabdomyolysis[J]. Curr Opin Lipidol 2007, 18: 401-408.
[14]Rahal A J, Elmallah A I, Poushuju R J, et al. Do statins really cause diabetes?: A meta-analysis of major randomized controlled clinical trials[J]. Saudi Medical Journal, 2016, 37(10):1051.
[15]Naci H, Brugts J, Ades T. Comparative Tolerability and Harms of Individual Statins[J]. Circ Cardiovasc Qual Outcomes, 2013, 6(4):390-399.
Golomb B A, Evans M A. Statin Adverse Effects: A Review of the Literature and Evidence for a Mitochondrial Mechanism[J]. Am J Cardiovasc Drugs,2008, 8(6):373-418.
[17]Mancini G B J, Tashakkor A Y, Baker S, et al. Diagnosis, prevention, and management of statin adverse effects and intolerance: Canadian Working Group Consensus update[J]. Canadian Journal of Cardiology,2013,29(12):1553-68.
[18]Khan TA, Shah T, Prieto D, et al. Apolipoprotein E genotype, cardiovascular biomarkers and risk of stroke: systematic review and meta-analysis of 14,015 stroke cases and pooled analysis of primary biomarker data from up to 60,883 individuals[J]. Int J Epidemiol,2013,42(2): 475-92.
[19]Song Y, Stampfer MJ, Liu S. Meta-analysis: apolipoprotein E genotypes and risk for coronary heart disease[J]. Ann Intern Med,2004,141: 137-147.
[20]Yin YW, Sun QQ, Zhang BB, et al. Association between apolipoprotein E gene polymorphism and the risk of coronary artery disease in Chinese population: evidence from a meta-analysis of 40 studies[J]. PLoS One,2013,8(6): e66924.
[21]Kirac D,Bayam E,Dagdelen M et al. HMGCR and ApoE mutations may cause different responses to lipid lowering statin therapy[J] .Cell. Mol. Biol. (Noisy-le-grand), 2017, 63(10): 43-48.
[22]Zintzaras E, Kitsios G D, Triposkiadis F, et al. APOE gene polymorphisms and response to statin therapy[J]. Pharmacogenomics Journal, 2009, 9(4):248.
[23]Hu M, Mak V W L, Tomlinson B. Polymorphisms in apolipoprotein E and apolipoprotein A-V do not influence the lipid response to rosuvastatin but are associated with baseline lipid levels in Chinese patients with hyperlipidemia[J]. Journal of Clinical Lipidology, 2012, 6(6):585.
[24]Rodrigues A C. Efflux and uptake transporters as determinants of statin response, Expert Opinion on Drug Metabolism & Toxicology, Informa Healthcare[J]. Expert Opin Drug Metab Toxicol, 2010, 6(5):621-632.
[25]Pasanen M K, Fredrikson H, Neuvonen P J, et al. Different Effects of SLCO1B1, Polymorphism on the Pharmacokinetics of Atorvastatin and Rosuvastatin[J]. Clinical Pharmacology & Therapeutics, 2007, 82(6):726–733.
[26]Rodrigues Alice C,Perin Paula M S,Purim Sheila G, et al. Pharmacogenetics of OATP transporters reveals that SLCO1B1 c.388A>G variant is determinant of increased atorvastatin response[J] .Int J Mol Sci, 2011, 12(9): 5815-27.
[27]Tornio A, Vakkilainen J, Neuvonen M, et al. SLCO1B1 polymorphism markedly affects the pharmacokinetics of lovastatin acid[J]. Pharmacogenetics & Genomics, 2006, 16(12):873-879.
[28]王瑾 , 陈韬 , 刘连 , 等 .ApoE 和 SLCO1B1 基因多态性与冠心病的相关性 [J/OL]. 心脏杂志 ,2018(02):150-153.
[29]Link E, Parish S, Armitage J, et al. SLCO1B1 variants and statininduced myopathy--a genomewide study[J]. N Engl J Med, 2008,359(8):789–799.
[30]Liu Ju-E,Liu Xiao-Ying,Chen Sheng, et al. SLCO1B1 521T > C polymorphism associated with rosuvastatin-induced myotoxicity in Chinese coronary artery disease patients: a nested case-control study[J] .Eur. J. Clin. Pharmacol., 2017, 73(11): 1409-1416.
《ApoE及SLCO1B1基因多态性与他汀类药物的研究进展论文》附论文PDF版下载:
http://www.lunwensci.com/uploadfile/2018/1031/20181031031102497.pdf
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/1382.html