SCI论文(www.lunwensci.com):
摘要:目的 探讨肺结核(Tuberculosis, TB)肉芽肿的基因表达和生物学过程的改变,为肺结核肉芽肿形成与发展的分子机制研究提供生物信息学依据。方法 从基因表达综合数据库(Gene Expression Omnibus, GEO)下载肺结核肉芽肿的基因芯片数据集,应用生物信息学方法筛选差异表达基因,利用 R 语言 clusterProfiler 包进行基因本体论(Gene ontology, GO)及通路富集分析。结果 共获得4762 个差异表达基因,包括 4359 个上调基因和 223 个下调基因。差异表达基因主要涉及嗜中性粒细胞活化、嗜中性粒细胞脱颗粒等生物反应过程,介导抗原肽结合、肽结合等分子功能,富集于溶酶体腔、FCN1 颗粒等。通过 STRING 数据库分析蛋白互作网络的中心节点蛋白,寻找关键(hub)基因。结论 ITGAM、PLAU、SERPINE、MAPK1、CXCR4、STAT1、CXCL9、IL8、MMP9、MMP1 是肺结核肉芽肿的最相关特征基因,吞噬体、溶酶体、抗原提呈等信号通路与肉芽肿形成与发展密切相关,为我们下一步研究提供重要线索。
关键词:肺结核肉芽肿;分子机制;差异表达基因;生物信息学
本文引用格式:张娜娜 , 曹华 , 解琪琪 , 等 . 肺癌合并肺栓塞临床特点回顾性分析 [J]. 世界最新医学信息文摘,2018,18(72):39-41.
Bioinformatics Analysis of Relevant Gene Arrays in Pulmonary Tuberculosis Granuloma
ZHAGN Na-na1, CAO Hua1, XIE Qi-qi2, WAN Yi-xin2*
(1.Department of Respiratory, Second Hospital of Lanzhou University, Lanzhou Gansu;
2. Department of Orthopaedics, Second Hospital of Lanzhou University, Lanzhou Gansu)
ABSTRACT: Objective To investigate the gene expression and biological process of tuberculosis (TB) granuloma, provide bioinformatics basis for the molecular mechanism of tuberculosis granuloma formation and development. Methods Downloaded the gene chip dataset of tuberculosis granuloma from Gene Expression Omnibus (GEO), the method of bioinformatics was used to screen differentially expressed genes, and R language clusterProfiler package was used for gene ontology (GO) and path Enrichment analysis. Results A total of 4762 differentially expressed genes were obtained, including 4359 up-regulated genes and 223 down-regulated genes. Differentially expressed genes are mainly involved in neutrophil activation, neutrophil degranulation and other biological processes, mediating peptide binding, serine-type binding and other molecular functions, enrichment in lysosomal cavity, FCN1 particles and so on. The central node protein of the protein interaction network was analyzed by the STRING database to find the key gene. Conclusion ITGAM, PLAU, SERPINE, MAPK1, CXCR4, STAT1, CXCL9, IL8, MMP9 and MMP1 are the most relevant genes of pulmonary tuberculosis granuloma. The signaling pathways such as phagosome, lysosome and antigen presentation are closely related to the formation and development of granuloma. providing important clues for our next study.
KEY WORDS: Tuberculosis granuloma; Molecular mechanism; Differentially expressed genes; Bioinformatics
0引言
肺结核(Tuberculosis, TB)是一种由结核分枝杆菌感染肺脏所引起的具有传染性的慢性疾病,在全世界广泛流传, 据 2016 年统计,全球每年约有 170 万人死于肺结核 [1],为全球 10 大死因之一。结核杆菌(Mycobact,erium tuberculosis,Mtb)感染不久之后,感染部位会形成肉芽肿,其结构包括核心的干酪样坏死组织,坏死灶周围的上皮样细胞、朗汉斯巨细胞,以及外层的淋巴细胞 [2]。此时,感染机体处于潜伏状态,无明显疾病征兆。而 5%-10% 潜伏感染者会在 2-3 年内进展为活动性肺结核,引起 Mtb 的播散与传播 [3],其传染性强,死亡率高。目前大量研究集中在免疫角度解释肺结核肉芽肿的发生的机理 [4-6],而对其分子机制研究甚少。生物信息学作为一门新的学科领域,从核酸及蛋白序列层面解释疾病形成的可能分子机制,为实验研究提供可行的思路 [7]。本文通过生物信息学相关方法对 Kim M 等构建的肺结核肉芽肿芯片数据进行重新分析,以探讨基因对肺结核肉芽肿的调节,从分子水平揭示其发生发展机制。
1材料与方法
1.1材料
从 NCBI 的 GEO 数据库下载数据集 GSE20050,基 于GPL1352 平台 [U133_X3P] Affymetrix Human X3P Array,表达数据为 Expression profiling by array,种属 Homo sapiens。该芯片数据包括 5 例干酪样肉芽肿及 2 例正常肺组织提取总RNA 进行基因芯片分析;本研究通过生物信息学分析其肺结核肉芽肿干酪样坏死组织及正常肺组织的基因芯片数据。
1.2数据处理及差异表达基因的筛选
原始数据用 R 语言软件包分析将原始文件通过 RMA 算法对原始数据进行背景校正、bootstrap 校正、质量控制和标准化处理,并转化为探针表达矩阵,后根据 GPL1352 平台文件所对应的 R 语言软件包将探针名转化为基因名;通过 R 语言 limma 包筛选出差异表达基因,差异表达基因同时满足|log2 fold change(log2FC)|>2 且 P<0.01。利用 R 语言 gplots 包绘制热图,直观地展示每个差异基因在每个样本中的表达情况。
1.3差异表达基因的基因本体论和通路富集分析
基因本体论(Gene ontology, GO)可以注释基因和蛋白质功能,有利于集中研究感兴趣的方向,发现新的现象。我们利用 R 语言 clusterProfiler 包对差异表达基因进行 GO 和KEGG 通路富集分析 [8, 9]。P<0.01 和 FDR<0.05 设定为显著性基因富集的临界值。
1.4共表达分析
通过 STRING(Version:10.5)在线软件(https://string-db.org/)以及 Cytoscape 插件 cytoHubba 对肺结核肉芽肿显著差异基因进行蛋白质 - 蛋白质相互作用网络分析(PPI 分析),寻找关键基因(Hub 基因)。
2结果与分析
2.1数据处理和差异基因筛选
通过对两组差异表达基因数据标准化及处理,基因芯片数据经标准化后以 Vioplot 图形式呈现(如图 1A)。图 1A 基本在同一水平,表明一致性较高。经数据预处理后,R 软件共筛选 4762 个差异表达基因(肉芽肿组 / 正常对照组),其中包括 4539 个上调基因和 223 个下调基因,以火山图形式呈现(如图 1B);用最上调和最下调的 100 个基因(以 |logFC|数值大小为标准)做热图(如图 2 所示),其中红色代表上调基因,绿色代表下调基因。可见两组样本基因表达具有显著差异;上调基因主要包括 PAG1、ADA2、CXCR4、CCL18、SLC50A1、LIPA、MFSD1、FEZ2 等,下调基因 INMT、FMO2、SFTPC、SFTPC、ADH1B、MGP、SFTPC、TMEFF2、SFTPC 等。
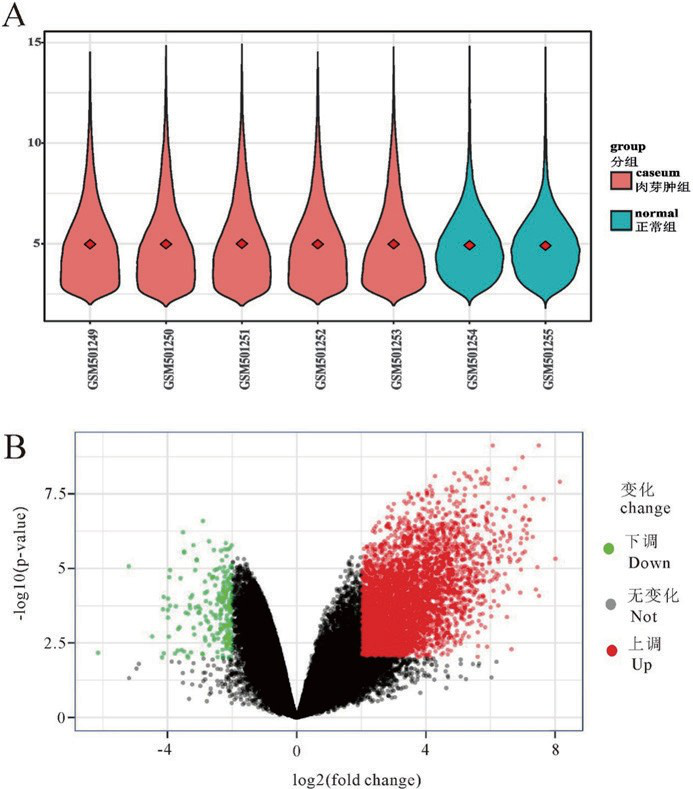
图 1 A :标准化之后的基因表达数据 vioplot ;B :差异基因火山图
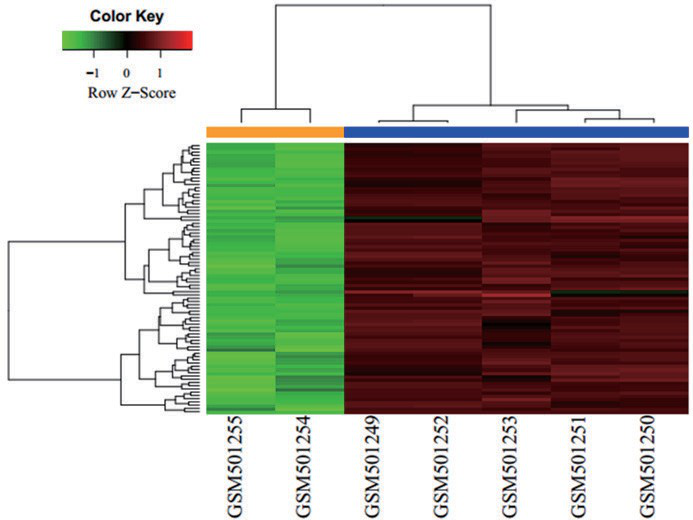
图 2 差异基因热图分析
2.2GO 和 KEGG 通路富集分析
GO 包括以下 3 个生物学部分:生 物过 程(biological process, BP),细胞组成(cellcular component, CC)和分子功能(molecular function, MF)。采用 R 语言 clusterProfiler 包对 4762 差异基因进行 GO 功能富集分析,选取前 16 位的功能富集类别。如图 3 所示,差异基因主要涉及中性粒细胞活化、嗜中性粒细胞脱颗粒、嗜中性粒细胞相关免疫反应等生物过程,介导抗原肽结合以及肽结合等分子功能,富集于胞内区;通路富集分析结果显示差异基因主要涉及吞噬体、溶酶体、结核通路、抗原提呈等经典信号通路。
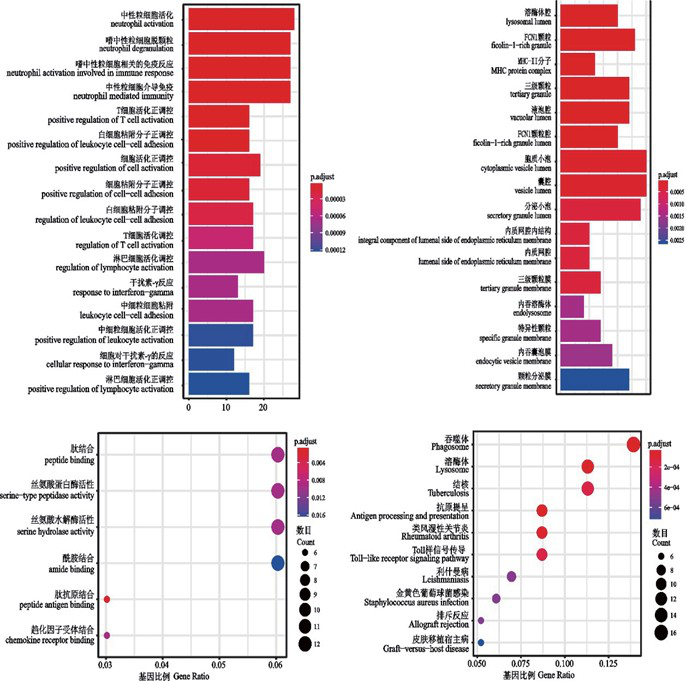
图 3 差异基因 GO 分析及通路富集分析
2.3差异表达编码蛋白质间相互网络分析
STRING 是一个由已知和预测的蛋白质相互作用数据组成的数据库,本研究将显著差异基因前 100(以 |logFC| 数值大小为标准)输入 STRING 工具,然后将所得数据导入 Cytoscape 中,利用插件 CytoHubba 找出 ITGAM、PLAU、SERPINE、MAPK1、CXCR4、STAT1、CXCL9、IL8、MMP9、MMP1 为所得 hub 基因。
3讨论
近年来,关于肺结核肉芽肿组织样本的基因组学、转录组学和蛋白组学在分子机制研究中较热 [10-12]。本研究的基因芯片数据集来源于 GEO 数据库,我们利用生物信息学方法比较肺结核芽肿干酪样组织和正常肺组织样本的差异基因表达,共筛选出 4726 个差异基因,其中包括 4539 个上调基因和 223 个下调基因。
ITGAM、PLAU、SERPINE、MAPK1、CXCR4、STAT1、CXCL9、IL8、MMP9、MMP1,为所得的 hub 基因。目前关于ITGAM、MAPK1、CXCR4、STAT1、IL8、MMP9、MMP1 基因在肺结核病中研究较多,且机制较明确。ITGAM 主要表达于中性粒细胞和单核细胞,是一种主要的白细胞表面抗原家族。早在 1998 年,Ernst 发现 ITGAM 是 Mtb 进入巨噬细胞的受体之一 [13]。MAPK1 为 MAP 激酶家族成员之一,参与多种细胞过程,如增殖、分化、转录调控和发育。肺结核患者通过 MAPK1 通路对 Mtb 产生强烈的免疫反应 [14]。CXCR4 是重要的趋化因子受体,调控各类细胞的转移和分化,且于血管生成相关,有研究 [15] 发现,肺结核肉芽肿相关促血管生成与 CXCR4 有密切联系,CXCR4 有望成为抗结核治疗的新靶点。STAT1 是潜在的细胞质转录因子,介导各种生物反应,包括细胞的增值、存活、凋亡和分化。感染后期,非磷酸化 STAT1 抑制巨噬细胞凋亡,利于结核菌在细胞内存活和增值,造成结核杆菌的免疫逃逸 [16]。MMP9、MMP1 均为 MMPS 家族的成员,其与结核肉芽肿形成与播散有关 [17, 18]。CXCL9 属 CXC 趋化因子家族,又被称作“干扰素伽玛诱导的单核细胞因子”,多项研究表明结核患者血浆中 CXCL9 显著高于健康者 [19, 20],可作为结核诊断标识,但其高表达机制尚不明确,还有待进一步研究。目前对 PLAU 的研究主要集中在阿尔兹海默症 [21],SERPINE 在妊娠方面研究较多 [22],而关于PLAU、SERPINE 对肺结核肉芽肿的影响未见报道。
此外,KEGG 通路富集分析显示,吞噬体、溶酶体、抗原提呈等信号通路在肺结核肉芽肿的形成与发展中起重要的作用。吞噬作用和吞噬溶酶体生物反应是机体消除外来微生物、抗原提呈等最基本的生物过程,Mtb 通过抑制感染机体巨噬细胞的吞噬体成熟、抵抗吞噬细胞产生杀菌因子,影响巨噬细胞杀菌能力,进而使 Mtb 在体内长期存在 [23]。抗原提呈细胞(Antigen-presenting cells, APC)与主要组织相容复合体 II 分子(Major histocompatibility complex class II, MHC-II)结合促进 CD4+ 产生,是抗 Mtb 的关键。而 Mtb 可以降低 MCH-II 的表达、降低抗原提呈、减少 CD4+ 细胞识别被感染的巨噬细胞 [23, 24],使 Mtb 免疫逃逸。克服吞噬体成熟阻滞、阻碍 Mtb 对抗原提呈的影响可能是未来抗结核治疗的一个研究方向。
本研究通过生物信息学的方法分析肺结核肉芽肿相关基因之间的相互关系,探讨影响肺结核肉芽肿形成及进展的发生机制的遗传因素,为肺结核的预防、诊断和治疗提供遗传基础理论。虽然目前对于肺结核治疗的研究取得很大的进展,但仍存在各种问题与挑战。我们预测 ITGAM、PLAU、SERPINE、MAPK1、CXCR4、STAT1、CXCL9、IL8、MMP9、MMP1 是肺结核肉芽肿的最相关特征基因,吞噬体、溶酶体、结核通路、抗原提呈为肺结核肉芽肿的重要信号通路,可能与肉芽肿形成与发展密切相关,值得进一步深入研究。
参考文献:
[1]Organization WH. Global tuberculosis report 2017[J]. Australasian Medical Journal, 2017, 6 (2).
[2]Russell DG. Who puts the tubercle in tuberculosis?[J]. Nature Reviews Microbiology, 2007, 5(1):39-47.
[3]Flynn JL, Chan J. Tuberculosis: Latency and Reactivation[J]. Infection and Immunity, 2001, 69(7):4195-4201.
[4]Rhoades ER, Geisel RE, Butcher BA, et al. Cell wall lipids from Mycobacterium bovis BCG are inflammatory when inoculated within a gel matrix: Characterization of a new model of the granulomatous response to mycobacterial components[J]. Tuberculosis, 2005, 85(3):159-176.
[5]Puissegur MP, Botanch C, Duteyrat JL, et al. An in vitro dual model of mycobacterial granulomas to investigate the molecular interactions between mycobacteria and human host cells[J]. Cellular Microbiology,2010,6(5):423-433.
[6]Karakousis PC, Yoshimatsu T, Lamichhane G, et al. Dormancy phenotype displayed by extracellular Mycobacterium tuberculosis within artificial granulomas in mice[J]. Journal of Experimental Medicine,2004,200(5):647-657.
[7]Luo YL, Liu YQ, Fang-Yu AN, et al. Bioinformatic Analysis of Related Key Genes in Malignant Transformation of Mesenchymal Stem Cells[J]. Life Science Research, 2017.
[8]Liu Z, Piao L, Zhuang M, et al. Silencing of histone methyltransferase NSD3 reduces cell viability in osteosarcoma with induction of apoptosis[J]. Oncology Reports, 2017, 38(5):2796-2802.
[9]Xu JF, Wang YP, Zhang SJ, et al. Exosomes containing differential expression of microRNA and mRNA in osteosarcoma that can predict response to chemotherapy[J]. Oncotarget, 2017, 8(44):75968-75978.
[10]Stein CM, Sausville L, Wejse C, et al. Genomics of Human Pulmonary Tuberculosis: from Genes to Pathways[J]. Current Genetic Medicine Reports, 2017, 5(4):149-166.
[11]Papp AC, Azad AK, Pietrzak M, et al. AmpliSeq transcriptome analysis of human alveolar and monocyte-derived macrophages over time in response to Mycobacterium tuberculosis infection[J]. PLOS ONE, 2018, 13(5):e198221.
[12]Kumar G, Shankar H, Sharma D, et al. Proteomics of Culture Filtrate of Prevalent Mycobacterium tuberculosis Strains: 2D-PAGE Map and MALDI- TOF/MS Analysis[J]. SLAS DISCOVERY: Advancing Life Sciences R&D, 2017, 22(9):1142-1149.
[13]Ernst JD. Macrophage Receptors for Mycobacterium tuberculosis[J]. Infection & Immunity, 1998, 66(4):1277-1281.
[14]Tateosian NL, Pellegrini JM, Amiano NO, et al. IL17A augments autophagy in Mycobacterium tuberculosis-infected monocytes from patients with active tuberculosis in association with the severity of the disease[J]. Autophagy, 2017:1.
[15]Torraca V, Tulotta C, Snaar-Jagalska BE, et al. The chemokine receptor CXCR4 promotes granuloma formation by sustaining a mycobacteria- induced angiogenesis programme[J]. Scientific Reports, 2017, 7:45061.
[16]Yao K, Chen Q, Wu Y, et al. Unphosphorylated STAT1 represses apoptosis in macrophages duringMycobacteriumtuberculosis infection[J]. Journal of Cell Science, 2017, 130(10):1740-1751.
[17]Salgame P. MMPs in tuberculosis: granuloma creators and tissue destroyers[J]. Journal of Clinical Investigation, 2011, 121(5):1686.
[18]Hrabec E, Strek M, Zieba M, et al. Circulation level of matrix metalloproteinase-9 is correlated with disease severity in tuberculosis patients[J]. Int J Tuberc Lung Dis, 2002, 6(8):713-719.
[19]Wang X, Jiang J, Cao Z, et al. Diagnostic performance of multiplex cytokine and chemokine assay for tuberculosis: 2012 科学研究与结核病防治高峰论坛 , 2012[C].
[20]Hasan Z, Jamil B, Khan J, et al. Relationship between Circulating Levels of IFN-γ, IL-10, CXCL9 and CCL2 in Pulmonary and Extrapulmonary Tuberculosis is Dependent on Disease Severity [J]. Scandinavian Journal of Immunology, 2009, 69(3):259-267.
[21]M R, L K, P F, et al. A functional polymorphism within plasminogen activator urokinase (PLAU) is associated with Alzheimer’s disease [J]. Human Molecular Genetics, 2006, 15(16):2446.
[22]Zhang L, Kanda Y, Roberts DJ, et al. Expression of progesterone receptor membrane component 1 and its partner serpine 1 mRNA binding protein in uterine and placental tissues of the mouse and human[J]. MOLECULAR AND CELLULAR ENDOCRINOLOGY, 2008, 287(1-2):81-89.
[23]Vergne I, Chua J, Singh SB, et al. Cell biology of Mycobacterium tuberculosis phagosome[J]. ANNUAL REVIEW OF CELL AND DEVELOPMENTAL BIOLOGY, 2004, 20:367-394.
[24]RK P, ME P, AA T, et al. Prolonged toll-like receptor signaling by Mycobacterium tuberculosis and its 19-kilodalton lipoprotein inhibits gamma interferon-induced regulation of selected genes in macrophages[J]. Infection and Immunity, 2004, 72(11):6603-6614.
《肺结核肉芽肿相关差异基因的生物信息学分析论文》附论文PDF版下载:
http://www.lunwensci.com/uploadfile/2018/1029/20181029031350427.pdf
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/1352.html




