SCI论文(www.lunwensci.com):
摘要:毒素抗毒素系统(TA)由稳定的毒素蛋白和不稳定的抗毒素(RNA或蛋白质)组成,二者协同表达,构成一个发挥多种功能的调控系统。持留菌是生长抑制、代谢减缓、但能够在致死性应激之后恢复生长的细菌。毒素抗毒素系统能够促进持留菌的形成,导致细菌多药耐药性的增加,靶向TA系统的新型抗菌药物的需求日益增长。总结了近年来毒素抗毒素系统介导持留菌形成的分子机制,以期为设计新型抗菌药物提供参考和帮助。
关键词:毒素抗毒素系统;持留菌;抗菌靶向药物
本文引用格式:姜倩倩,李国才.毒素抗毒素系统促进持留菌形成的分子机制[J].世界最新医学信息文摘,2019,19(76):120-122,131.
Molecular Mechanism of Formation of Persisters Mediated by Toxin-antitoxin System
JIANG Qian-qian,LI Guo-cai*
(Yangzhou University school of Medicine,Jiangsu Key Laboratory of Noncoding RNA,Jiangsu Co-Innouation Center for the Prevention and Control of Important Animal Infections Disease and Zoonoses,Yangzhou Jiangsu)
ABSTRACT:The toxin-antitoxin system(TA)is composed of stable toxin proteins and unstable antitoxin(RNA or protein)which are co-expressed to form a regulatory system with multiple functions.The persisters usually refer to growth-inhibiting and metabolism-decreasing bacteria which can resume growth after lethal stress.It was fund that toxin-antitoxin system involves in the formation of bacterial persistence,leading to the increasing in multidrug resistance of bacteria.Thus the demand for new antibacterial drugs targeting to toxin-antitoxin system is increasing.The molecular mechanism of formation of persisters mediated by toxin-antitoxin system in recent years is summarized in order to provide reference and help for the design of new antibacterial drugs.
KEY WORDS:Toxin-antitoxin system;Persister;Targeted antibiotics
引言
毒素抗毒素系统(toxin-antitoxin system,TA)广泛存在于原核生物基因组中,是微生物应激的操纵子,调控原核生物细胞内的多个重要生理代谢过程,通常通过干扰细胞过程如DNA复制、翻译、细胞分裂和ATP合成而导致细胞生长的抑制。持留菌是指抗生素敏感性细菌群体中的一小部分细胞,当暴露于抗生素时,其随机转变为缓慢生长或准休眠状态,并导致多药耐药性。细菌的持留性是病原体的重要表观遗传特性之一,是细菌感染复发的主要原因,是一个重要的公共卫生问题。TA系统可介导产生耐受抗生素和环境变化的缓慢生长的持留菌,其中毒素在压力情况下被激活,抑制细菌代谢活性,从而导致细菌的休眠状态。当条件有利于它们的繁殖时,抗毒素拮抗毒素的活性,持留菌从静止状态恢复并重新生长。因此,消除持留菌才可能使感染得到彻底的治疗。研究表明,持留菌的形成机制与很多因素有关,如TA系统[1]、SOS反应、密度信号感应系统等,本文对TA系统及其诱导持留菌形成的分子机制作一综述。
1TA系统
1.1TA系统的结构与功能
TA系统由毒素和抗毒素两种成分构成,二者的编码基因存在于细菌质粒或染色体中。在大多数情况下,抗毒素基因位于其同源毒素基因的上游,因此抗毒素似乎比其同源毒素产生水平更高。然而这种遗传排列也有例外,例如鲍曼不动杆菌的TA系统就不遵守这一规则,其特性之一是“反向组织”,即毒素基因在抗毒素基因的上游[2]。通常毒素是蛋白质,通过干扰细胞的基本生理代谢过程(例如转录、翻译)发挥作用;抗毒素是蛋白质或小RNA分子,可直接抑制或间接抵消毒素的活性[3]。当毒素受到抗毒素抑制时,生物体可以正常生长。然而,在应激或营养缺乏的条件下,抗毒素被灭活,毒素的活性得以发挥,从而促进细胞进入休眠状态。
1.2TA系统的分类
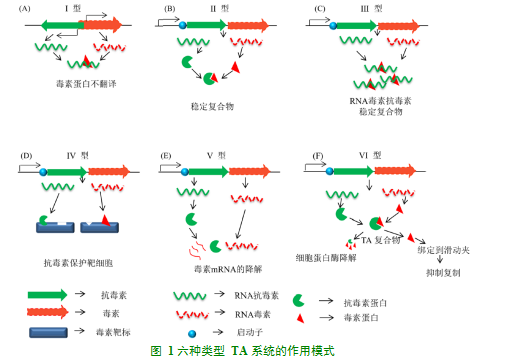
目前根据毒素与抗毒素的作用方式将TA系统分成Type I-TypeⅥ6种不同类型(图1)。
1.2.1I型TA系统
I型TA系统中,抗毒素是含有50-200个核苷酸的小调节RNA(sRNA),其与毒素基因的mRNA反义并形成碱基对以直接抑制mRNA翻译毒素蛋白。Hok/Sok是研究得较多的I型TA系统,其中Hok为毒素,Sok为抗毒素。其Hok mRNA-Sok mRNA二聚体可被RNaseIII迅速降解,Hok的毒性作用被抑制;在压力条件下,Sok RNA可被RNaseE以半衰期30 S的速度快速降解,Hok的毒性作用则可得以发挥[4]。
1.2.2II型TA系统
II型TA系统抗毒素和毒素都是天然的蛋白质,二者的基因共转录翻译,抗毒素通过直接结合并中和其同源毒素。II型TA系统是现在研究最深入广泛的一类TA系统[3],其与持留菌的形成密切相关[5-6]。这一系统中研究最多的是MazEF[7],RelBE[8]和HipBA[7],而最丰富的II型系统是VapBC[8]。
1.2.3III型TA系统
III型系统中抗毒素sRNA与毒素RNase相互作用,并形成抑制毒素活性的RNA假结合毒素复合物,干扰毒素与其靶标结合。III型TA系统包括有助于噬菌体抗性的ToxIN和CptIN系统。ToxIN是一种动态蛋白质-RNA复合物,具有稳定的抗病毒感染活性[9]。最近的生物信息学分析表明,III型TA系统在与炎症、肥胖症甚至数种癌症有关的肠道微生物群中非常丰富[10]。
1.2.4IV型TA系统
IV型TA系统中,毒素和抗毒素都是蛋白质,抗毒素蛋白间接抑制毒素蛋白,干扰毒素与其靶标的结合。例如在YeeU/YeeV中,YeeV与两种必需的细胞骨架蛋白FtsZ和MreB相互作用,抑制细胞生长。纯化的YeeV抑制GTP酶活性,从而抑制FtsZ的GTP依赖性聚合。此外YeeV还抑制MreB的ATP依赖性聚合[11]。
1.2.5V型TA系统
V型TA系统中,抗毒素是特异性的RNase,毒素mRNA的内切核糖核酸酶被抗毒素蛋白直接切割而降解。ghoST是目前唯一被报道的Ⅴ型TA,毒素蛋白GhoT是一个小的疏水性肽,在脂质双层中形成α螺旋结构,形成瞬时跨膜孔[12],从而破坏细胞膜导致其裂解,抗毒素蛋白GhoS是一种能够切割ghoT mRNA的核酸内切酶,阻止其翻译[13]。
1.2.6VI型TA系统
VI型TA系统中抗毒素表现为蛋白水解衔接子,促进毒素降解[14]。与经典TA系统不同,经典TA系统通常是毒素和抗毒素都被合成,并形成稳定的无毒复合物;在压力条件下,降解更多不稳定的抗毒素,从而释放出稳定的毒素,来抑制细菌生长。VI型系统中毒素SocB不稳定,能够被蛋白酶ClpXP组成性水解,而这种水解需要抗毒素SocA作为蛋白水解衔接子。压力情况时,毒素SocB积累,通过与DNA聚合酶III的直接相互作用,抑制DNA复制延伸[14]。
2TA系统与持留菌
已经证明TA系统可通过多种机制促进持留菌的形成[5]。一些毒素不是导致细胞死亡,而是将细胞转变为对抗生素具有抗性的休眠状态,然后在环境条件有利时恢复生长[15]。利用TA系统促进持留菌形成这一特点,设计靶向TA系统的抗菌药物,已被证明在临床上治疗感染有显著疗效,进一步深入探究具有重大意义。
2.1TA系统介导持留菌形成的机制
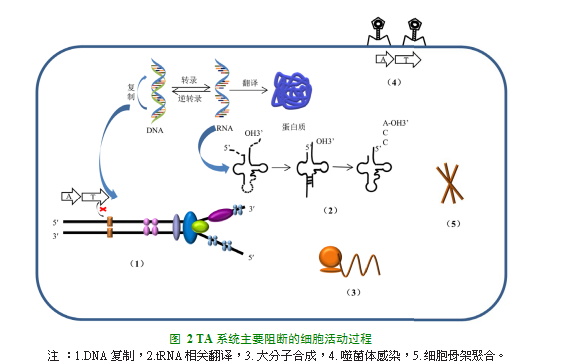
TA系统的活性受信号核苷酸四(五)磷酸鸟苷(p)ppGpp的调节,该ppGpp通过Lon蛋白酶、无机磷酸盐和其他应激诱导的信号传导途径起作用[16]。高水平的(p)ppGpp进一步刺激Lon蛋白并导致抗毒素降解,毒素变得自由和活跃,阻断细胞的主要活动过程(图2),例如DNA复制、tRNA相关翻译[17]、蛋白合成、噬菌体感染、细胞骨架聚合、细胞壁的生物合成等,最终导致生长停滞和持留菌的形成[18]。
2.1.1抑制DNA复制
SocA/SocB属于VI型TA系统,抗毒素SocA间接中和毒素SocB的毒性,而是作为蛋白水解衔接子,促进蛋白酶ClpXP对毒素SocB的降解。在存在药物或其他生存压力时,毒素SocB积累,与DNA Pol III竞争结合DnaN,DnaN是一种环状蛋白质,DNA Pol III与DnaN的结合可使其持续合成能力提高三个数量级[19],而毒素SocB与DnaN的竞争结合,导致DNA Pol III的持续合成能力降低,从而抑制DNA复制延伸[14]。CcdB是ccd TA系统中的毒素成分,毒素CcdB与DNA促旋酶结合并使其失活,从而抑制DNA复制[20]。并且最近Eira Choudhary等[21]发现DNA回旋酶的消耗,可导致RecA/LexA蛋白介导的SOS反应发生,SOS反应可抑制DNA复制。
2.1.2阻断tRNA相关翻译
靶向tRNA的毒素通过多种方式来抑制翻译。VapC毒素和MazF-mt9毒素是切割tRNA的核酸内切酶[22]。TacT和AtaT毒素是作为乙酰转移酶起作用,乙酰转移酶使tRNA的氨基乙酰化[23]。最后,HipA毒素磷酸化并灭活谷氨酰-tRNA合成酶,引起核糖体翻译过程中的延伸因子EF-Tu的失活,其阻止tRNA Glu的氨酰化。HipA和HipA7都靶向谷氨酸-tRNA连接酶(GltX),但HipA7在促进持留性方面更有效,可能是因为HipA也靶向其他底物,但其毒性低于HipA[24]。
2.1.3切割mRNA
II型TA系统中RelBE系统中毒素RelE以核糖体依赖性方式切割翻译的mRNA,从而抑制翻译。RelE结合在核糖体A位点,并在A位点密码子中的第二个核苷酸后切割RNA,RelE主要在mRNA的5’末端前100个密码子中特异性切割[25]。MazEF和MqsRA II型TA系统以核糖体非依赖性的方式切割mRNA。MazEF TA系统中MazF基因编码毒素蛋白,其本质是RNA核糖核酸内切酶。毒素MazF切割单链RNA上的ACA序列[26],而MqsA/MqsR系统中毒素MqsR切割单链RNA上的GC序列[27],从而抑制翻译,阻碍大分子的合成。II型TA系统毒素基因涉及大分子合成的还包括VapB/VapC[28],Doc/Phd,Hha/TomB等。
2.1.4抑制噬菌体感染
Ho k-Sok(Type I)[29],LsoAB、M azEF(Type II)[30-31],ToxIN(Type III)[9]和AbiEG(Type IV)[32]这几个类型的TA系统具有噬菌体抗性,可保护细菌自身免受噬菌体感染。T ox N/Tox I是第一个被发现的III型TA系统,T ox IN是由三种蛋白质毒素(ToxNs)和三种特异性非编码RNA抗毒素(ToxIs)形成的三角形结构[33]。ToxI抗毒素可以自发折叠,并且降低ToxIN复合物的稳定性。压力情况下,ToxI优先降解,释放的毒素ToxN可以杀死噬菌体感染的细胞,从而增加抗病毒反应的强度[9]。
2.1.5阻碍细胞骨架聚合
CbtA/CbeA属于IV型TA系统,毒素CbtA作为双功能细胞骨架抑制剂,FtsZ和MreB分别是指导细胞分裂和细胞增长的必需细胞骨架蛋白,CbtA通过与其的直接相互作用,从而双重抑制细胞分裂和细胞增长。并且目前已经鉴定其H6/H7环作为可被FtsZ抑制剂利用的新靶向位点,这可能对开发靶向该必需细胞骨架蛋白的新抗生素具有意义[34]。
2.2TA系统在持留菌形成中的争议
迄今为止,TA系统的生物学功能已经被广泛研究,TA系统在持留菌形成的过程中发挥了重要作用,其中II型TA系统研究地最为深入,与持留菌之间的关系也最为密切。以往支持II型TA系统诱导持留菌形成,最常用的证据之一是观察到10种mRNA(通常称为ΔTA10菌株)的缺失使持留菌的数量减少。然而Goormaghtigh等[35]最近的一篇论文指出该菌株持留性降低,是由于突变菌株中存在φ80噬菌体(一种常见的实验室污染物),而不是因为TA系统的缺失。通过重新构建ΔTA10菌株(ΔmazF,ΔchpB,ΔrelBE,ΔdinJ/yafQ,ΔyefM/yoeB,ΔhigBA,ΔprlF/yhaV,ΔyafNO,ΔmqsRA,ΔhicAB),并且没有噬菌体污染,结果显示删除10个TA系统的基因不会影响其对氧氟沙星或氨苄西林的持留性,也就是说,TA系统的诱导与抗生素的持留性之间没有直接联系。这值得我们重新审视TA系统与持留菌之间的关系,并且细菌中拥有如此之多的TA系统,它们的功能以及存在价值值得人们思考。目前TA系统确认的功能有:(1)噬菌体抑制;(2)质粒维持;(3)应激反应;(4)生物膜形成;(5)持留性。然而这些功能都是基于产生过量的毒素,生理剂量下毒素主要是以一种可逆的方式约束细胞的新陈代谢,而不会导致细菌杀伤或者程序性死亡[36]。
2.3靶向TA系统的抗菌药物
细菌持留性与抗生素抗性不同,持留菌在抗生素存在下不会增殖,而是随机地转换为生长抑制状态。大多数临床使用的抗生素的杀灭效率,强烈依赖于靶细菌的生理状态,具有低代谢活性的缓慢生长或休眠的细菌,通常难以被大多数抗生素杀死。这是因为抗生素通常会通过消除必需的活性目标来杀死细菌,然而在生长缓慢的细胞中,抗生素的抑制作用对这些靶标是不敏感的,因此细菌暂时变得耐药[37]。持留菌的存在通常使宿主产生慢性复发性感染,消除持留菌对于宿主免于感染至关重要。在设计新的抗菌化合物时,寻找新的非标准目标是一个高度优先考虑的事项。细菌TA系统是编码毒素和抗毒素的遗传系统,其通过干扰必需的细胞过程引起生长停滞,诱导持留菌的形成。TA毒素的靶标主要涉及DNA复制、RNA合成、大分子合成、噬菌体感染和细胞骨架聚合等生物过程,这些和抗生素目标之间存在明显的重叠,因此靶向TA系统,可利用CRISPR/Cas9基因编辑技术[38],构建TA系统的基因敲除株,进一步探究其与持留性的关系。
李同庆等[39]研究发现HipA抑制剂显著降低了氨苄青霉素和卡那霉素诱导的大肠杆菌的持留菌的发生率,并且不依赖于抗生素,首次证明TA系统中的毒素抑制剂可以干扰持留性形成,并提供了治疗细菌持留性的新策略。In-Gyun Lee等人[40]根据其对结核分枝杆菌VapBC30的研究,设计了两种基于VapB30和VapC30的新型肽,它们成功地破坏了TA复合物,从而激活了VapC30毒素的核糖核酸酶活性。Amar Deep等人[28]设计了基于肽的抑制剂来靶向VapC11核糖核酸酶活性,VapC11的过表达导致染色体TA基因的上调,证明了VapBC11 TA系统对Mtb在豚鼠中建立感染至关重要。
最近研究发现TA对序列特异性反义试剂敏感,使用序列特异性反义肽核酸寡聚体,人工激活大肠杆菌mazEF和hipBA TA系统,抑制抗毒素的翻译引起的生长停滞,是一种创新的抗菌策略。此外,与mazEF和hipBA活性相关的另外两个目标被确定为有前途的抗菌药物作用点,为其在抗微生物策略中的进一步开发提供了理论基础[7]。
3展望
TA系统广泛存在于细菌病原体中,但不存在于真核细胞中,在细菌基因组中非常丰富,被评价为有前途的抗菌靶标。近年来对TA系统在大肠杆菌、金黄色葡萄球菌、鲍曼不动杆菌等持留菌形成的作用进行了广泛的研究,TA系统中毒素可阻滞DNA复制、mRNA及蛋白合成等主要细胞过程,导致生长停滞和持留菌的形成。持留菌的形成容易造成临床上反复感染、病程延长和治疗失败等问题,并使细菌耐药率不断升高。尽管TA系统不是导致持留菌形成的唯一因素,与细菌持留性方面的相关性尚存在争议,但由于持留菌的广泛存在,设计和开发具有靶向TA系统的新型特异性抑制剂是必要和迫切的。目前,靶向TA系统的试剂如HipA抑制剂、VapB30和VapC30等新型肽,已显示出可破坏TA系统相关性生长停滞的作用,为临床上新型抗菌药物的开发奠定了理论基础。TA系统的深入研究对细菌持续性感染的新型治疗药物研发具有重大价值。
参考文献
[1]Harms A,Maisonneuve E,Gerdes K.Mechanisms of bacterial persistence during stress and antibiotic exposure[J].Science,2016,354(6318):aaf4268.
[2]Jurenaite M,Markuckas A,Suziedeliene E.Identification and characterization of type II toxin-antitoxin systems in the opportunistic pathogen Acinetobacter baumannii[J].Journal of bacteriology,2013,195(14):3165-3172.
[3]Lee K Y,Lee B J.Structure,Biology,and Therapeutic Application of Toxin-Antitoxin Systems in Pathogenic Bacterial[J].Toxins,2016,8(10):E305.
[4]Chukwudi C U,Good L.Phenotypic indications of FtsZ inhibition in hok/sok-induced bacterial growth changes and stress response[J].Microbial Pathogenesis,2018,114:393-401.
[5]Page R,Peti W.Toxin-antitoxin systems in bacterial growth arrest and persistence[J].Nature Chemical Biology,2016,12(4):208-214.
[6]Rocker A,Meinhart A.Type II toxin:antitoxin systems.More than small selfish entities?[J].Current genetics,2016,62(2):287-290.
[7]Równicki M,Pieńko T,Czarnecki J,et al.Artificial Activation of Escherichia coli mazEF and hipBA Toxin-Antitoxin Systems by Antisense Peptide Nucleic Acids as an Antibacterial Strategy[J].Frontiers in microbiology,2018,9:2870.
[8]Solano-Gutierrez J,Pino C,Robledo J.Toxin-antitoxin systems shows variability among Mycobacterium tuberculosis lineages[J].FEMS Microbiol Lett,2019,366(1):fny276.
[9]Short F L,Akusobi C,Broadhurst W R,et al.The bacterial Type III toxin-antitoxin system,ToxIN,is a dynamic protein-RNA complex with stability-dependent antiviral abortive infection activity[J].Scientific reports,2018,8(1):1013.
[10]Kang S,Kim D,Jin C A-O,et al.A Systematic Overview of Type II and III Toxin-Antitoxin Systems with a Focus on Druggability[J].Toxins(Basel),2018,10(12):E515.
[11]Tan Q,Awano N,Inouye M.YeeV is an Escherichia coli toxin that inhibits cell division by targeting the cytoskeleton proteins,FtsZ and MreB[J].Molecular microbiology,2011,79(1):109-118.
[12]Kim J S,Schantz A B,Song S,et al.GhoT of the GhoT/GhoS toxin/antitoxin system damages lipid membranes by forming transient pores[J].Biochemical and Biophysical Research Communications,2018,497(2):467-472.
[13]Wang X,Lord D M,Cheng H Y,et al.A new type V toxin-antitoxin system where mRNA for toxin GhoT is cleaved by antitoxin GhoS[J].Nature chemical biology,2012,8(10):855-861.
[14]Aakre C D,Phung T N,Huang D,et al.A bacterial toxin inhibits DNA replication elongation through a direct interaction with theβsliding clamp[J].Molecular cell,2013,52(5):617-628.
[15]Hayes F.Toxins-Antitoxins:Plasmid Maintenance,Programmed Cell Death,and Cell Cycle Arrest[J].Science,2003,301(5639):1496-1499.
[16]Svenningsen M S,Veress A,Harms A,et al.Birth and Resuscitation of(p)ppGpp Induced Antibiotic Tolerant Persister Cells[J].Scientific reports,2019,9(1):6056.
[17]Walling L R,Butler J S.Toxins targeting transfer RNAs:Translation inhibition by bacterial toxin-antitoxin systems[J].Wiley Interdisciplinary Reviews:RNA,2019,10(1):e1506.
[18]Yang Q E,Walsh T R.Toxin-antitoxin systems and their role in disseminating and maintaining antimicrobial resistance[J].FEMS microbiology reviews,2017,41(3):343-353.
[19]Johnson A,O’donnell M.Cellular DNA replicases:components and dynamics at the replication fork[J].Annu Rev Biochem,2005,74:283-315.
[20]Smith A B,Maxwell A.A strand-passage conformation of DNA gyrase is required to allow the bacterial toxin,CcdB,to access its binding site[J].Nucleic Acids Res,2006,34(17):4667-4676.
[21]Choudhary E,Sharma R,Kumar Y,et al.Conditional Silencing by CRISPRi Reveals the Role of DNA Gyrase in Formation of Drug-Tolerant Persister Population in Mycobacterium tuberculosis[J].Frontiers in cellular and infection microbiology,2019.9:70.
[22]Chen R,Tu J,Liu Z,et al.Structure of the MazF-mt9 toxin,a tRNA-specific endonuclease from Mycobacterium tuberculosis[J].Biochemical and Biophysical Research Communications,2017,486(3):804-810.
[23]Jurenas D,Chatterjee S,Konijnenberg A,et al.AtaT blocks translation initiation by N-acetylation of the initiator tRNAfMet[J].Nat Chem Biol,2017,13(6):640-646.
[24]Semanjski M,Germain E,Bratl K,et al.The kinases HipA and HipA7 phosphorylate different substrate pools in Escherichia coli to promote multidrug tolerance[J].Science Signaling,2018,11(547):eaat5750.
[25]Hwang J Y,Buskirk A R.A ribosome profiling study of mRNA cleavage by the endonuclease RelE[J].Nucleic acids research,2017,45(1):327-336.
[26]Zhang Y,Zhang J,Hoeflich K P,et al.MazF Cleaves Cellular mRNAs Specifically at ACA to Block Protein Synthesis in Escherichia coli[J].Molecular Cell,2003,12(4):913-923.
[27]Yamaguchi Y,Park J H,Inouye M.MqsR,a Crucial Regulator for Quorum Sensing and Biofilm Formation,Is a GCU-specific mRNA Interferase in Escherichia coli[J].Journal of Biological Chemistry,2009,284(42):28746-28753.
[28]Deep A,Tiwari P,Agarwal S,et al.Structural,functional and biological insights into the role of Mycobacterium tuberculosis VapBC11 toxin-antitoxin system:targeting a tRNase to tackle mycobacterial adaptation[J].Nucleic Acids Research,2018,46(21):11639-11655.
[29]Pecota D C,Wood T K.Exclusion of T4 phage by the hok/sok killer locus from plasmid R1[J].Journal of bacteriology,1996,178(7):2044-2050.
[30]Hazan R,Engelberg-Kulka H.Escherichia coli mazEF-mediated cell death as a defense mechanism that inhibits the spread of phage P1[J].Molecular Genetics and Genomics,2004,272(2):227-234.
[31]Wan H,Otsuka Y,Gao Z Q,et al.Structural insights into the inhibition mechanism of bacterial toxin LsoA by bacteriophage antitoxin Dmd[J].Molecular Microbiology,2016,101(5):757-769.
[32]Hampton H G,Jackson S A,Fagerlund R D,et al.AbiEi Binds Cooperatively to the Type IV abiE Toxin-Antitoxin Operator Via a Positively-Charged Surface and Causes DNA Bending and Negative Autoregulation[J].Journal of Molecular Biology,2018,430(8):1141-1156.
[33]Hu G,Yu X,Bian Y,et al.Atomistic Analysis of ToxN and ToxI Complex Unbinding Mechanism[J].International journal of molecular sciences,2018,19(11):E3524.
[34]Heller D M,Tavag M,Hochschild A.CbtA toxin of Escherichia coli inhibits cell division and cell elongation via direct and independent interactions with FtsZ and MreB[J].PLoS genetics,2017,13(9):e1007007.
[35]Goormaghtigh F,Fraikin N,PutrinšM,et al.Reassessing the Role of Type II Toxin-Antitoxin Systems in Formation of Escherichia coli Type II Persister Cells[J].mBio,2018,9(3):e00640-18.
[36]Song S,Wood T K.Post-segregational Killing and Phage Inhibition Are Not Mediated by Cell Death Through Toxin/Antitoxin Systems[J].Frontiers in microbiology,2018,9:814.
[37]Maisonneuve E,Gerdes K.Molecular Mechanisms Underlying Bacterial Persisters[J].Cell,2014,157(3):539-548.
[38]陈芳,张伟锋,赵俊丽,等.应用CRISPR/Cas9系统构建Rev-erbβ基因敲除的HEK293细胞系[J].细胞与分子免疫学杂志,2016,32(11):1446-1452.
[39]Li T,Yin N,Liu H,et al.Novel Inhibitors of Toxin HipA Reduce Multidrug Tolerant Persisters[J].ACS medicinal chemistry letters,2016,7(5):449-453.
[40]Lee I G,Lee S J,Chae S,et al.Structural and functional studies of the Mycobacterium tuberculosis VapBC30 toxin-antitoxin system:implications for the design of novel antimicrobial peptides[J].Nucleic Acids Research,2015,43(15):7624-7637.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/21571.html