SCI论文(www.lunwensci.com):
摘要:食管癌是我国常见的恶性肿瘤之一,每年导致了大量的患者死亡,早发现早治疗以及密切监测成为减少患者死亡率的重要途径。
已有研究表明,液态组织学检查作为食管癌诊治和监测指标已成为精准医学的重要组分。循环肿瘤细胞作为食管癌诊断和监测指标由来已久,由于存在一定的争议性而在相当长的一段历史里沉寂下来,随着现代化技术改进和仪器的革新,如Cellsearch系统、膜滤过分离法(ISET),微流控技术,流式细胞术,密度梯度离心术等技术的使用,循环肿瘤细胞又成为研究热点。本文将从循环肿瘤细胞用于食管癌的诊治和监测的最新研究进展进行综述。
关键词:食管癌;液态活检;循环肿瘤细胞;循环肿瘤DNA
本文引用格式:来金宇,郭家龙,刘华松,等.液态活检在食管癌诊治中的应用前景[J].世界最新医学信息文摘,2019,19(52):31-32.
0引言
食管癌作为一种常见的消化道恶性肿瘤,在我国占癌症死亡率第四位,每年导致的死亡率达到了15万人,严重影响着广大人民的生命安全[1]。多年来,经过广大医务工作者的不懈努力,在食管癌的治疗上(包括外科手术切除、同步放化疗以及中医中药治疗等方法)有了很大的进步,但是仅局限在早期食管癌的治疗中,中晚期食管癌的治疗仍面临很大困境,因此食管癌的早期诊断显得尤为重要。而食管癌早期临床症状不典型,常规的体检包括影像、内镜及病检也无法准确发现,因此临床迫切需要一种更为精确、高效、便捷的检查方法来诊断早期食管癌并且密切监测肿瘤治疗后的动态变化情况。
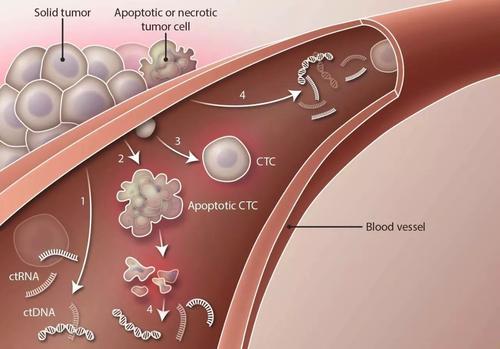
液态组织学检查是目前研究较热的肿瘤检测方法,包括对循环肿瘤细胞(circulating tumor cells,CTCs)和循环肿瘤DNA(circulating tumor DNA,ctDNA)监测两大类。通过采取患者的外周血,使用专门的仪器设备分离患者外周血中的游离循环肿瘤细胞(circulating tumor cells,CTCs)和循环肿瘤DNA(circulating tumor DNA,ctDNA),并结合目前临床常用的肿瘤诊断方式方法,对患者的疾病情况进行系统的评价,提高早期肿瘤的检出率,尽早对食管癌进行治疗,从而降低食管癌患者的死亡率[2]。但就目前的研究进展来看,CTCs和ctDNA的检测方法无论在特异性还是敏感性方面都面临着严峻挑战[3]。
1液态活组织检查的对象
液态活组织检查是通过采取患者的外周静脉血,利用Cellsearch系统、膜滤过分离法、有微流控技术,流式细胞术,密度梯度离心术等技术分离得到循环肿瘤细胞和循环肿瘤DNA的方法,这种方法具有操作简单,经济实惠,对患者创伤小,患者医从性高等诸多优势[4]。
1.1CTCs的生物学特性
早在1869年Thomas Ashwort就提出了CTCs作为肿瘤标志物的猜想,Thomas Ashwort发现患者外周血中的CTCs的形态和患者本身的肿瘤细胞相似,因此CTCs被认为是肿瘤组织在自身代谢过程中细胞脱落游离,进入血液循环系统形成的循环肿瘤细胞或者循环肿瘤细胞栓[5],CTCs通过某种机制逃离人体的免疫系统监控,进入人体的器官或组织定植并形成转移肿瘤。大量报道表明,食管癌患者外周血循环中游离循环肿瘤细胞(circulating tumor cells,CTCs)明显高于正常人[6]。
CTCs具有间叶细胞转化能力和上皮化能力,多个CTCs可发生凝聚形成循环肿瘤栓,增加了其在组织和器官定植的能力和逃避免疫监视的能力,从而部分解释了肿瘤的转移机制。然而游离循环肿瘤细胞(circulating tumor cells,CTCs)在外周血中含量很低,在早期食管癌患者的外周血中含量更低,这对其相应的检测技术提出了很高的要求[7]。现已有研究表明,通过免疫磁珠负性富集外周血的方法可除去正常细胞,留取其中的肿瘤细胞后,采用荧光原位杂交技术(fluorescence in situ hy—bridization.FISH)分析8/20号染色体拷贝数,通过分析其染色体扩增情况对CTCs进一步进行鉴定,从而提高检出率[8]。
1.2ctDNA的生物学特性
1977年Leon等发现肿瘤晚期患者外周血中来自肿瘤的血浆游离DNA片段(cfDNA)明显高于正常人,这些cfDNA中包括了肿瘤癌基因及抑癌基因突变、DNA甲基化等多种与肿瘤密切相关的特异性标志的DNA片段(ctDNA),这些ctDNA和肿瘤的发生、转移等有着密切的关系[9-11]。
目前已知的ctDNA主要由肿瘤细胞凋亡或者坏死过程中碎片化的DNA、肿瘤细胞代谢过程中分泌到外周血中、肿瘤通过血行转移、人体淋巴系统攻击肿瘤细胞释放出肿瘤细胞DNA等方式出现在外周血。ctDNA是小片段生物分子,在人体代谢较快,且具有更高的灵敏性,因此对肿瘤类型的诊断具有较高的特异性。对野生型和突变型ctDNA的定量检测在肿瘤的早期诊断、肿瘤的演变、生物学性状、肿瘤的疗效和预后监测方面明显优于CTCs[12]。
2液态活检的操作方法
2.1CTCs的操作方法
在外周血中存在的CTCs太少,这就需要高灵敏性和高特异性的检测设备和检测方法。目前有文献报道的检测CTCs的方法很多,大致有40多种,但是都存在局限性,这也是导致目前相关研究停滞不前的原因之一。目前使用较多的方法是利用细胞之间大小、密度、电荷大小等物理特性的不同对外周血中的CTCs进行初步富集,然后通过识别分子表面的特异性标志物,利用逆转录PCR、流式细胞仪等技术获得目标CTCs细胞[13]。
2.2ctDNA的检测
ctDNA的检测是基于外周血循环的DNA片段中存在基因突变的肿瘤DNA(ctDNA),通过技术成熟的高通量测序及、BEAMing技术等方法对其进行检测,其中高通量测序的方法是对几十万到几百万条DNA分子进行肿瘤相关基因、全外显子以及全基因组进行检测,从而获取目标ctDNA。
3液态活检在食管癌的诊治中的应用
3.1用于食管癌的早期诊断和临床分期
目前临床上大多数就诊的患者已经有典型的进行性吞咽困难,通过肿瘤标志物检测、影像技术、内镜技术及病理活检等方式进行确诊,而此时的食管癌多数已经是中晚期伴随着周围淋巴结的转移,手术效果和放化疗等联合的全方位手段治疗的疗效仍不能令人满意。而对于早期食管癌患者,由于临床表现不明显,检查技术缺陷,导致其诊断存在很大的困难。而目前研究较热的液态活检技术有可能改善这一尴尬的现状。
有文献报道,在早期影像学还未能发现明显病变异常的时候,一部分的肿瘤细胞或者碎片DNA会在自身代谢中进入血液循环,形成CTCs和ctDNA,通过临床检查这些物质就可以较早的发现肿瘤,因此可以作为常规的临床体检筛查项目,这对于早期食管癌患者无疑是一个福音。也有文献报道根据检测到的CTCs和ctDNA作为食管癌的临床分期依据,与我们经典的肿瘤分期(TNM)之间存在显著的相关性,因此有建议将CTCs和ctDNA的检测作为临床肿瘤分期的重要组成部分,但是其可行性仍需要我们去评估[14-16]。
3.2用于食管癌的疗效评价和复发监测
目前我们对食管癌的治疗后评价主要是影像学检查,包括定期对肿瘤周围和常见远处转移组织器官的检查,这种方法不仅有很大辐射,也需要较大的花费,而液态活检技术作为无创、安全、动态监测以及患者医从性高等优势,给我们的治疗和评价疗效,特别是对治疗后患者动态监测提供了新思路。
4液态活检的优势和局限性
目前对食管癌的诊断多是临床上对有明显进食梗阻感的患者影像、内镜检查检测出来的,一般是患者有了临床症状才去就诊或者是体检发现较为典型的影像学特征,但这个时候患者的临床分期多为中晚期,使得通过包括手术在内的多种治疗手段疗效大大降低,这严重的影响了肿瘤患者的预后。有文献报道,在肿瘤发生的早期,血液中即可出现循环肿瘤细胞,并且可以检测到这些循环肿瘤细胞的端粒酶活性,提示了端粒酶活性的表达是细胞早期癌变过程中重要的表现,而目前检测外周血中循环肿瘤细胞的端粒酶活性的技术是成熟的[17]。
也有研究表明,在食管癌早期即有少许的肿瘤细胞脱落至循环血液中,而这些少量的CTCs和ctDNA在自身代谢过程中只有不足0.01%的部分直接导致了肿瘤的转移,但是可以发现早期肿瘤[18]。现在我们需要做的就是研究更加精密的仪器设备来更加准确定量的检测它们,再通过手术获取病变组织的病理学结果,得到CTCs和ctDNA和目前的肿瘤诊断金标准-病理诊断的相关性和对应关系,从而将用CTCs和ctDNA作为无创的,便捷的早期肿瘤诊断方法,因此使用CTCs和ctDNA来发现早期肿瘤是可行的。
由于现在CTCs和ctDNA在外周血中含量微乎其微,目前的检测和分析较为困难,基本是在科研中开展,因此研究更加精密、准确、价廉的检测设备是目前迫切的需要。就目前国内外对CTCs和ctDNA检测仪器的研究进展来看CTCs和ctDNA检测像血常规检测一样在临床普及还是一件仍重道远的事。有研究表明,对检测到的循环肿瘤细胞进行基因分析发现,不同的循环肿瘤细胞里面的信号通路并不是完全相同的,这就无法通过检测循环肿瘤细胞来判断机体肿瘤类型。
CTC在非转移性食管癌的诊治意义也受到不少学者的质疑,我们目前对CTC细胞学特征和分子特征还不是很清楚,特别是目前无法科学的评价食管癌患者中外周血CTC中(早期肿瘤标志物)HER2表达的频率和肿瘤学影响,这也就大大降低了肿瘤早期诊断的价值[19]。以及通过对CTCs和ctDNA检测分析得到的病理诊断结论与活检标本病理诊断之间的相关性等问题也是需要解决的[20]。
综上,液态活检技术作为肿瘤诊断的新武器让我们看到了人类战胜肿瘤的曙光,但是将液态活检技术应用于临床肿瘤诊治的主要指标任重道远,需要我们科研工作者继续的努力。
参考文献
[1]Bohanes P,Yang D,Chhibar RS,et al.Influence of sex onthe survival of patients with esophageal cancer[J].J ClinOncol,2012,30(18):2265-2272.
[2]左婷婷,郑荣寿,曾红梅,等.中国食管癌发病状况与趋势分析[J].中华肿瘤杂志,2016,38(9):703-708.
[3]Li,Y,Ma G,Zhao P,et al.Improvement of sensitive and specific detection of circulating tumor cells using negative enrichment and immunostaining-FISH[J].ClinChimActa,2018,(485):95-102.
[4]
Raimondi C,Gradilone A,Naso G,et al.Clinical utilityof circulating tumor cell counting through CellSearch:The dilemma of a concept suspended in Limbo[J].OncoTargets Ther,2014,7(5):619-625.
[5]Alix-PanabieresC,PantelK.Challenges in cireulatingtumour cell research[J].Nat Rev Cancer,2014,14(9):623-631.
[6]Zheng X,Fan L,Zhou P,et al.Detection of circulatingtumor cells and circulating tumor microemboliingastric cancer[J].TranslatOnc ol,2017,10(3):431-441.
[7]Paterlini-Brechot P,Benali NL.Circulating tumor cells(CTC)detection:clinical impact and future directions[J].Cancer Lett,2007,253(2):180-204.
[8]任传利,何平,张金强,等.8号和20号染色体拷贝数改变辅助食管癌外周血循环肿瘤细胞鉴定[J].中国肿瘤,2008(06):513-517.
[9]Wang JY,Hsieh JS,Chang MY,et al.Molecular detection ofAPC,K-ras,and p53 mutations in the serum of colorectal cancerpatients as circulating biomarkers[J].W orld J Surg,2004,28(7):721-726.
[10]Shaw JA,Smith BM.Walsh T,et al.Microsatellite alterationsplasma DNA of primarybreast cancer patients[J].ClinCancerRes,2006(3):1119-1124.
[11]Fujiwara K,Fujimoto N,Tabata M,et al.Identification of epige-netic aberrant promoter methylationin serum DNA is usefulforearly detection of lung cancer[J].Clin Cancer Res,2005,11(3):1219-1225.
[12]Tadimety A,Closson A,Li C,et a1.Advances in liquid biopsyon-chip for cancer nlanagement:Technologies,hiomarke~,and clinical analysis[J].Crit Rev Clin Lab Sci,2018:1-23.
[13]Mostert B.Sleijfer s,Foekens JA,et al.Circulating tumor cells(CTCs):detection methods and their clinical relevance in breastcancer[J].Cancer Treat Rev,2009,35(5):463-474.
[14]Hiraiwa K,Takeuchi H,Hasegawa H,et al.Clinical significance of circulating tumor cells in blood from patients with gastrointestinalcancers[J].Ann SurgOncol,2008,15(11):3092-3100.
[15]李军,王伟,乔媛媛,等.食管鳞癌外周血循环肿瘤细胞检测及临床意义[J].中华胸心血管外科杂志,2012,28(3):157-160.
[16]Kong W,Yang H,He L,et al.MicroRNA-155 is regulated by the transforming growth factor beta/Smad pathway and contributesto epithelial cell plasticity by targetingRhoA[J].Mol Cell Biol,2008,28(22):6773-6784.
[17]Sapi E.Okpokwasili NI.Rutherford T.Detectiou of telomerase-positive circulatingepithelial cells in ovarian cancer patients[J].Cancer Detect Prev,2002,26(2):158-167.
[18]Mori M.Minnori K,Ueo H,et al.Molec·ular detection of circulating solidcart-inotna cells in the peripheral biood:the concept of early systemic disease[J].Int J Cancer,1996,68(6):739-743.
[19]Woestemeier,Ghadban T,RiethdorfS,et al.A.Absence of HER2 Expression of Circulating Tumor Cells in Patients with Non-Metastatic Esophageal Cancer[J].Anticancer Res,2018,38(10):5565-5669.
[20]陈颖,朱明华.液态活检技术的发展及肿瘤领域的应用[J].分子诊断与治疗杂志,2015,7(6):361-366.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/11762.html