[摘要]目的探究小鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)对四氯化碳(tetra⁃chloromethane,CCl4)诱导小鼠急性肝损伤的修复作用。方法研究于2018年1—12月在江苏省中医院开展,运用随机数字表法将18只小鼠分为3组,分别为矿物油对照组(Oil组)、CCl4损伤组(CCl4组)和治疗组(BM-MSCs组),每组6只。单次腹腔注射矿物油或10%的CCl4建立急性肝损伤模型。24 h后,经尾静脉输注磷酸盐缓冲液(phosphate buffered saline,PBS)或BM-MSCs。第4天采集小鼠血液和肝脏组织标本,检测血清中天门冬氨酸氨基转移酶(aspartate amino transferase,AST)和丙氨酸氨基转移酶(alanine aminotransferase,ALT)的活性,观察组织大体观和病理学的改变。结果血清ALT和AST结果显示,CCl4组小鼠ALT活性为(67.40±5.79)U/L,AST活性为(110.70±39.58)U/L,均高于Oil组ALT(51.53±9.52)U/L和AST(73.65±9.77)U/L,而输注BM-MSCs后,两者活性均较CCl4组降低,即ALT(54.18±17.19)U/L、AST(78.73±14.97)U/L,差异有统计学意义(P均<0.05)。肝脏组织大体观和病理切片显示,CCl4组呈典型的氧化损伤表现,而BM-MSCs组可见明显的缓解。结论输注外源性小鼠BM-MSCs能够有效促进CCl4诱导的小鼠急性肝损伤的修复。
[关键词]骨髓间充质干细胞,四氯化碳,急性肝损伤
肝脏是人体最大的多功能实质性器官,虽具有较强的代偿与再生能力,但脆弱且易损伤。当短期内暴露于不同的致病因素下时,如化学物质、酒精、病毒等,肝脏会发生急性损伤,呈现炎症、肝细胞坏死、氧化应激等病理改变,损伤终末可发展为肝衰竭甚至肝癌[1-2]。在化学物质诱导的肝损伤动物模型中,四氯化碳(tetrachloromethane,CCl4)为常用且经典的造模剂,成膜效率高且重复性好。多项研究表明,单次注射CCl4可致急性肝损伤[3]。
间充质干细胞(mesenchymal stem cells,MSCs)以其高度自我更新和多向分化潜能的优势成为再生医学中重要的细胞来源。而骨髓是首次发现MSCs的组织,也是其主要来源[4]。再生医学的出现为临床肝病的治疗提供新的途径,例如细胞移植。在急慢性肝病的治疗中,MSCs疗法被视为肝移植的替代疗法。多项动物模型的研究结果皆证实了MSCs移植在急性肝损伤中的有效性和安全性[5]。
1材料与方法
1.1材料
1.1.1动物18只美国癌症研究所小鼠,5周龄,雄性,清洁级,体质量(20±2)g,购自南京医科大学实验动物中心,用于构建急性肝损伤及修复模型。3只昆明小鼠,4周龄,雄性,清洁级,购自江苏大学实验动物中心,用于小鼠骨髓间充质干细胞的分离与培养。本研究的动物实验符合《实验动物管理和使用指南》,经南京中医药大学附属医院动物伦理委员会批准(2015NL-KS09)。
1.1.2试剂和材料低糖达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)购自Gibco公司;胎牛血清购自吉泰生物公司;0.25%胰蛋白酶购自Amresco公司;分析纯CCl4购自国药公司;矿物油购自Sigma公司;丙氨酸氨基转移酶(ala⁃nine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒购自三维生物公司;细胞培养瓶购自Nunc公司,1 mL胰岛素注射器购自BD公司。
1.1.3仪器超净工作台(苏州净化厂),细胞培养箱(Thermo Scientific公司),台式离心机(Eppendorf公司),倒置显微镜(Olympus公司),数码相机(三星电子),全自动生化分析仪(Beckman Coulter公司)。
1.2方法
1.2.1小鼠骨髓间充质干细胞的分离和培养将昆明小鼠断颈处死并浸于75%乙醇中消毒5 min,在超净台中取出小鼠,用无菌的镊子和剪刀剥离后肢股骨,剔除表面肌肉,用磷酸盐缓冲液(phosphate buffered saline,PBS)与培养基的混合液冲洗骨髓腔至股骨发白,收集骨髓细胞,800 rpm离心5 min,用低糖DMEM培养基(含15%胎牛血清)重悬,以5×106/mL密度接种于细胞培养瓶中,置于含37℃恒温、5%CO2饱和湿度的细胞培养箱中。第4天全量换液去除悬浮的细胞,以后每3 d全量换液1次。当细胞集落的融合度达80%~90%时,予以消化传代。在倒置显微镜下观察细胞的形态,取对数生长期的BM-MSCs经胰酶消化、PBS洗涤和细胞计数制备成2×106/200µL PBS细胞悬液备用。
1.2.2小鼠造模与干预运用随机数表法将18只小鼠分为3组,即矿物油对照组(Oil组)、损伤组(CCl4/PBS组)和治疗组(CCl4/BM-MSCs组),每组6只。3组小鼠皆为5周龄,体质量皆为(20±2)g,3组间差异无统计学意义(P>0.05)。将矿物油和CCl4按体积比配置成10%(V/V)的CCl4矿物油溶液,对损伤组和治疗组小鼠按5µl/g的剂量给予单次腹腔注射构建急性肝损伤模型,对照组小鼠给予单次等剂量的矿物油。损伤24 h后,治疗组小鼠尾静脉注射(i.v)200µl PBS细胞悬液(含2×106 BM-MSCs),损伤组小鼠尾静脉注射(i.v)等量PBS,对照组小鼠不作处理。各组小鼠自由摄食和饮水,于第4天(即损伤第5天)行心脏采血处死,收集血液和肝脏标本,拍摄组织大体观,备检。
1.2.3血清学指标检测待血液充分凝固后,室温3 500 r/min离心10 min,收集血清。利用生化分析仪检测各组小鼠的ALT和AST的活性,评价治疗前后,各组小鼠肝脏血清学指标的变化。
1.2.4肝脏组织病理学分析取小鼠肝脏右大叶,分为3部分,每部分各取一小块组织置于4%多聚甲醛溶液中固定,24 h后制作石蜡切片并做HE染色,于显微镜下观察各组小鼠肝脏的病理学改变,采集图像。
1.3统计方法
运用GraphPad Prism 5.0软件分析数据,血清学数据为符合正态分布的计量资料,以(±s)表示。采用单因素方差分析比较3组间的差异,进一步两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2结果
2.1小鼠BM-MSCs的原代培养和体外扩增
骨髓细胞原代培养的第4天,部分原代细胞(含间充质干细胞)呈现集落或散在的贴壁方式,细胞形态不均一,可见针尖状、多角形和圆形。贴壁的原代细胞对胰酶的反应性不同,尤以MSCs较敏感。因此,体外传代扩增的同时也是细胞纯化的过程。BM-MSCs形态似成纤维样细胞,呈相对均一的长梭形贴壁生长,见图1。
2.2小鼠BM-MSCs对急性肝损伤的修复效果评价
与Oil组小鼠相比,CCl4损伤的小鼠于次日表现出蜷缩、明显的精神萎靡和活力减弱,全身皮毛呈竖立等应激状态,提示小鼠模型构建有效。
2.2.1肝脏大体观的评价细胞移植后第4天(即损伤后第5天),Oil组肝脏呈红褐色,质软,表面光滑均匀无颗粒;CCl4/PBS组肝脏体积增大,质硬,色泽暗淡,约90%的表面覆有粟粒样颗粒;CCl4/BM-MSCs组肝脏虽不及Oil组的柔软红润,但较CCl4/PBS组有了明显的大体改善,表现为质地和色泽,以及表面的颗粒明显减少约50%。
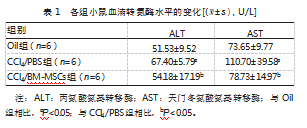
2.2.2血清学指标的评价模型小鼠经CCl4损伤后,血清转氨酶ALT和AST的水平显著升高,至损伤后第5天仍维持在较高的水平,与Oil组水平相比,差异有统计学意义(P均<0.05)。BM-MSCs移植后,小鼠的血清转氨酶水平得以回落,与CCl4/PBS组相比,差异有统计学意义(P<0.05),见表1。
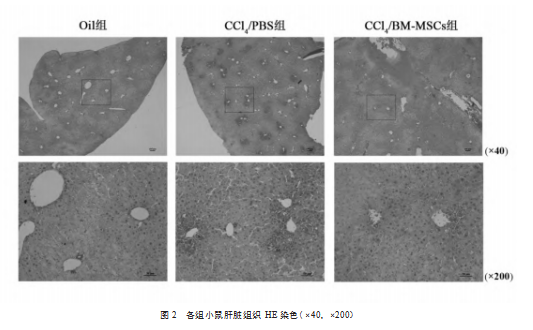
2.2.3肝脏组织病理学评价细胞移植后第4天(即损伤后第5天),各组小鼠的肝组织切片病理结果显示:①Oil组:肝小叶结构完整,肝索排列有序,肝细胞未见病理性改变如空泡变性、坏死等,未见炎性细胞的浸润;②CCl4/PBS组:肝小叶结构破坏,肝索排列紊乱,中央静脉周围见数个片状坏死灶,肝细胞空泡变性伴炎性浸润;③CCl4/BM-MSCs组:与CCl4/PBS组相比,肝细胞坏死灶的数量明显减少,范围明显缩小,肝细胞仍见空泡变性,但炎性浸润明显减少(如图2)。
3讨论
急性肝损伤的发生源于肝脏在短期内受各种有害因素的作用,继而引起肝功能的急性受损,这一病理过程往往与危重症肝病息息相关。在诱导实验动物肝损伤的要素中,CCl4是一种应用广泛且经济方便的化学试剂。现有的研究表明,CCl4剂量和方式的不同可引起多种模型动物不同程度的肝损伤[3]。
本研究采用的造模要素有:小鼠体重为(20±2)g,CCl4浓度为10%(V/V),损伤剂量为5µl/g,方式为单次腹腔注射,损伤终点为24 h。胡凤娇等[6]在对393篇文献的数据挖掘中发现,(20±2)g的小鼠体重最为常用,约84.73%采用单次腹腔注射,且最常见的损伤时间为24 h。据此,本文采用的基础要素与多数研究一致,独创性在于CCl4的浓度和剂量。当损伤24 h后,小鼠存活率100%,但精神状态、活力及全身皮毛都呈明显的损伤应激表现。
ALT和AST是指示肝细胞发生损伤以及严重程度的敏感酶[2]。付双楠等[7]发现,选择CCl4损伤24 h建模更合适,原因之一为ALT(121.98±21.66)U/L和AST(274.27±44.02)U/L均升高(P均<0.01)。本文于损伤24 h建模,并加干预措施(BM-MSCs移植),结果显示:CCl4/PBS组小鼠在损伤第5天时,ALT(67.40±5.79)U/L和AST(110.70±39.58)U/L仍较对照组的(51.53±9.52)、(73.65±9.77)U/L维持在较高水平(P均<0.05)。肝脏形态的肉眼观显示,肝表面颗粒样变占比约90%,与杜斌等[8]结果相符。肝组织病理学显示:相较对照组,CCl4/PBS组肝细胞的空泡变性、坏死及炎性细胞浸润表现较明显,与文献报告一致[2-3,7-10]。综上所述,本研究模型构建成功。
在急性肝损伤模型的治疗方案中,MSCs的移植方式有尾静脉、肝内、腹腔注射等,而尾静脉注射因操作简单易行而最为常用[5]。本研究中,鼠BM-MSCs经尾静脉输注4 d后,CCl4/BM-MSCs组的肝脏无论从大体观(50%表面颗粒样变)还是组织病理学上,均较CCl4/PBS组有显著的修复和改善,同期的ALT(54.18±17.19)U/L和AST(78.73±14.97)U/L活性也明显降低(P均<0.05),接近于对照组水平。目前,将鼠BM-MSCs用于CCl4诱导的小鼠急性肝损伤的研究较少。其中,Milosavljevic N等[10],Liu J等[12]均采用尾静脉移植的研究方式,所得结果与本文一致,即转氨酶活性均明显降低(P均<0.05)。急性肝损伤模型常用于护肝药物的作用及机制研究,其致病机制主要是有毒自由基引起的氧化应激、脂质过氧化和肝细胞坏死[13-14]。而MSCs发挥疗效的机制可能与其肝源性分化、旁分泌效应、免疫调节、外泌体等方面有关[5,12,15]。
综上所述,本研究成功建立了一种短时高效的CCl4诱导小鼠急性肝损伤的模型,证实了小鼠骨髓MSCs对小鼠急性肝损伤具有一定的修复作用。该研究对临床和实验动物“同种异体MSCs疗法”具有一定的参考价值,同时为MSCs参与肝损伤修复机制的探讨提供实验依据。
[参考文献]
[1]Fan H,Tu T,Zhang X,et al.Sinomenine attenuates alcohol-induced acute liver injury via inhibiting oxida⁃tive stress,inflammation and apoptosis in mice[J].Food Chem Toxicol,2022,159:112759.
[2]肖冬焱,何伟,肖志滢,等.淫羊藿苷对四氯化碳诱导小鼠急性肝损伤的保护作用机制[J].中国组织工程研究,2024,28(23):3654-3660.
[3]黎晶晶.粟芽蛋白对四氯化碳诱导的小鼠急性肝损伤的保护作用及其机制[D].南昌:南昌大学,2023.
[4]Kunisaki Y.Pericytes in Bone Marrow[J].Adv Exp Med Biol,2019,1122:101-114.
[5]孙婷,李凡,杜联芳.间充质干细胞治疗急性肝损伤:肝脏归巢率及定向分化能力[J].中国组织工程研究,2019,23(1):125-131.
[6]胡凤娇,宋文杰,王张,等.四氯化碳致小鼠急性肝损伤模型造模要素及中医药防治的数据挖掘研究[J].中药与临床,2018,9(5):34-37,44.
[7]付双楠,高达,郭佳佳,等.四氯化碳致小鼠急性肝损伤模型建立与考察[J].肝脏,2022,27(9):1036-1040.
[8]杜斌,蔡维维,陈俊良,等.25%四氯化碳诱导小鼠急性肝损伤模型血清AST、ALT水平变化[J].现代医药卫生,2018,34(8):1121-1122,1127.
[9]周迎春.四氯化碳诱导的小鼠急性肝损伤模型的实验研究[J].黑龙江中医药,2018,47(1):90-91.
[10]杨帆,魏小果,赵鑫,等.白头翁皂苷B4对四氯化碳致急性肝损伤模型小鼠的保护作用及机制研究[J].中药材,2021,44(12):2938-2942.
[11]Milosavljevic N,Gazdic M,Simovic Markovic B,et al.Mesenchymal stem cells attenuate acute liver injury by altering ratio between interleukin 17 producing and regulatory natural killer T cells[J].Liver Transpl,2017,23(8):1040-1050.
[12]Liu J,Feng B,Xu Y,et al.Immunomodulatory effect of mesenchymal stem cells in chemical-induced liver in⁃jury:A high-dimensional analysis[J].Stem Cell Res,2019,10(1):262.
[13]张维,张运超,胡丞铭,等.姜黄素对四氯化碳诱导小鼠急性肝损伤的预防机制[J].武汉轻工大学学报,2023,42(6):37-46.
[14]黄海锋,庞晓妍,戴卫波,等.柴胡疏肝颗粒通过调控Keap1-Nrf2/HO-1信号通路改善四氯化碳致小鼠急性肝损伤[J].中国药学杂志,2024,59(8):703-712.
[15]Lin F,Chen W,Zhou J,et al.Mesenchymal stem cells protect against ferroptosis via exosome-mediated stabili⁃zation of SLC7A11 in acute liver injury[J].Cell Death Dis,2022,13(3):271.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/80453.html