摘要:目的分析肝细胞肝癌患者磁共振成像(MRI)表现及其对微血管侵犯(MVI)的评估价值。方法选取本院92例接受根治术治疗的肝细胞肝癌患者,均在术前行MRI检查,按照病理学结果,将其分为MVI组与无MVI组,比较两组MRI表现,并以受试者工作特征(ROC)曲线分析MRI表现对MVI的评估价值。结果MVI组与无MVI组肿瘤直径、肿瘤形状比较,差异无统计学意义(P>0.05);MVI组瘤周动脉期强化、肿瘤边缘不光滑占比显著高于无MVI组,差异有统计学意义(P<0.05),肿瘤包膜完整占比显著低于无MVI组,差异有统计学意义(P<0.05);ROC分析显示,瘤周动脉期强化、肿瘤包膜、肿瘤边缘及三项联合评估MVI的曲线下面积(AUC)分别为0.703、0.786、0.753、0.896,三项联合AUC最大,敏感度与特异度分别为90.34%、71.95%。结论肝细胞肝癌患者MRI表现以瘤周动脉期强化、肿瘤边缘不光滑及包膜缺损为主,这些表现联合评估MVI的效能较大,可为MVI评估提供重要指导。
关键词:肝细胞肝癌,磁共振成像,微血管侵犯,评估
0引言
肝癌属于恶性肿瘤病变,临床发病率与致死率均较高。以往研究表明,我国肝癌死亡人数在全球范围居第一[1]。在原发性肝癌患者中,肝细胞肝癌占比达90%以上,具有病情发展快、容易转移及患者预后较差等特征,早期症状一般较为隐匿,大部分患者就诊时已经发展至中晚期[2-3]。临床主要通过根治性切除以及肝移植术等手段进行肝细胞肝癌患者的治疗,然而术后存在较高复发风险,远期生存率并不理想。以往报道指出,微血管侵犯(MVI)属于肝癌术后病灶复发与生存时间较为重要影响因素,相较于无MVI患者,MVI患者复发率增加3.5~14.0倍[4]。故术前准确评估肝细胞肝癌患者MVI情况,对诊疗方案的合理选择、更好延长生存时间以及改善患者预后具有积极指导意义。磁共振成像(MRI)是一种多参数成像方式,软组织分辨率非常高,与电子计算机断层扫描(CT)相比,可以更准确呈现病灶结构[5]。以往关于MRI表现评估肝细胞肝癌MVI的报道争议较大。本文主要探究了肝细胞肝癌患者MRI表现及对MVI的评估价值。本研究已通过医院伦理委员会审核,患者均已签署知情同意书。
1资料与方法
1.1一般资料
选取2019年8月—2022年9月本院接受根治术治疗的肝细胞肝癌患者92例为研究对象。纳入标准:①符合肝细胞肝癌相关诊断标准[6],行肝癌根治术治疗,且经手术病理证实;②单发肿瘤病灶;③术前没有抗肿瘤治疗史;④术前MRI影像资料无缺失。排除标准:①近期存在感染史及手术史;②合并严重脏器疾病、脑血管病变、血液系统病变及自身免疫疾病等;③其他恶性肿瘤患者;④存在远处转移;⑤处于妊娠或哺乳期。按照病理学结果,将其分为MVI组与无MVI组。研究符合《赫尔辛基宣言》原则。
1.2方法
全部患者术前予以MRI设备(型号:MAGNETOM Avanto 1.5T,厂家:西门子公司)扫描,配合八通道相控阵线圈完成检查过程,检查前严格禁食4~6h,并于扫描前10min饮水(控制为500mL),注意扫描从受检者膈肌顶至肝脏,予以T1加权成像(T1WI)、T2WI以及T2WI增强扫描等。相关扫描参数具体为。T1WI:重复时间(TR)169ms,回波时间(TE)4.8ms,层间距、层厚及激励次数分别为1mm、6mm、2次;T2WI:TE90ms,TR 2000ms,其他参数与T1WI一致;T1WI增强:TR与TE分别为4.9ms、2.4ms,层间距、层厚及激励次数分别为0mm、3mm、1次;动态增强扫描过程中,通过高压注射器向受检者肘静脉注射一定造影剂,控制速率3mL/s左右,剂量1.5mL/kg,并在注射完成30s、65s与120s实施肝动/静脉期扫描与平衡期扫描。安排2位工作经验达到10年的放射科医师予以双盲独立评估,如果结果不一致,需要共同讨论后得出统一结果。
1.3观察指标
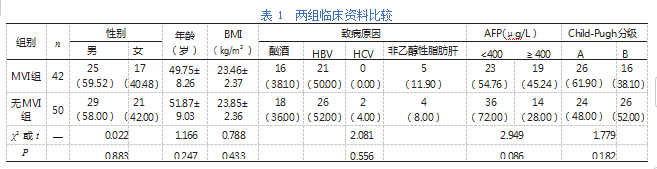
比较两组性别、年龄、体重指数(BMI)、致病原因[酗酒、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)及非乙醇性脂肪肝]、甲胎蛋白(AFP)、Child-Pugh分级等临床资料及MRI表现(包括肿瘤直径、瘤周动脉期强化、肿瘤包膜、肿瘤边缘及肿瘤形状等)。
1.4数据处理
采用SPSS 20.0处理数据,计数资料以“n(%)”形式表示,使用χ2检验;正态分布计量资料以(x—±s)形式表示,使用t检验;以受试者工作特征(ROC)曲线分析MRI表现对MVI评估价值。以P<0.05为差异有统计学意义。
2结果
2.1两组临床资料比较
两组性别、年龄、BMI、致病原因、AFP及Child-Pugh分级比较,差异无统计学意义(P>0.05),见表1。
2.2两组MRI表现比较
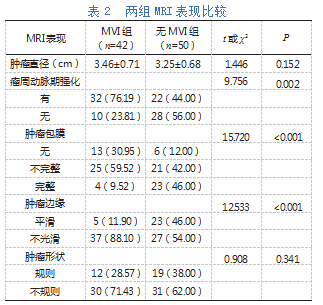
两组肿瘤直径、肿瘤形状比较无显著差异(P>0.05);MVI组瘤周动脉期强化、肿瘤边缘不光滑占比显著高于无MVI组(P<0.05),肿瘤包膜完整占比显著低于无MVI组(P<0.05),见表2。
2.3 MRI表现评估MVI的ROC分析
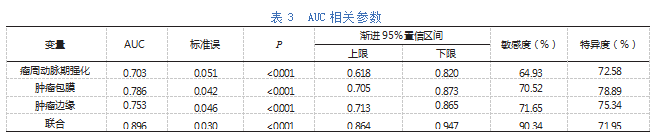
ROC分析显示,瘤周动脉期强化、肿瘤包膜、肿瘤边缘及三项联合评估MVI的曲线下面积(AUC)分别为0.703、0.786、0.753、0.896,三项联合AUC最大,敏感度与特异度分别为90.34%、71.95%,见表3。
3讨论
MVI属于肝细胞肝癌侵袭行为主要指标,其形成于微观尺度,一般依靠术后病理学诊断,然而考虑到MVI患者具有早期接受辅助治疗的潜在需求,且临床现状表明MVI的评估过度依赖手术病理学分析,因此寻找术前无创评估MVI的手段具有一定迫切性及重要意义。术前预测肝细胞肝癌是否存在MVI,有利于手术方案及肝移植受体的更好选择,比如强调手术过程中避免挤压病灶及过度旋转肝脏、获得足够切缘等[7]。同时,对于MVI,临床可以采取更积极的治疗,比如与放射栓塞或者与化疗栓塞相结合进行较大区域消融治疗。以往国内外学者对肝细胞癌患者MVI术前预测开展了不少研究,但相关预测标准缺乏一致性,具有较大争议。
以往多项研究发现MRI对于肝癌MVI具有一定预测价值[8-9],使其开始逐渐得到广泛应用。现阶段,关于MVI的具体影像学表现,临床尚无共识。本研究发现,MVI组瘤周动脉期强化表现占比较无MVI组显著更高,与左立平等[10]研究结论一致,说明瘤周动脉期强化能够用于MVI的评估及预测。该MRI表现可能与肝细胞肝癌病灶微血管浸润后发生灌注改变有关,病灶附近微小肿瘤血栓可对小门静脉分支造成阻塞,使门静脉血流降低,代偿性动脉灌注量提高。故如果MRI检查显示瘤周动脉期强化表现,则MVI可能性较大。以往研究表明,肝细胞肝癌病灶周围纤维包膜组织微血管血流速度减慢可能属于晚期增强的主要原因[11]。相关研究称,纤维包膜里面血管经常受到癌细胞侵袭,提出纤维包膜可用于门静脉入侵情况的预测[12]。亦有报道指出,包膜的存在和肝细胞肝癌病理学结果密切相关,同时包膜不完整有利于MVI产生[13]。
本研究显示,MVI组肿瘤包膜完整占比显著低于无MVI组,基本符合上述研究观点,提示包膜缺损为MVI主要MRI表现。主要因为从病理解剖上来说,包膜是一种纤维囊,可对肿瘤转移与侵袭产生限制作用,若包膜不完整或者缺失时,将增加MVI形成可能性[14-15]。本研究还发现,MVI患者更容易呈现肿瘤边缘不光滑表现。考虑与边缘不光滑的肝细胞肝癌呈局灶性突出状以及多结节融合型,病灶内存在丰富新生肿瘤血管,表现出较大异质性,具有更强侵犯性有关。本研究进一步经ROC分析发现,瘤周动脉期强化、肿瘤包膜、肿瘤边缘单纯及联合评估MVI的AUC依次为0.703、0.786、0.753、0.896,其中联合评估AUC最大,说明这三种MRI表现联合评估MVI效能最大,敏感度高达90.34%,能够有效指导临床术前预测MVI及采取合理治疗措施。
综上所述,肝细胞肝癌患者主要呈现出瘤周动脉期强化、肿瘤边缘不光滑及包膜缺损等MRI表现,将MRI用于MVI的评估,具有较高评估效能,可有效指导肝细胞肝癌临床诊治。
参考文献
[1]Yang JD,Hainaut P,Gores GJ,et al.A global view of hepatocellular carcinoma:trends,risk,prevention and management[J].Nat Rev Gastroenterol Hepatol,2019,16(10):589-604.
[2]Gret en TF,Lai CW,Li G,et al.Targeted a n d I m m u n e-B a s e d T h e r a p i e s f o r Hepatocellular Carcinoma[J].Gastroentero lo gy,2019,156(2):510-524.
[3]Renne S L,S arco gnat o S,Sacchi D,et al.Hepatocellular carcinoma:a clinical and pathological overview[J].Pathologica,2021,113(3):203-217.
[4]E r st a d D J,T ana b e KK.P r o g no stic an d Therapeutic Implications of Micro vascular Invasion in Hepatocellular Carcinoma[J].Ann Surg Oncol,2019,26(5):1474-1493.
[5]Chong HH,Yang L,Sheng RF,et al.Multi-scale and multi-parametric radiomics of gadoxetate disodium-enhanced MRI predicts microvascular invasion and outcome in patients with solitary hepatocellular carcinoma≤5 cm[J].E ur Radiol,2021,31(7):4824-4838.
[6]中华人民共和国国家卫生健康委员会.原发性肝癌诊疗指南(2022年版)[J].中华消化外科杂志,2022,21 (2):143-168.
[7]Lv K,Cao X,D u P,et a l.Radio mic s fo r the detection of microvascular invasion in hepatocellular carcinoma[J].World J Gastroenter ol,2022,28(20):2176-2183.
[8]Dong SY,Wang WT,Chen XS,et al.Microvascular invasion of small hepatocellular carcinoma can be preoperatively predicted by the 3D quantification of MRI[J].Eur Radiol,2022,32(6):4198-4209.
[9]Yang H,Han P,Huang M,et al.The role of gadoxetic acid-enhanced MRI features for predicting microvascular invasion in patients with hepatocellular carcinoma[J].Abdom Radiol(NY),2022,47(3):948-956.
[10]左立平,蒋丰洋,周斌彬,等.术前MRI在预测169例肝细胞肝癌微血管侵犯及早期复发的价值[J].山东大学学报(医学版),2022,60(3):89-95,99.
[11]陆一昕,张卫,王鹏,等.术前磁共振征象分析对孤立性肝细胞肝癌微血管侵犯的预测价值[J].广西医学,2019,41(13):1605-1608.
[12]黄京城,刘金韵,胡景卉,等.增强MRI影像组学对肝癌微血管侵犯的预测价值[J].放射学实践,2022,37(10):1243-1248.
[13]常莉莉,张文军.肝癌MRI表面扩散系数值与病理分级和微血管侵犯的相关性研究[J].中国肿瘤临床与康复,2021,28(8):966-969.
[14]卢长宇,田野,陶博,等.术前超声造影对肝癌介入术后微血管侵犯及早期复发的预测价值[J].中国超声医学杂志,2022,38(10):1119-1123.
[15]Li L,Su Q,Yang H.Preoperative prediction of microvascular invasion in hepatocellular carcinoma:a radiomic nomogram based on MRI[J].Clin Radiol,2022,77(4):e269-e279.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/79817.html