摘要:cGAS-STING是近年发现的一种与免疫及炎症相关的信号通路,由一种新的DNA识别受体cGAS、干扰素刺激因子STING及中间的第二信使cGAMP组成,具有高代谢率的肾脏与此信号通路关系密切。近年研究表明,cGAS-STING在慢性肾脏病中发挥重要作用,以此通路为靶点的药物开发,是学者们关注的重点。本文系统地阐述了cGAS-STING信号通路的组成、活化机制与其在慢性肾脏病中的作用,并围绕cGAS-STING通路治疗肾脏疾病的意义进行了展望。
关键词:cGAS-cGAMP,STING,慢性肾脏病
0引言
cGAS-STING通路是机体感受细胞质中异常存在的DNA并激活I型干扰素免疫反应的重要信号通路,可发挥对抗外源病原体和识别清除内源性损伤的双重作用[1],近年来已成为医学界关注的热点。人类蛋白质图谱分析显示,cGAS不仅在大多数免疫相关器官组织中高度表达,而且在许多非免疫相关组织器官中也有表达[2]。研究发现,cGAS-STING通路的激活可促进脂肪组织产生胰岛素抵抗[3],并引起饮食诱导的非酒精性脂肪肝[4-5],巨噬细胞中的STING在此病理过程中也起重要作用,表明cGAS-STING信号通路在调节代谢中具有潜在的作用。此外,cGAS-STING通路还与细胞的能量代谢以及在不同条件下发生的自噬、凋亡和mTOR信号通路的活化有关[6-7]。
研究证实,炎症是肾脏病发生发展中的重要因素,但具体机制未明[8]。cGAS-STING信号通路一方面作为抗感染的第一道防线,另一方面作为识别外源性DNA与自身dsDNA的感受器,可导致固有免疫系统长期或过度激活,参与许多疾病的病理过程[9]。本文介绍了cGAS-STING信号通路的组成及活化机制,并简要总结了其在慢性肾脏病中的研究进展。
1 cGAS-STING信号通路的组成
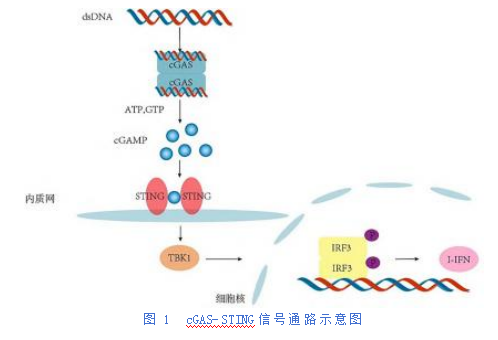
cGAS-STING信号通路主要由环鸟苷单磷酸-腺苷单磷酸合酶(cyclic guanosine monophosphate-adenosine monophosphate synthase,cGAS)和cGAMP的直接受体干扰素基因刺激因子(stimul at or of interferon genes,STING)组成。cGAS属于核苷酸转移酶(NTase)家族,有大约130~150个残基的非结构化,保守性不佳的N末端延伸和是属于核苷酸转移酶(NTase)超家族的高度保守的Mab21结构域组成[10]。当dsDNA被cGAS识别后,它催化ATP和GTP合成第二信使cGAMP[11]。STING又称为是一种定位于线粒体外膜上的多跨膜蛋白,由四部分组成:短N末端胞质段,负责结合TBK1的C末端尾部,四个内质网膜上的跨膜螺旋和胞质配体结构域[12-13]。
2 cGAS-STING信号通路的活化机制
2.1 cGAS的活化
cGAS的C端的Mab21结构域有1个高度保守的锌囊结构,其中的锌离子可维持蛋白结构,这是cGAS识别双链DNA(dsDNA)的重要位点之一,抑制其表达将导致dsDNA无法被识别[14]。cGAS与dsDNA结合而被激活,引起第二信使cGAMP的合成。除了病原体衍生的dsDNA外,cGAS还可被自身DNA激活,如mtDNA和核DNA,这些DNA异常存在于细胞质或微核中,诱发线粒体应激、基因组不稳定性或DNA损伤等情况。cGAS与胞质DNA的结合导致其通过构象变化和二聚化而活化,从而引起其催化位点的重排,这种结合取决于DNA长度,与DNA序列无关,当DNA长度大于16个核苷酸时,才能有效跨越cGAS二聚体的2个DNA结合位点使其产生催化活性。在人体内,cGAS二聚体需要足够长的DNA以协同方式与其结合,长度须大于45个核苷酸,对于小于20个核苷酸长度的DNA只有在cGAS浓度很高的时候才能体外诱导cGAS催化活性[15]。
2.2 cGAS产生刺激因子
cGAS充当DNA受体和核苷酸基转移酶,通过产生CDN(a cyclic dinucleotide)信使与效应器STING进行远距离通信。各种细菌产生CDN,包括cGMP–GMP、cAMP–AMP和3',3'-cGAMP,这些CDN包含两个单磷酸核苷酸,通过磷酸二酯键相互连接形成环状结构。与具有两个3'-5'键的细菌CDN不同,哺乳动物细胞产生2',3'-cGAMP,具有2'-5'和3'-5'磷酸二酯键。尽管细菌CDN也可以激活STING,但2',3'-cGAMP能以更高的亲和力与STING结合,使细胞产生IFN-I和炎性细胞因子[16]。
2.3 STING的功能
STING具有四种功能:IRF3活化、NF-κB活化、自噬调节和通过STING溶酶体运输诱导溶酶体细胞死亡(lysosomal cell death,LCD)。其中,STING通过其N端部分跨越内质网膜四次来活化IRF3。STING的C—末端部分的配体结合结构域(LBD)和C—末端尾部(CTT)都面向胞质(见图1)。在稳态条件下,与内质网结合的STING形成一个二聚体,它们的LBD随即成为一个环状二核苷酸配体,而后形成一个V形配体结合袋,2',3'-cGAMP与STING二聚体的配体结合袋结合。STING二聚体通过其CTT与TBK1结合,配体结合和STING寡聚可能促进了TBK1的反式磷酸化,活性TBK1随后磷酸化STING的CTT(这发生在STING的相邻二聚体上,而不是TBK1结合的二聚体)。CTT磷酸化为IRF3创建一个对接位点,随后被TBK1磷酸化,IRF3随后发生二聚化,获得转录活性[17]。
2.4 cGAMP与STING相互作用
cGAMP促进STING从内质网向高尔基中间隔室和高尔基体的易位,从而激活TBK1/IRF3/I-IFN信号通路,cGAMP与STING的结合也会激活IκB激酶(IKK),这会增加核因子κB(NF-κB)的磷酸化和活化,从而产生许多炎症细胞因子,见图1。
3 cGAS-STING信号通路在慢性肾脏病中的作用
肾脏细胞富含线粒体且新陈代谢活跃,在病理条件下可发生氧化应激,电解质转运效率降低,造成线粒体功能受损和肾小管炎症,这是慢性肾脏病(chronic kidney disease,CKD)潜在发病机制之一[18]。研究发现,cGAS-STING通路可能参与多种肾脏病的发生与发展。
在肾脏的众多病理变化中,肾纤维化是导致终末期肾功能衰竭的常见途径。2019年,Chung等[19]进行肾纤维化相关研究时,发现了CKD的另一致病机制:肾小管细胞中线粒体受损使mtDNA暴露在胞质中,STING途径被激活,引发肾脏炎症,导致CKD的发生。他们发现,肾纤维化患者和相应的动物模型中均存在线粒体转录因子A(mitochondrial transcription factor A,TFAM)的缺失,于是制备了肾小管特异性敲除TFAM基因的小鼠,这些小鼠的肾小管细胞在6周龄时出现了严重的线粒体损伤和能量生成不足,12周龄时出现肾纤维化、炎症反应和进行性氮质血症,并最终死亡。在TFAM敲除小鼠的肾脏细胞中,mtDNA的异常组装可引起胞质易位、cGAS-STING的DNA传感通路激活,表明TFAM基因缺失可直接激活cGAS-STING通路,引起细胞因子的释放和免疫细胞的募集。STING基因敲除可以改善Tfam基因缺失诱导的小鼠肾纤维化和肾衰竭,抑制STING的活性也能够减轻小鼠肾脏纤维化。
研究显示,STING-PERK-eIF2α信号通路能够调控mRNA的帽依赖翻译机制[20]。mRNA与cGAMP结合后,STING的胞内结构域与PERK的胞内激酶结构域相互作用,直接激活PERK,触发真核起始因子2α(eIF2α)的磷酸化,而且它能通过调控mRNA的翻译上调胶原蛋白的表达量,并促进肾脏纤维化。此机制对肾纤维化的调控在时间上明显早于经典的STING-TBK1-IRF3信号,在功能上,cGAS-STING-PERK-eIF2通路的激活显著抑制细胞mRNA翻译的总体水平,但特异地促进部分炎症和存活相关蛋白的合成。因而,我们猜测,从药理学和遗传学上以cGAS-STING-PERK-eIF2α轴为靶点进行治疗,能够显著改善肾纤维化。
糖尿病肾病(diabetic kidney disease,DKD)是导致终末期肾脏病的主要原因之一,肾细胞损伤是其诱因之一。研究表明,在肾功能障碍早期,脂肪毒性会造成足细胞的线粒体损伤,并使mtDNA通过BAX进入胞质,经此途径进入胞质的mtDNA能在无脂肪毒性的条件下激活cGAS-STING通路,继而引起下游TBK1和NF-κB通路的活化,造成足细胞损伤[21]。于是,我们认为mtDNA-cGAS-STING通路是DKD或其他肥胖相关肾脏疾病的潜在治疗靶点之一。
系统性红斑狼疮(systemic lupus erythematosus,SLE)是狼疮性肾炎(lupus nephritis,LN)的诱因之一。研究表明,固有免疫和适应性免疫能激活人体对SLE的自身免疫,它的机制为:中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)累积造成核膜损伤,自身抗原持续暴露于免疫系统,在IFN介导下,进入胞质的mtDNA容易被线粒体ROS氧化。氧化的mtDNA对外周血单个核细胞(peripheral blood mononuclear cell,PBMC)和Thp1细胞来说是一种强有力的炎性刺激,并能够通过STING途径诱导IFN刺激基因(IFN-stimulated gene,ISG)的表达,达到促炎的目的[22-23]。足细胞的自噬和凋亡也是LN的发病机制之一。LN患者肾脏炎症微环境中的细胞因子能够作用于足细胞,使它分泌更多的促炎细胞因子,加重局部炎症反应;G1、G2为载脂蛋白L1抗体(Apolipoprotein L1,APOL1)的风险等位基因,人体足细胞中被激活的cGAS-STING通路和IFN信号能上调G1和G2的表达,这与终末期LN在非洲裔美国人中的加速进展有关[24]。
4展望
自2013年完整的cGAS-STING信号通路被发现后,学者们一直在各领域对其开展研究,cGAS-STING在肾脏疾病的相关研究也越来越多。但对于如何通过调控cGAS-STING途径缓解肾脏病以及STING是否存在其他上游通路等问题,目前尚不明确。因此,cGAS-STING信号通路的研究对于阐明慢性肾脏病的发病机制具有重要意义,相关研究成果可能对慢性肾脏病的防治提供新思路。
参考文献
[1]刘佳烨,公伟,张爱华.cGAS-cGAMP-STING信号通路的活化机制及其在肾脏疾病中作用的研究进展[J].中华肾脏病杂志,2021,37(4):369-374.
[2]Bai J,Liu F.cGAS-STING signaling and function in metabolism and kidney diseases[J].J Mol Cell Biol,2021,13(10):728-738.
[3]Bai J,Cervantes C,Liu J,et al.DsbA-L prevents obesity-induced inflammation and insulin resistance by suppressing the mtDNA release-activated cGAS-cGAMP-STING pathway[J].ProcNatl Acad Sci U S A,2017,114(46):12196-12201.
[4]Luo X,Li H,Ma L,et al.Expression of STING Is Increased in Liver Tissues From Patients With NAFLD and Promotes Macrophage-Mediated Hepatic Inflammation and Fibrosis in Mice[J].Gastro enterology,2018,155(6):1971-1984.
[5]Xiong X,Wang Q,Wang S,et al.Mapping the molecular signatures of diet-induced NASH and its regulation by the hepatokine Tsukushi[J].Mol Metab,2019,20(12):128-137.
[6]Lei Z,Deng M,Yi Z,et al.cGAS-mediated autophagy protects the liver from ischemia-r e p e r f u s i o n i n j u r y i n d e p e n d e n tly o f STING[J].Am J Physiol Gastro intest Liver Physiol,2018,314(6):G655-G667.
[7]Lum KK,Song B,Federspiel JD,et al.Interactome and Proteo me Dynamics Uncover Immune Modulatory Associations of the Pathogen Sensing Factor cGAS[J].Cell Syst,2018,7(6):627-642.
[8]Gutierrez OM,Shlipa k MG,Katz R,et al.A s s o c iatio n s of Pla sma Biomar k er s of Inflammation,Fibrosis,and Kidney Tubular Injury With Progression of Diabetic Kidney Disease:A Cohort Study[J].Am J Kidney Dis,2022,79(6):849-857.
[9]Bai J,Liu F.The cGAS-cGAMP-STING Pathway:A Molecular Link Between Immunity and Metabolism[J].Diabetes,2019,68(6):1099-1108.
[10]Civril F,Deimling T,de Oliveira Mann CC,et al.Structural mechanism of cytosolic DNA sensing by cGAS[J].Nature,2013,498(7454):332-337.
[11]阳怡羽,张旭飞,吴秀文,等.cGAS-STING通路与自噬交互作用的研究进展[J].医学研究生学报,2022,35(5):532-537.
[12]Jin L,Hill KK,Filak H,et al.MPYS is required for IFN response factor 3 activation and type I IFN production in the response of cultured phagocytes to bacterial second messengers cy c lic-di-AMP a n d cy c lic-di-G MP[J].J Immunol,2011,187(5):2595-2601.
[13]Zhang X,Bai XC,Chen ZJ.Structures and Mechanisms in the cGAS-STING Innate Immunity Pathway[J].Immunity,2020,53(1):43-53.
[14]谭星,庞晓燕,郝秀静,等.胞质DNA感受器c GAS的研究进展[J].中国免疫学杂志,2021,37(21):2569-2574,2579.
[15]Cheng Z,Dai T,He X,et al.The interactions between cGAS-STING pathway and pathogens[J].Signal Transduct Target Ther,2020,5(1):91.
[16]Skopelja-Gardner S,An J,Elk on KB.Role of the c GAS-STING pathway in systemic a nd o r ga n-spec ific diseases[J].Nat Rev Nephrol,2022,18(9):558-572.
[17]Hopfner KP,Hornung V.Molecular mechanisms and cellular functions of cGAS-STING signalling[J].Nat Rev Mol Cell Biol,2020,21(9):501-521.
[18]For bes JM,Thor b u r n DR.Mitocho nd r ia l dysfunction in diabetic kidney disease[J].Nat Rev Nephrol,2018,14(5):291-312.
[19]Chung KW,Dhillon P,Huang S,et al.Mitochondrial Damage and Activation of the STING Pathway Lead to Renal Inflammation and Fibrosis[J].Cell Metab,2019,30(4):784-799.
[20]Zhang D,Liu Y,Zhu Y,et al.A non-canonical cGAS-STING-PERK pathway facilitates the translational program critical for senescence and organ fibrosis[J].Nat Cell Biol,2022,24(5):766-782.
[21]Zan g N,Cui C,Guo X,et al.c GAS-STING activation contributes to podocyte injury in diabetic kidney disease[J].iScience,2022,25(10):105145.
[22]Loo d C,Blanco LP,Pur malek MM,et al.Neutro phil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease[J].Nat Med,2016,22(2):146-153.
[23]刘瑞华,余学清,阳晓.狼疮肾炎发病机制的研究进展[J].中华肾脏病杂志,2019,35(12):950-953.
[24]Davis SE,Khatua AK,Popik W.Nucleosomal dsDNA Stimulates APOL1 Expression in Human Cultured Podocytes by Activating the cGAS/IFI16-STING Signaling Pathway[J].Sci Rep,2019,9(1):15485.
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/79298.html