SCI论文(www.lunwensci.com)
【摘要】目的:观察艾曲泊帕联合强化免疫抑制治疗再生障碍性贫血(AA)患者的效果。方法:选取2018年12月至2020年12月该院收治的90例AA患者进行前瞻性研究,按照随机数字表法将其分为对照组和观察组各45例。对照组采用强化免疫抑制治疗,观察组在对照组基础上采用艾曲泊帕治疗。比较两组临床疗效、治疗前后血常规指标(中性粒细胞计数、血红蛋白和血小板计数)水平、外周血T细胞指标[调节性T细胞(Treg)、辅助性T细胞17(Th17)]水平、炎性因子[白细胞介素-10(IL-10)、IL-6、IL-17]水平,以及不良反应发生率。结果:观察组治疗总有效率为95.56%(43/45),高于对照组的82.22%(7/45),差异有统计学意义(P<0.05);治疗后,两组中性粒细胞计数、血红蛋白水平、血小板计数均高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05);治疗后,两组Treg、IL-10水平均高于治疗前,且观察组高于对照组,两组Th17、IL-6、IL-17水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05);两组不良反应发生率比较,差异无统计学意义(P>0.05)。结论:艾曲泊帕联合强化免疫抑制治疗AA患者可提高治疗总有效率,改善血常规指标、外周血T细胞和炎性因子水平,效果优于单纯强化免疫抑制治疗。
【关键词】艾曲泊帕;强化免疫抑制;再生障碍性贫血;血常规;T细胞;炎性因子
Effects of Eltrombopag combined with intensive immunosuppression in treatment of patients with aplastic anemia
FANG Min
(Department of Hematology of the Central Hospital of Jiamusi City,Jiamusi 154002 Heilongjiang,China)
【Abstract】Objective:To observe effects of Eltrombopag combined with intensive immunosuppression in treatment of patients with aplastic anemia(AA).Methods:A prospective study was conducted on 90 AA patients admitted to the hospital from December 2018 to December 2020.They were divided into control group and observation group according to the random number table method,45 cases in each group.The control group was treated with intensive immunosuppressive therapy,while the observation group was treated with Eltrombopag on the basis of that of the control group.The clinical efficacy,the blood routine levels(neutrophil count,hemoglobin level and platelet count,the peripheral blood T cell index levels[regulatory T cell(Treg),helper T cell 17(Th17)],the inflammatory factor levels[interleukin-10(IL-10),IL-6,IL-17],and the incidence of adverse reactions were compared between the two groups before and after the treatment.Results:The total effective rate of treatment in the observation group was 95.56%(43/45),which was higher than 82.22%(7/45)in the control group,and the difference was statistically significant(P<0.05).After the treatment,the neutrophil counts,the hemoglobin levels and the platelet counts in the two groups were higher than those before the treatment,those in the observation group were higher than those in the control group,and the differences were statistically significant(P<0.05).After the treatment,the levels of Treg and IL-10 in the two groups were higher than those before the treatment,and those in the observation group were higher than those in the control group;the levels of Th17,IL-6 and IL-17 in the two groups were lower than those before the treatment,and those in the observation group were lower than those in the control group;and the differences were statistically significant(P<0.05).However,there was no significant difference in the incidence of adverse reactions between the two groups(P>0.05).Conclusions:Eltrombopag combined with intensive immunosuppressive therapy for the AA patients can improve the total effective rate of treatment,improve the levels of blood routine,peripheral the blood T cells and inflammatory factors.Moreover,it is superior to single intensive immunosuppressive therapy.
【Keywords】Eltrombopag;Intensive immunosuppression;Aplastic anemia;Blood routine;T cell;Inflammatory factor
再生障碍性贫血(AA)是以全血细胞减少为主要表现的疾病,我国年发病率约为0.74/10万人,患者常伴有贫血、出血、感染等症状[1-2]。免疫抑制剂具有非特异性抑制免疫功能,可影响核酸代谢,抑制淋巴细胞增生,干扰抗体形成,是当前治疗AA患者的常用手段,但无法有效改善贫血症状[3-4]。血小板下降是AA的特征之一,艾曲泊帕是一种非肽类小分子血小板生成素(TPO)受体激动剂,能够促进血小板生成,达到治疗目的[5]。本文观察艾曲泊帕联合强化免疫抑制治疗AA患者的效果。
1资料与方法
1.1一般资料选取2018年12月至2020年12月本院收治的90例AA患者进行前瞻性研究。纳入标准:符合《再生障碍性贫血诊断与治疗中国专家共识(2017年版)》中相关诊断标准[6],经血常规、骨髓活检等检查确诊;近6个月未使用过免疫制剂;入组前未接受AA相关治疗。排除标准:合并肝、肾功能不全;存在病毒、细菌等急慢性感染;伴皮肌炎、硬皮病等自身免疫性疾病;合并脾功能亢进、骨髓增殖性肿瘤等疾病。患者及家属均知情本研究内容并签署知情同意书,本研究经本院医学伦理委员会批准。按照随机数字表法将其分为对照组和观察组各45例。对照组:男25例,女20例;年龄15~59岁,平均(36.07±3.58)岁;病程2个月至13年,平均(3.05±0.26)年。观察组:男23例,女22例;年龄15~60岁,平均(36.09±3.60)岁;病程3个月至14年,平均(3.08±0.27)年。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。
1.2方法对照组采用强化免疫抑制治疗,包括兔抗人胸腺细胞免疫球蛋白(Genzyme Polyclonals S.A.S,国药准字J20150136,25 mg),静脉滴注,3.5 mg/(kg·d),连续用药5d;环孢素口服溶液(杭州中美华东制药有限公司,国药准字H10930130,50 mL∶5 g),起始剂量3~5 mg/(kg·d),分2次口服,1~2周后逐渐增加剂量至4~8 mg/(kg·d),维持血药浓度在200~400 ng/mL,治疗6个月。
观察组在对照组基础上采用艾曲泊帕乙醇胺片(Novartis Farmaceutica SA,国药准字J20170387,25 mg)口服治疗,起始剂量25 mg/d,每次增加25 mg,1周内增加至75 mg/d,1次/d,之后以此剂量维持治疗6个月。
1.3观察指标(1)比较两组临床疗效[7]。显效:贫血和出血症状消失,血红蛋白水平、中性粒细胞计数及血小板计数显著改善;有效:贫血和出血症状明显好转,血红蛋白水平、中性粒细胞计数及血小板计数有所改善;无效:未达上述标准。总有效率=(显效+有效)例数/总例数×100%。(2)比较两组治疗前后血常规指标水平。采集患者外周静脉血5 mL,用H30 Pro型全自动血细胞分析仪检测中性粒细胞计数、血红蛋白水平和血小板计数。
(3)比较两组治疗前后外周血T细胞指标和炎性因子水平。采集患者外周静脉血5 mL,采用流式细胞仪检测调节性T细胞(Treg)、辅助性T细胞17(Th17)水平;采用酶联免疫吸附法检测血清白细胞白介素-10(IL-10)、IL-6、IL-17水平。(4)比较两组不良反应发生率。
1.4统计学方法采用SPSS 25.0统计学软件处理数据,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
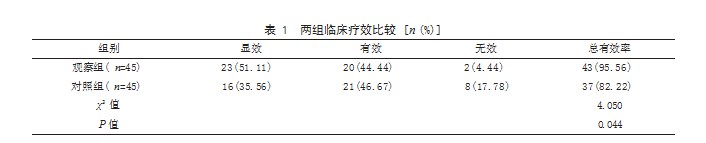
2.1两组临床疗效比较观察组治疗总有效率为95.56%(43/45),高于对照组的82.22%(37/45),差异有统计学意义(P<0.05)。见表1。
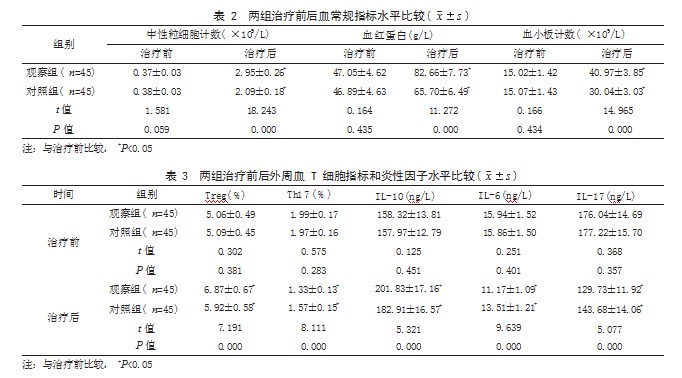
2.2两组治疗前后血常规指标水平比较治疗前,两组中性粒细胞计数、血红蛋白水平、血小板计数比较,差异均无统计学意义(P>0.05);治疗后,两组中性粒细胞计数、血红蛋白水平、血小板计数均高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05)。见表2。
2.3两组治疗前后外周血T细胞指标和炎性因子水平比较治疗前,两组外周血T细胞指标和炎性因子水平比较,差异均无统计学意义(P>0.05);治疗后,两组Treg、IL-10水平均高于治疗前,且观察组高于对照组,两组Th17、IL-6、IL-17水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)。见表3。
2.4两组不良反应发生率比较观察组不良反应发生率为11.11%(5/45),对照组不良反应发生率为4.44%(2/45),两组不良反应发生率比较,差异无统计学意义(P>0.05)。见表4。
3讨论
AA的发病机制尚未完全阐明,可能与遗传、化学毒物、电离辐射、病毒感染等因素有关。目前研究认为,造血干/祖细胞、造血微环境、免疫系统等异常在AA发病中起关键作用,近年来细胞因子学说也逐渐受到关注,调节细胞因子可能成为治疗AA的可行方向之一[8]。兔抗人胸腺细胞免疫球蛋白与环孢素可发挥免疫抑制作用,缓解AA患者临床症状,达到治疗目的[9]。
本研究结果显示,观察组治疗总有效率高于对照组;治疗后,观察组中性粒细胞计数、血红蛋白水平和血小板计数均高于对照组,这一结果与文献报道相一致[10]。分析原因为艾曲泊帕可与TPO受体跨膜结构域相互作用,启动信号级联反应,诱导巨核细胞和骨髓造血干细胞增殖、分化,促进血小板生成,从而改善造血功能,且不会影响内源性TPO水平[11-12],与强化免疫抑制联用可发挥协同增效作用。
已知Treg与Th17细胞功能相互拮抗,并处于动态平衡状态,若平衡状态被打破可导致造血干细胞功能异常[13]。IL-10是由Treg产生的抗炎因子,能调控自身免疫性疾病。IL-6、IL-17是由Th17分泌的炎性因子,能促进炎性细胞聚集,导致造血干细胞损伤、凋亡。本研究结果同时显示,治疗后,观察组Treg、IL-10水平均高于对照组,Th17、IL-6、IL-17水平均低于对照组。分析原因可能为免疫抑制剂通过抑制AA患者的Th活化和功能亢进而降低IL-6、IL-17的表达;以及通过增强Treg的作用而增加IL-10的表达,而艾曲泊帕可诱导骨髓祖细胞的增殖和分化,产生具有免疫抑制功能的髓系抑制性细胞,起到免疫调节作用,使Treg及其相关因子IL-10水平升高,Th17、IL-6、IL-17水平降低[14-15]。本研究结果还显示,两组不良反应发生率比较,差异无统计学意义。提示联合艾曲泊帕用药未增加安全风险。
综上所述,艾曲泊帕联合强化免疫抑制治疗AA患者可提高治疗总有效率,改善血常规指标、外周血T细胞和炎性因子水平,效果优于单纯强化免疫抑制治疗。
参考文献
[1]赵砚荣,成静.艾曲泊帕在免疫性血小板减少症、再生障碍性贫血和骨髓增生异常综合征中的应用进展[J].中国当代医药,2019,26(35):29-33.
[2]杨洁茹,王化泉,邵宗鸿.艾曲泊帕治疗再生障碍性贫血作用机制的研究进展[J].中华医学杂志,2020,100(32):2557-2560.
[3]武利强,黄丽芳,杨慧,等.一线单倍体造血干细胞移植或强化免疫抑制治疗中性粒细胞为0暴发型再生障碍性贫血研究[J].中国实用内科杂志,2021,41(10):873-876.
[4]贾晋松.重型再生障碍性贫血细胞免疫功能异常与强化免疫抑制治疗的关系[J].中国实用内科杂志,2021,41(1):40-44.
[5]袁芳芳,张青兰,张丽娜,等.艾曲泊帕、重组人血小板生成素联合标准免疫抑制治疗重型再生障碍性贫血16例疗效及安全性分析[J].中华血液学杂志,2021,42(12):1021-1024.
[6]付蓉.再生障碍性贫血诊断与治疗中国专家共识(2017年版)[J].中华血液学杂志,2017,38(1):1-5.
[7]中华医学会血液学分会红细胞疾病(贫血)学组.再生障碍性贫血诊断治疗专家共识[J].中华血液学杂志,2010,31(11):790-792.
[8]刘海芸,刘婷婷.再生障碍性贫血发病机制研究进展[J].中国实验血液学杂志,2015,23(4):1216-1220.
[9]陈苗,吴亚妹,周道斌,等.强化免疫抑制治疗和单倍体移植治疗年轻重型再生障碍性贫血的比较[J].基础医学与临床,2020,40(6):759-764.
[10]柴星星,李瑞鑫,杜晓鹏,等.艾曲泊帕联合强化免疫治疗老年重型再生障碍性贫血35例分析[J].中国实用内科杂志,2021,41(4):301-305.
[11]蔡嘉惠.艾曲泊帕联合环孢素治疗再生障碍性贫血的疗效分析[J].北方药学,2021,18(7):66-67.
[12]王超.艾曲泊帕联合CsA及G-CSF治疗重型再生障碍性贫血的回顾性研究[J].临床医学,2021,41(12):91-93.
[13]王蕊,董彩丽,赵云婷,等.Treg/Th17细胞失衡及相关细胞因子表达水平与再生障碍性贫血的关系分析[J].河北医学,2020,26(10):1738-1742.
[14]柴星星,何广胜,何耀,等.艾曲波帕联合标准剂量强化免疫抑制治疗老年重型再生障碍性贫血[J].临床血液学杂志,2019,32(9):683-686.
[15]丁宇斌,唐玉凤,唐旭东.艾曲波帕在重型再生障碍性贫血治疗中的应用进展[J].山东医药,2019,59(18):91-94.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/60787.html