SCI论文(www.lunwensci.com)
摘要:目的 利用生物信息学分析方法预测布鲁氏菌外膜蛋白 OmpW 家族蛋白(OmpW family protein)的理化性质、信号肽、蛋白结 构和抗原表位, 为布鲁氏病基因疫苗的研制提供理论基础。 方法 从 GenBank 中获取 OmpW 家族蛋白的氨基酸序列, 运用在线软件 Port- Param 分析 OmpW 家族蛋白的理化性质;采用UCL 在线分析工具预测 OmpW 家族蛋白的二级结构, SWISS-MODEL 在线分析工具预测其 三级结构。 结果 利用在线软件预测布鲁氏菌外膜蛋白 OmpW 分子式为 C1136H1717N281O321.脂肪族指数为 91.63.理论蛋白等电点(pI 值) 为 5.67 ,原子总数为 3 457 ,其氨基酸序列 Ala ( A )占 12.3% 、Gly ( G )占 10.6% 。正电荷残基(Arg+Lys) 、负电荷残基(Asp+Glu) 总数分别为 16 和 18.其不稳定系数为 23.01.该蛋白为稳定蛋白, 亲水性系数为 GRAVY 为 0.143 。结论 OmpW 有一个跨膜结构域, 存 在糖基化位点和磷酸化位点,具有多个抗原表位。二级结构有链、螺旋和卷曲;三级结构为单聚体,属于外膜蛋白家族。本研究结果为 进一步研究布鲁氏菌外膜蛋白 OmpW 家族蛋白及疫苗的开发与研制提供了理论依据。
关键词: 布鲁氏菌,OmpW 家族蛋白,生物信息预测
Prediction of biological information of outer membrane protein OmpW family of Brucella
BO Yaning1. ZHUANG Tianrui2. GAO Yue3. SUN Jingnan4. WANG Rui6. HU Hai5. GAO Zhixiang2. YU Hui5*
(1. Ulanqab Clinical Medical College, Baotou Medical College; 2. School of public health, Baotou Medical College; 3. School of traditional
Chinese Medicine; 4. School of Stomatology; 5. School of Basic Medicine, Inner Mongolia, Baotou 014010. China; 6. Inner Mongolia Medical University, Inner Mongolia, Hohhot 010010. China)
Abstract: Objective The physicochemical properties, signal peptides, protein structure and epitopes of OmpW family of Brucella outer membrane proteins were predicted by bioinformatics analysis. It provides theoretical basis for the development of Brucellosis gene vaccine. Methods The amino acid sequence of OmpW family protein was obtained from GenBank, and the physicochemical properties of OmpW family protein were analyzed by Port-Param software. UCL online analysis tool and Swiss-Model online analysis tool were used to predict the secondary structure of OmpW family proteins. Results The molecular formula of OmpW was C1136H1717N281O321. the aliphatic index was 91.63. the theoretical pI value was 5.67. the total number of atoms was 3457. the amino acid sequence Ala(A) was 12.3%, Gly(G) was 10.6%. The total number of positive charge residues (Arg+Lys) and negative charge residues (Asp+Glu) were 16 and 18. respectively, and their instability coefficient was 23.01. The protein is stable and its hydrophilic coefficient is GRAVY 0.143. OmpW has a transmembrane domain with glycosylation and phosphorylation sites and multiple epitopes. Secondary structures have chains, helices and curls; The tertiary structure is monomer and belongs to the outer membrane protein family. Conclusion This study provides a theoretical basis for further research on OmpW family of Brucella outer membrane proteins and the development and development of vaccines.
Keywords: Brucella; OmpW family protein; Bioinformation prediction
布鲁氏菌(Brucella)是一种胞内寄生革兰氏阴性菌, 布鲁氏菌所致的布鲁氏菌病为一种人畜共患病。布鲁氏菌 的自然宿主以牛、羊等家畜以及人类为主。感染会导致家 畜的睾丸炎、流产或不孕不育;人感染后引发波状热,临 床并发心内膜炎、肝脾肿大、关节病变或骨髓增生等,以 生殖系统疾病为多 [1] 。随着研究不断进展,根据宿主偏好 性和生化表型对布鲁氏菌的分类也越来越多,但是人类对 于防治布鲁氏菌依然没有效果较为理想的疫苗。
外膜蛋白( Outer membrane proteins, OMP)是一种仅 存在于革兰氏阴性菌中的特殊蛋白质,通常具有一个跨膜结 构域, 位于细菌外膜, 该跨膜结构域是细菌存活和毒力发挥 的关键因素, 主要包括 OmpA、OmpW 等 [2]。由于布鲁氏菌 的外膜蛋白具有较强的免疫原性,所以布鲁氏菌可以逃避巨 噬细胞的免疫监控与反应。细胞死亡分析显示, T4SS 效应 VceC 和两个不同的分泌蛋白 OmpW 家族蛋白(BAB1_1579 和蛋白 BAB1_1185)与布鲁氏菌细胞毒性有关。这项研究 提出对于布鲁氏菌细胞毒性相关的分子机制新的见解和为 布鲁氏菌筛选候选疫苗的筛选提供有价值的信息 [3]。
对布鲁氏菌外膜蛋白 OmpW 家族蛋白进行生物信息学 分析, 可以进一步了解 OmpW 家族蛋白基因表达、蛋白质 特性、蛋白质结构功能、免疫学特性等相关信息, 为日后深 入研究其作用提供更多理论依据,也为研发更加安全有效 的布鲁氏菌疫苗和临床治疗药物提供了一定的理论基础。
1 材料与方法
从 NCBI-Gene (https://www.ncbi.nlm.nih.gov)基因数 据库找到不同种布鲁氏菌外膜蛋白 OmpW 家族蛋白基因 序列和蛋白质氨基酸序列。
1.1 蛋白质理化性质分析 运用在线分析工具 ProtPararm ( https://web.expasy.org/protparam/ )分析布鲁氏菌外膜蛋白 OmpW 家族蛋白的一些物理和化学参数,如氨基酸和原 子组成、正负电荷残基数、分子量、等电点、分子式、半 衰期、不稳定系数、脂肪族指数、亲水性系数等。
1.2 蛋白质跨膜结构域及信号肽预测 运用 TMHMM 预 测布鲁氏菌外膜蛋白 OmpW 家族蛋白的跨膜结构域;使 用 novopro 网站( https://novopro.cn/tools/signalp )预测布鲁 氏菌外膜蛋白 OmpW 家族蛋白的信号肽。
1.3 蛋白质的糖基化及磷酸化位点预测 通过 NetPhos3. 1 ( https://services.healthtech.dtu.dk/service.php?NetPhos-3.1 ) 预测布鲁氏菌外膜蛋白 OmpW 家族蛋白磷酸化作用位点, 采用 NetNGlyc1.0 在线分析布鲁氏菌外膜蛋白 OmpW 家 族蛋白糖基化作用位点。
1.4 蛋白质二级结构预测 通过 UCL( http://bioinf.cs.ucl. ac.uk/psipred/ )在线分析工具预测布鲁氏菌外膜蛋白 OmpW 家族蛋白的二级结构。
1.5 蛋白质的三级结构预测及建模 利用在线软件 SWIWW-MODEL( https://swissmodel.expasy.org/interactive/ GBJVfy/models/)预测并建立布鲁氏菌外膜蛋白 OmpW 家 族蛋白的三级结构模型。
1.6 B、T 细胞抗原表位预测 通过 ABCPred(https://webs. iiitd.edu.in/raghava/abcpred/ )预测布鲁氏菌外膜蛋白 OmpW 家 族蛋白的 B 细胞抗原表位;通过 NetMHCcons-1.1 ( https:// services.healthtech.dtu.dk/service.php?NetMHCcons-1.1 )预 测该蛋白的 T 细胞抗原表位。
2 结果
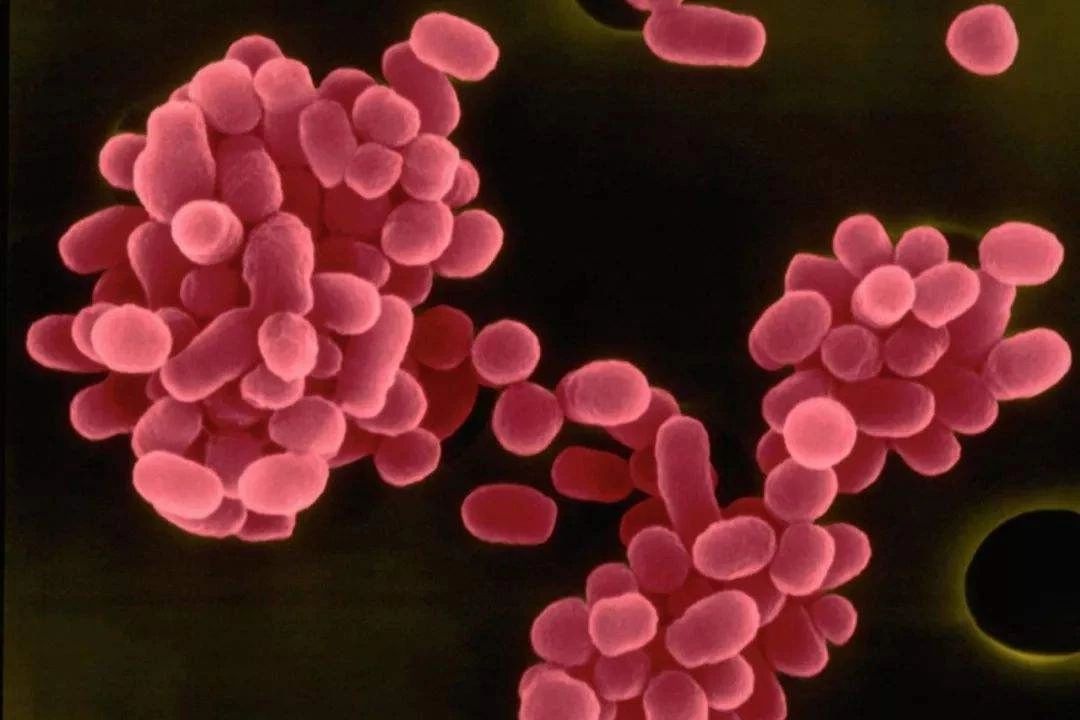
2.1 不同种布鲁氏菌外膜蛋白 OmpW 家族蛋白基因序 列 从 NCBI-Gene 数据库中获得马耳他氏布鲁氏菌、猪 布鲁氏菌、犬布鲁氏菌、绵羊附睾种布鲁氏菌、流产布鲁 氏菌、中间型布鲁氏菌中外膜蛋白 OmpW 家族蛋白基因 序列,见表 1.
以上 6 种布鲁氏菌外膜蛋白OmpW 家族蛋白基因一 致, 共有 684 个碱基, 基因序列 NCBI-Gene 基因数据库中 可查询。
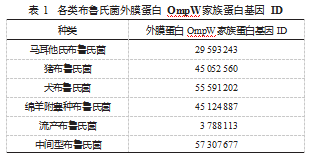
2.2 OmpW 家族蛋白的氨基酸序列 OmpW 家族蛋白基 因编码蛋白共含有 227 个氨基酸残基,见表 2.
2.3 OmpW 家族蛋白的理化性质 ProtPararm 在线分析工 具分析布鲁氏菌外膜蛋白 OmpW 家族蛋白理化性质。布 鲁氏菌外膜蛋白 OmpW 分子式为 C1136H1717N281O321 ,脂肪族 指数为 91.63.理论 pI 值为 5.67.原子总数为 3 457.其氨 基酸序列 Ala( A)占 12.3%、Gly( G)占 10.6%。正电荷残基 (Arg+Lys)、负电荷残基(Asp+Glu)总数分别为 16 和 18. 其不稳定系数为 23.01.该蛋白为稳定蛋白,亲水性系数 为 GRAVY 为 0.143.体外哺乳动物的网织红细胞半衰期是30 h,酵母体内半衰期为 >20h,大肠杆菌体内半衰期 >10h。
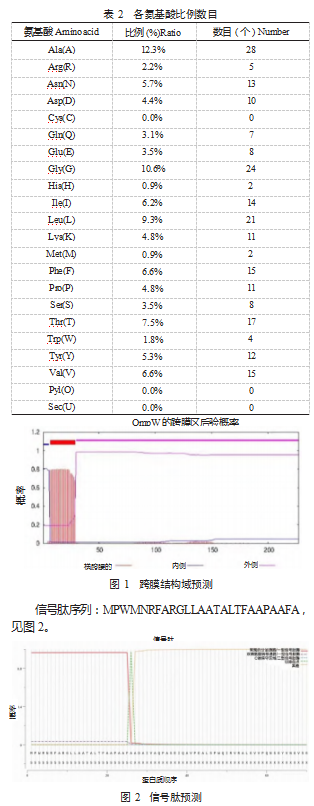
2.4 OmpW 家族蛋白的跨膜结构域及信号肽预测 经过 TMHMM Server v.2.0 对于布鲁氏菌外膜蛋白OmpW 家族 蛋白进行跨膜结构域预测, 结果显示在其 7~29 位氨基酸 处存在有一个跨膜结构域,见图 1.
经 novopro 网站进行 OmpW 蛋白信号肽预测, 结果显 示有信号肽的概率为: 96.481% ,信号肽类型: SP ( Sec/ SPI );切割位点: 26~27.概率: 97.400%。
信号肽序列:MPWMNRFARGLLAATALTFAAPAAFA,见图 2.
2.5 OmpW 家族蛋白的糖基化和磷酸化分析 经过NetPhos3. 1 进行布鲁氏菌外膜蛋白 OmpW 家族蛋白磷酸
化位点预测。发现存在 17 个磷酸化位点,分别位于第 15、87、98、132、148、156、209、221、224 位苏氨酸(T ); 位 于第 61、72、100 位酪氨酸(Y );位于第 43、66、68、73、 108 位丝氨酸( S )等氨基酸处(见图 3 );并存在 1 个 N- 糖基化位点,位于第 146 位(0.6939)氨基酸处(见图 4 );没有发现存在 O- 糖基化位点。
2.6 OmpW 家族蛋白的二级结构预测 布鲁氏菌外膜蛋 白 OmpW 家族蛋白的二级结构中有链( Strand ) 13 个,螺旋(Holix ) 2 个,卷曲(Coil ) 16 个,见图 5、图 6.
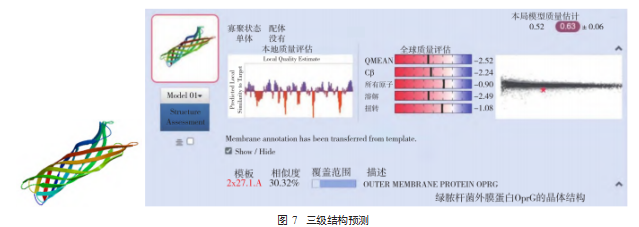
2.7 OmpW 家族蛋白的三级结构预测 利用在线软件 SWIWW-MODEL 预测并建立布鲁氏菌外膜蛋白 OmpW 家族蛋白的三级结构模型。其 GMQW 值为 0.52.说明结 果可信度高,预测 OmpW 家族蛋白为单聚体,属于外膜 蛋白家族,见图 7.
2.8 OmpW 家族蛋白的 T、B 细胞抗原表位预测 通 过 ABCPred( https://webs.iiitd.edu.in/raghava/abcpred/ ) 预 测 蛋 白 共 有 2 4 个 B 细 胞 抗 原 表 位, 如 2 0 4 - 219.66 - 81.144 - 159.78 - 93.169 - 184.35 - 50 等。通 过 NetMHCcons- 1 . 1 ( https://services .healthtech .dtu .dk/ service. php?NetMHCcons- 1. 1 )预测蛋白的 T 细胞抗原表 位( HLA-A*02:01 ),预测结果强结合肽 4 个,弱结合肽5 个。
3 讨论
革兰氏阴性菌的外膜( outer membrane, OM)外部 小叶存在脂多糖,因此是一种保护性屏障,能阻碍亲水 性和疏水性化合物的渗透。OMP 是促进革兰氏阴性菌 摄取细胞生长和功能所必需的营养和其他分子的通道之 一 [4], 是一种革兰氏阴性菌中的特殊蛋白质, 通常具有一 个跨膜结构域,是细菌存活和毒力发挥的关键,主要包括 OmpA 、OmpW 等 [2] 。而外膜蛋白 W (OmpW)属于小外膜孔蛋白家族,由 8 股反向平行 β 折叠片形成的桶 状疏水通道 [5] ,相关研究表明 OmpW 家族蛋白与提高细 菌应对各种环境压力的能力紧密相关, 如渗透作用 [6] 、氧 化作用 [7] 、温度变化及营养匮乏 [8] 等。同时, OmpW 家 族蛋白作为一种毒力因子编码的蛋白, 其在细菌体内合 成增多通常表示细菌毒力的加强, 可视为是一种重要的 保护性抗原 [9] ,由于其在革兰氏阴性菌中具有较高的保 守性, 在病菌感染和宿主免疫反应的激活方面起重要作 用, 应成为疫苗研发的重点关注对象。目前, 关于大肠杆 菌 OmpW 家族蛋白基因的研究较多,而对于布鲁氏杆菌 OmpW 基因鲜有报道。有研究表明, 布鲁氏菌外膜蛋白免疫原性较好, 可以刺激机体产生较强的免疫, 可作为疫苗 构建的候选物 [10] ,鉴于此,本研究对其进行生物信息学 分析, 以期为进一步研究布鲁氏杆菌的疫苗研发提供理论 依据。
布 鲁 氏 菌 外 膜 蛋 白 OmpW 家 族 蛋 白 分 子 式 为 C1136H1717N281O321. 脂肪族指数为 91.63.理论 pI 值为 5.67 , 原子总数为 3457.其氨基酸序列 Ala ( A)占 12.3%, Gly ( G)占 10.6%。Arg+Lys、Asp+Glu 总数分别为 16 和 18.其 不稳定系数为 23.01.可以认为布鲁氏杆菌外膜蛋白 OmpW 家族蛋白具有较好的稳定性。本研究发现, 在该蛋白 7~29 位氨基酸处存在有一个跨膜结构域。本研究预测该蛋白在 细胞中起着通道蛋白的作用。该蛋白有 96.481% 的概率存 在信号肽,信号肽指引蛋白质转移的方式有两种,转运后 由三种信号肽酶进行切除,该蛋白存在的信号肽为常规的 分泌通路和Ⅰ型信号肽酶。
蛋白质的磷酸化修饰与多种生物学过程密切相关,如 DNA 损伤修复、转录调节、信号转导、细胞凋亡的调节 等。布鲁氏菌外膜蛋白 OmpW 家族蛋白存在 17 个磷酸化 位点, 存在 1 个 N- 糖基化位点, 没有发现存在 O- 糖基化 位点。该预测为进一步解析 OmpW 家族蛋白磷酸化在调控 布鲁氏菌转录与复制过程中的作用奠定基础。
通过分析布鲁氏菌外膜蛋白 OmpW 家族的二级结构 可以发现其折叠比例最高,蛋白质折叠机制一直是一项研 究热点,蛋白质的错误折叠可能导致新生肽链的降解或蛋 白活性的消失, 因此, 我们猜测诱导布鲁氏杆菌 OmpW 家 族的错误折叠可以破坏其稳定性,降低杀死此菌的难度。
抗原表位的研究,拥有重要的意义和临床应用价值。 预测显示布鲁氏菌外膜蛋白 OmpW 家族共有 24 个 B 细胞 抗原表位, T 细胞抗原表位( HLA-A×02 ∶ 01 )有强结合 肽 4 个,弱结合肽 5 个。该蛋白抗原表位较多,有一定的 抗原性,可以作为潜在的布鲁氏菌感染抗原候选分子,为 研发布病新药靶点及新型疫苗制备提供新的方向。
通过上述研究,我们有效实现了布鲁氏外膜蛋白 OmpW 家族蛋白生物信息的预测分析。该蛋白质由 227 个氨基酸 残基组成,原子总数为 3 457 ,等电点为 5.67.整体表现 为非亲水性的稳定蛋白;该蛋白存在 1 个跨膜结构域;含 有 1 个 N- 糖基化和 17 个磷酸化修饰位点; 二级结构中有 链(Strand ) 13 个、螺旋(Holix ) 2 个、卷曲(Coil ) 16 个。以上研究表明布鲁氏菌外膜蛋白 OmpW 家族蛋白在细 菌感染和宿主免疫反应的激活方面有着重要作用,为深入 解析 OmpW 家族蛋白在布鲁氏菌在侵染过程中发挥的作 用及研发更加安全有效的布鲁氏菌疫苗和临床治疗药物提 供了一定理论基础。
参考文献
[1] ZHANG N, HUANG D, WU W, et al. Animal brucellosis control or eradication programs worldwide: A systematic review of experiences and lessons learned[J]. Prev Vet Med, 2018. 160: 105- 115.
[2] HORST R, STANCZAK P, W THRICH K. NMR polypeptide back bone conformation of the E. coliout-ermembrane protein W[J]. Struvture, 2014. 22(8): 1204- 1209.
[3] LI P, TIAN M, HU H, et al . Lable-free based cOmparative proteomic analysis of secretory proteins of rough Brucella mutants. J Proteomics, 2019. 195: 66-75.
[4] MAY B J, ZHANG Q, LI L L, et al. COmplete genomic sequence of Pasteurella multocida, Pm70[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001. 98(6): 3460-3465.
[5] HONG H, PATELD R, TAMM L K, et al. The outer membrane protein OmpW forms an eight-strandedβ-barrel with a hydrophobic channel[J]. Journal of biological chemistry, 2006. 281(11): 7568-7577.
[6] WU L, LIN X, WANG F. et al. OmpW and OmpV are required for NaCI regulation in Photobacterium damsela[J]. Journal of proteome research, 2006. 5 (9): 2250-2257.
[7] GIL F, LPINZA F, FUENTES J, et al . The OmpW(porin)gene mediates methyl viologen (paraquat) efflux in Salmonella enterica serovar Typhimurium[J]. Research in microbiology, 2007. 158 (6): 529-536.
[8] NANDI B, NANDYR K, SARKAR A, et al. Structural features,properties and regulation of the outer-membrane protein W (OmpW) of Vibrio cholerae[J]. Microbiology, 2005. 151(9): 2975-2986.
[9] DEVI L B, BORA D P, DAS S K. et al. Virulence gene profiling of porcine Pasteurella multocida isolates ofAssam[J]. Veterinary World, 2018. 11(3): 348-354.
[10] ASLAM M, SHEHROZ M, HIZBULLAH, et al. Potential druggable proteins and chimeric vaccine construct prioritization against Brucella melitensis from species core genome data[J]. Genomics, 2020. 112(2): 1734- 1745.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/56519.html