SCI论文(www.lunwensci.com):
摘要:报道1例复发难治性白血病患者经同胞全相合造血干细胞移植后超早期复发(28天),经去甲基化治疗、靶向治疗、强化疗以及改良供者淋巴细胞输注达完全缓解后,32天后再次复发死亡。通过回顾诊疗过程以及复习相关文献,思考怎么提高难治性白血病的治疗效果,改善预后,如何进行造血干细胞移植后复发的防治。
关键词:造血干细胞移植;移植后超早期复发;复发难治性白血病
本文引用格式:梁春艳,邢海洲,李英梅,等.异基因造血干细胞移植后超早期复发死亡病例1例并文献复习[J].世界最新医学信息文摘,2019,19(96):316-318,322.
0引言
复发难治性急性髓系白血病(Acute myelgenous leukemia,AML)通常对化疗药物耐药,化疗后不缓解或缓解后易复发,目前认为异基因造血干细胞移植(Allogeneic hematopoietic stem-cell transplantation,Allo-HSCT)是治疗复发难治性AML的唯一有效手段,但Allo-HSCT后复发率仍较高,远期生存率低。现将我科复发难治AML患者行同胞全相合造血干细胞移植,移植后28天复发,随后进行地西他滨联合索拉菲尼,治疗失败后,采用克拉曲滨、阿糖胞苷、伊达比星联合方案强化疗,序贯进行动员后供者淋巴细胞输注,缓解后再次复发,疾病进展死亡的病例报告如下并复习相关文献。
1病例资料
患者,男,43岁,因确诊急性髓系白血病-M5,高危,拟行造血干细胞移植于2018年9月18号入院。2018年04月因发热在当地医院查血常规:白细胞113.6×109/L,血红蛋白122g/L,血小板58×109/L,外周血原始细胞占56%。骨髓细胞形态学:有核细胞增生极度活跃,单核细胞异常增生,原幼细胞比例占88.8%,粒系受抑制。免疫学:原始向单核细胞延伸分布区域可见异常细胞群体,约占有核细胞2.2%,表达CD13、CD33、CD34、CD38、CD117,部分细胞表达HLA-DR、CD7,单核细胞比例明显增高,部分异常表达CD56,且CD13、CD14抗原表达部分缺失。白血病相关突变基因FLT3-ITD阳性,DNMT3A阳性,C-KIT/D816V基因突变。43种融合基因筛查:HOX11阳性,余均阴性。染色体示:正常核型。诊断为“急性髓系白血病M5高危”。在当地医院给予标准“柔红霉素针+阿糖胞苷针”方案,化疗后评估提示部分缓解(Partial remission,PR)。后给予5周期化疗,达PR。为行同胞全相合造血干细胞移植转入我院。
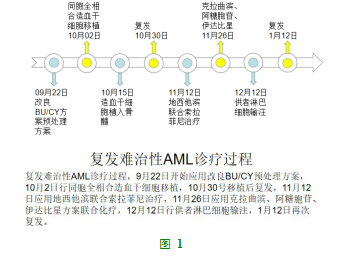
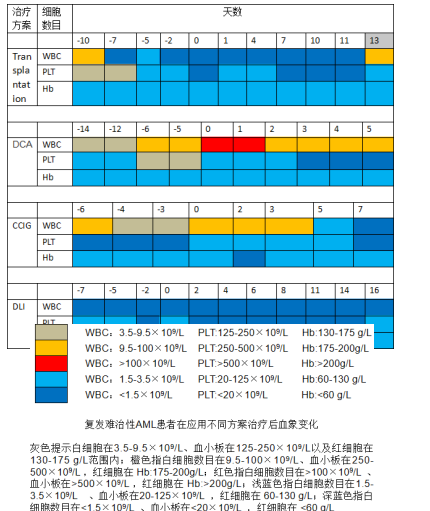
入院复查,骨髓形态学:单核细胞占11.2%,原+幼单7.6%。免疫学:未见原始或幼稚原始细胞。患者属于难治复发性AML,于2018年9月22日应用改良BU/CY方案预处理(图1),2018年10月2日回输同胞全相合外周血造血干细胞采集物253mL,单个核细胞(Monomuclear cell,MNC)3.9×108/kg,CD34+细胞9.79×106/kg。10月15日(+13天)血常规:中性粒细胞7.82×109/L,血小板37×109/L,提示造血干细胞植入(表1)。移植后21天,骨髓形态、流式MRD、突变基因阴性,供者嵌合率100%。但是,随后患者出现外周血细胞下降,移植后28天复查骨髓形态学提示:原始单核细胞16.8%;免疫学:MRD约5.524%;分子生物学:DNMT3A阳性(图2)。患者移植后复发,考虑移植后围手术期,身体耐受较差以及伴有FLT3-ITD突变,2018年11月12日采用地西他滨25mg×5天方案化疗,联合口服索拉菲尼。化疗后三系细胞明显减少(表1)。2018年11月20日(化疗后8天,移植后47天)复查骨髓形态学:单核细胞(原+早幼)约28.0%;免疫学:MRD约36.409%,突变基因筛查:DNMT3A、FLT3-ITD、NPM1阳性;供者嵌合比例33.71%(图3)。去甲基化以及靶向治疗后骨髓原始细胞较前明显增高,治疗无效。2018年11月26日(移植后53天),应用CCI方案进行挽救化疗(克拉曲宾7.5mg×5天,阿糖胞甘100mg×7天,伊达比星10mg×3天)。化疗后15天,2018年12月11日输注冻存供者干细胞采集物(MNC:1×108/kg),同时给予环孢素静脉滴注维持一周。2018年12月31日(二次回输后20天)复查,骨髓形态学提示单核细胞0%,免疫学MRD阴性,分子生物学提示突变基因阴性,供者嵌合比例100%(图4)。患者再次获得完全缓解。2019年1月12日,患者出现胸骨明显压痛,复查提示骨髓形态学、免疫学、分子生物学再次复发,供者嵌合比例0%。患者放弃治疗,疾病进展死亡。
2讨论及文献复习
此病例,根据FAB分类属于M5,同时伴有FLT3-ITD突变、DNMT3A R882突变、C-KIT/D816V基因突变和HOX11阳性,危险分层高危。Fms相关的酪氨酸激酶3(Fms-related tyrosine kinase 3,FLT3)、DNA甲基转移酶3A(DNA methylation transferase 3A,DNMT3A)是近年来较为关注的突变基因。FLT3-ITD突变在AML患者中占约20-30%,DNMT3A R882热点突变在AML患者中占约14%-34%,伴有FIT3-ITD、DNMT3A突变的AML通常具有外周血白细胞计数较高,原始细胞占比较高,多属于FAB分类中的M4、M5,多见于正常核型,具有治疗效果差、临床预后差、复发风险高、生存期短等临床特征,是AML不良预后的独立因素[1-8]。Ribeiro[2]等研究发现在AML中DNMT3A突变率为23.1%,具有较差的总生存率(Overall survival,OS)、无复发生存率(Relapse free survival,RFS),中位生存时间11.9月,DNMT3A突变是总体生存率的独立预后不良因素。Ahn[8]等报道同时伴有DNMT3A R882和FLT3-ITD双突变的患者经allo-HSCT后的OS率、EFS率明显降低,复发率明显升高,死亡率较高。国内Tang[9]等研究结果提示FLT3-ITD+DNMT3A R882-组经allo-HSCT后2年OS率及无病生存率(Leukemia free survival,LFS)率均低于FLT3-ITD-DNMT3AR882-组,2年累积复发率高于FLT3-ITD-DNMT3A R882-组;伴有FLT3-ITD和DNMT3AR882双突变的AML经alloHSCT后2年累积复发率偏高,OS率和LFS率偏低。研究发现,DNMT3A基因突变和FLT3-ITD突变有相互促进作用。Wakita[10]等报道发现DNMT3A突变可能导致基因不稳定,因此容易诱发FLT3-ITD的突变,同时造成对化疗药物的耐药性以及增高复发风险。MarkováJ[11]等发现FLT3-ITD突变容易诱发DNMT3A突变,而且同时伴有FLT3-ITD、DNMT3A双突变的AML具有更高的复发风险,具有更差的预后。
复发难治性AML通常对化疗药物耐药,治疗后不完全缓解或缓解后再次复发,目前认为Allo-HSCT是治疗复发难治性AML的唯一有效手段,Allo-HSCT可以改善预后[12]。虽然部分复发难治性AML经移植可以获益,达到无病生存,但仍有部分患者死于移植后早期复发,因此移植后预防复发是需要关注的重点。对于复发难治性AML移植后可以采取多种策略预防复发,如尽早减停免疫抑制剂、供者淋巴细胞输注(Donor lymphocyte infusion,DLI),预防性化疗以及靶向药物的应用,当移植后复发时可采用化疗、新型靶向药物应用、供者淋巴细胞输注、CAR-T、再次进行造血干细胞移植以及参加临床实验、姑息治疗等,根据患者病情以及意愿选择不同的方案[13-19]。Inamoto[13]等回顾性分析了行造血干细胞移植的2656例白血病患者,发现经移植早期没有出现移植物抗宿主病(Graft versus host disease,GVHD)的情况下,通过减停免疫抑制剂,可以降低早期复发率,但是对远期复发率没有改善。Allo-HSCT可以治愈白血病主要原因之一在于供者免疫细胞在受者体内可以发挥移植物抗白血病(Graft versus leukemia,GVL)效应,对于高危患者移植后可以采取再次输注供者细胞的方法预防或治疗复发,目前采用的DLI多是北京大学黄晓军教授研究组改良版DLI,应用粒细胞集落刺激因子(Granulocyte colony stimulating factor,G-CSF)动员后,输注供者外周血采集物,采集物中含有较多的CD34+细胞,DLI输注时同时联合应用免疫抑制剂,可以预防GVHD的发生,保留了DLI的GVL作用[15,20]。Wang[21]等对比了应用G-CSF刺激的DLI与未应用G-CSF刺激的DLI,发现应用G-CSF动员后的DLI预防移植后复发2年累计复发率36%,3年生存率31%,3年无病生存率22%,结果均优于对照组,并具有统计学意义。
该患者来我院进行同胞全相合造血干细胞移植,移植后植入顺利。移植后21天骨髓形态学、免疫学、分子生物学提示达CR,然而随后出现外周血细胞的急剧降低伴胸骨明显压痛,移植后28复查,骨髓形态学、免疫学、分子生物学提示复发。对于移植后超早期复发的治疗,目前仍缺乏有效的治疗手段。对于移植后复发的患者,二次移植仍是有效的治疗方法,但是二次移植复发率更高,预后更差[17],目前缺乏关于二次移植疗效的多中心多样本分析。嵌合抗原受体T细胞疗法(Chimeric antigen receptor T cells,CAR-T)作为一种细胞免疫治疗方法,具有良好的应用前景,目前的CAR-T多是针对于CD19抗原,在急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)中取得较好的疗效[18,22],由于目前已知的白血病细胞抗原在正常的造血细胞上均表达,AML缺乏特异性抗原,限制了CAR-T在AML中的应用[23]。复发难治性AML移植后复发可以采取多种策略,但是治疗效果较差,总体生存率较低,因此如何提高复发难治性白血病的治疗效果,改善预后,获得长期生存,是血液界亟需解决的问题。
该病例患者属于典型的复发难治性AML,经正规化疗、造血干细胞移植、移植后去甲基化、靶向治疗、强化疗以及DLI等治疗均无效,治疗效果差,预后差,生存期短。患者经造血干细胞移植后早期复发(28天),在国内外鲜少有关于经造血干细胞移植后在一月内复发的病例报道。
通过对该病例诊疗过程以及诊疗效果的回顾,希望可以为医务工作者在诊治复发难治性AML时提供一些诊疗思路。目前已知FLT3-ITD、DNMT3A R882突变是AML独立的预后不良因素,因此初诊AML伴FLT3-ITD、DNMT3A R882突变在诱导缓解化疗时是否可以应用较强的化疗方案,化疗两个周期达缓解状态时是否可以及时进行造血干细胞移植,在移植后是否可以早期减停免疫抑制剂,同时早期进行供者淋巴细胞输注等方案预防复发随着诊疗水平的提高以及化疗药物、造血干细胞移植、靶向治疗、细胞免疫治疗等治疗方法在临床的普及,白血病的治疗效果已经有了很大的提升,预后有了明显的改善,绝大多数患者可以获得长期生存,但是仍有部分患者对化疗药物耐药,属于复发难治性白血病,此类患者对化疗药物反应差,化疗后不缓解或者缓解后很快复发,部分患者经造血干细胞移植可以获益,仍有小部分患者在移植早期复发,预后极差,因此如何提高此类患者的治疗效果,改善预后,获得长期生存,是血液界一直关注的重点,是血液界的难题,也是亟需解决的难题,我相信随着学者们对白血病发病机制的深入认识以及医疗水平的提高,这些难题最终会得到解决。
参考文献
[1]Song Y,Magenau J,Li Y,et al.FLT3 mutational status is an independent risk factor for adverse outcomes after allogeneic transplantation in AML[J].Bone Marrow Transplant,2015,1(4):511-520.
[2]Ribeiro AF,Pratcorona M,Erpelinck-Verschueren C,et al.Mutant DNMT3A:a marker of poor prognosis in acute myeloid leukemia[J].Blood,2012,119(24):5824-31.
[3]Sengsayadeth SM,Jagasia M,Engelhardt BG,et al.Allo-SCT for high-risk AML-CR1 in the molecular era:impact of FLT3/ITD outweighs the conventional markers[J].Bone Marrow Transplant,2012,47(12):1535-7.
[4]Martelli MP,Sportoletti P,Tiacci E,et al.Mutational landscape of AML with normal cytogenetics:biological and clinical implications[J].Blood Rev,2013,27(1):13-22.
[5]Gaidzik VI,Schlenk RF,Paschka P,et al.Clinical impact of DNMT3A mutations in younger adult patients with acute myeloid leukemia:results of the AML Study Group(AMLSG)[J].Blood,2013,121(23):4769-77.
[6]Lagunas-Rangel FA,Chávez-Valencia V.FLT3-ITD and its current role in acute myeloid leukaemia[J].Med Oncol,2017,34(6):114.
[7]Tang S,Shen H,Mao X,et al.FLT3-ITD with DNMT3A R882 double mutation is a poor prognostic factor in Chinese patients with acute myeloid leukemia after chemotherapy or allogeneic hematopoietic stem cell transplantation[J].Int J Hematol,2017,106(4):552-561.
[8]Ahn JS,Kim HJ,Kim YK,et al.DNMT3A R882 Mutation with FLT3-ITD Positivity Is an Extremely Poor Prognostic Factor in Patients with Normal-Karyotype Acute Myeloid Leukemia after Allogeneic Hematopoietic Cell Transplantation[J].Biol Blood Marrow Transplant,2016,22(1):61-70.
[9]唐善浩,陆滢,张丕胜,等.FLT3-ITD与DNMT3A R882双突变对急性髓系白血病异基因造血干细胞移植预后的影响[J].中华血液学杂志,2018.39(7).
[10]Wakita S,Yamaguchi H,Omori I,et al.Mutations of the epigenetics-modifying gene(DNMT3a,TET2,IDH1/2)at diagnosis may induce FLT3-ITD at relapse in de novo acute myeloid leukemia[J].Leukemia,2013,27(5):1044-52.
[11]MarkováJ,MichkováP,BurčkováK,et al.Prognostic impact of DNMT3A
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/27072.html