SCI论文(www.lunwensci.com):
摘要:背景:阿扎胞苷(AZA),地西他滨(DEC)和来那度胺(LEN)正在被用于治疗骨髓增生异常综合症(MDS)。目的使用网络荟萃分析(NMA)比较药物的疗效和耐受性。方法搜索了PubMed,Medline,Embase和Cochrane数据库。我们纳入了比较AZA,LEN,DEC或最佳支持治疗(BSC)的随机对照试验(RCT)。主要结局指标是治疗前3个周期内的总体缓解率(ORR)和早期死亡。结果本研究共纳入10项RCT,共1647例患者。我们发现,AZA,DEC,LEN,AZA+LEN的平均ORR分别为45.52%,41.64%,42.74%和58.38%。BSC的平均ORR为6.85%。结果表明,与BSC相比,四种药物疗法的ORR明显更高。然而,四种疗法之间没有发现统计学差异。根据SUCRA,在MDS的治疗中,AZA+LEN疗法最有可能达到ORR。结论AZA,DEC,LEN和AZA+LEN疗法与BSC相比可以改善MDS患者的ORR,而不会增加死亡率。SUCRA结果表明AZA+LEN是MDS患者的最佳疗法,但在四种疗法之间未观察到统计学意义。
关键词:阿扎胞苷;地西他滨和来那度胺;骨髓增生异常综合症;网状meta分析
本文引用格式:石雨薇,娄世锋.关于阿扎胞苷、地西他滨和来那度胺在治疗骨髓增生异常综合症中疗效和安全性的Meta分析[J].世界最新医学信息文摘,2019,19(100):9-14.
Meta Analysis of the Efficacy and Safety of Azacytidine,Desetabine and Lenalidomide in the Treatment of Myelodysplastic Syndrome
SHI Yu-wei,LOU Shi-feng
(Department of Hematology,the Second Affiliated Hospital of Chongqing Medical University,Chongqing)
ABSTRACT:Background Azacitidine(AZA),Decitabine(DEC)and Lenalidomide(LEN)are used in management of myelodysplastic syndromes(MDS).objective to compare the efficacy and tolerability of the drug by network meta-analysis(NMA).Methods To search PubMed,Medline,Embase,and Cochrane library.We included Randomized
controlled trial(RCT)comparing AZA,LEN,DEC or best supportive care(BSC).Primary outcome is overall response rate(ORR)and early death within first 3 cycle of treatment.Results 10 RCTs with 1647 patients were included.We discovered that average ORR for AZA,DEC,LEN,AZA+LEN is 45.52%,41.64%,42.74%and 58.38%respectively.Average ORR for BSC is 6.85%.Result indicated four pharmaceuticals therapies have significantly higher ORR compared to BSC.Yet,no statistical difference was found between four therapies.According to SUCRA,AZA+LEN therapy was most likely(85.22%)to achieve ORR in management of MDS.It was discovered that application of drugs does not increase early death rate.Conclusions AZA,DEC,LEN and AZA+LEN therapies could improve the ORR of MDS patients comparing to BSC without increase the mortality risk.The SUCRA results suggests AZA+LEN to be the best therapy for MDS patient but not statistical significance has been observed between four therapies.
KEY WORDS:Azacitidine;Decitabine,Lenalidomide;Myelodysplastic syndrome;Network meta-analysis
1 背景
骨髓增生异常综合症(MDS)和慢性粒细胞性白血病(CMML)是一组骨髓疾病,其特征在于血细胞减少,出血和感染的风险增加。每年在美国诊断出近15,000至20,000新患者[1-3]。在大多数MDS患者中,已发现复发性体细胞突变和细胞遗传异常[4-5]。MDS患者的预后差别很大,30%的患者被归类为高风险组,转化为急性骨髓性白血病可能性很高[6]。有一些预后分数可以用来将患者分类为不同的风险组,并相应地用适当的治疗来治疗他们。IPSS评分是使用最广泛的MDS预后分层工具[2-3]。
美国食品和药物管理局目前批准了三种药物来治疗MDS,即阿扎胞苷,地西他滨和来那度胺。阿扎胞苷和地西他滨是胞嘧啶的嘧啶核苷类似物。它们被分类为去甲基化剂(HMA)。它们将通过与DNA转移酶相互作用来增加DNA去甲基化水平[7]。阿扎胞苷是一种广泛适用于MDS患者的治疗方法。其疗效以血液学结果和生活质量的改善为特征[8-9]。
来那度胺是一种沙利度胺类似物,比沙利度胺更有效和更耐受[10-11]。关于来那度胺的研究主要集中在5q-MDS患者中[12],因为他的主要作用是降解you由在5q32上CSNK1A1编码的CK1a[10]。然而,在没有5q-突变的MDS患者中也观察到了来那度胺治疗的临床改善[13-15]。这种疾病进展控制背后的机制可能有助于来那度胺的免疫调节功能。它会抑制在促炎细胞因子中并上调T细胞和NK细胞的活性,从而减少宿主与肿瘤之间的免疫相互作用,从而促进MDS的发展[11]。
这三种药物在低危和高危MDS患者中的疗效报道逐渐增多,然而,尚无meta分析全面地比较这些疗法在MDS患者中的疗效和安全性。一些系统的综述已经研究了该主题,但是由于方法的局限性,他们仅对两种具有不同证据水平的药物进行了比较[16-18]。网状meta分析(NMA)是进行更综合分析的强大工具。NMA可以比较某种疾病(MDS)的所有干预(A,B,C,D),并利用所有可比的研究(A-B,B-C,C-D等)。使用基于贝叶斯的算法,NMA可以使用共同的干预(例如:B,C)进行间接比较(A-C,B-D等)。NMA的另一个功能是,它可以根据累积排名曲线(SUCRA)下的面积将治疗从最佳到最差进行排名。在这项研究中,我们进行了系统的综述和网络meta分析,比较了阿扎胞苷,地西他滨和来那度胺在MDS患者中的疗效和耐受性。主要结果是总体缓解率(ORR)和早期死亡率。我们使用系统搜索来确定所有符合条件的研究,并且仅包括随机对照试验(RCT)。使用贝叶斯网络框架进行meta分析,并且根据SUCRA对治疗方法进行了排序。还利用了其他一些分析来测试结果的有效性。
2方法
这项系统评价和网络meta分析遵循了PRISMA NMA指南的最新扩展版本[19]。
2.1纳入标准。我们考虑了研究阿扎胞苷,来那度胺或地西他滨的MDS患者的RCT。纳入标准包括以下内容:
(1)患者:骨髓增生异常综合症患者。
(2)干预和控制:比较阿扎胞苷(AZA),来那度胺(LEN)或地西他滨(DEC)或相互比较或支持治疗(BSC)。
(3)结果测量:根据国际工作组(IWG)2006标准,主要结果是总体缓解率(ORR),包括完全缓解(CR),部分缓解(PR)和血液学改善(HI)[20]。次要结果是早期死亡,早期死亡定义为治疗的前三个周期内的死亡。
(4)研究设计:随机对照试验。
2.2系统检索。已使用以下关键词搜索PubMed,Medline,Embase和Cochrane库中的英语文章:
((lenalidomide)OR(revlimid)OR(CC5013)OR(hypomethylation OR(2 deoxy 5 azacytidine)OR(5 aza 2 deoxycytidine)OR(5 aza 2 desoxycytidine)OR(5 azadeoxycytidine)OR(5 azadesoxycytidine)OR(azacitidine)OR(azacitidine)OR(azacyd)OR(azacytidine)OR(azacytidine)OR(dacogen)OR(decitabine)OR(ladakamycin)OR(mylosar)OR(nsc 127716)OR(nsc102816)OR(nsc-102816)OR(nsc127716)OR(vidaza))AND((myelodysplastic syndrome)OR(dysmyelopoietic syndrome)OR(MDS))AND((randomized study)OR(randomized trial)OR(randomised study)OR(randomised trial))。从数据库创建之日到2019年7月,都对所有数据库进行了搜索。
2.3研究纳入。两位作者使用上述标准独立筛选了具有潜在资格的文章。出现分歧时,通过相互讨论以及参考通讯作者意见来解决。数据由两位审阅者独立提取,并由通讯作者进行审阅。
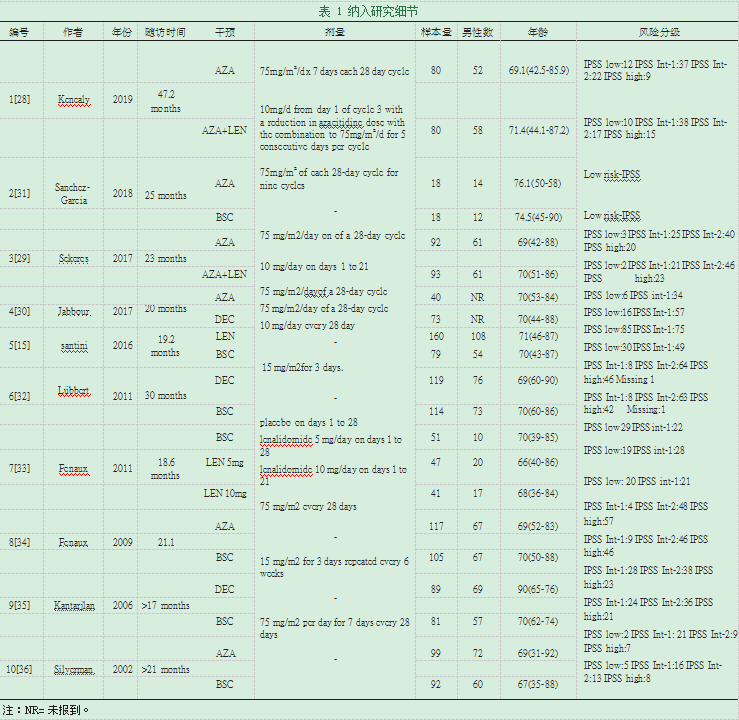
2.4数据提取。总提取数据包括:作者,出版年份,干预类型,随访时间,每组患者人数,每组男性患者,平均患者年龄,分类,干预,剂量,总缓解率,前3个周期内的死亡治疗和不良事件。
2.5质量分析。两位审阅者使用Cochrane偏倚风险工具评估了纳入研究的偏倚风险的方法学质量[21]。
2.6统计分析。首先,已经进行了使用STATA中的随机效应模型(StataCorp LP,美国德克萨斯州大学城,版本13.0)的配对meta分析。计算二分结果的相对风险(RR),可信区间为95%(CrI)[22]。GeMTC R package被用来检查整体异质性I2[23]。如果发现纳入文章中有显著的异质性,我们将放弃meta分析仅做系统回顾,然后,使用STATA,R和Winbugs进行随机效应网状meta分析。我们报道了效应大小(RR)和置信区间的结果。附录1中显示了WinBugs中随机效应模型的代码。使用了马尔可夫链蒙特卡罗方法来获得整体估计。同时使用四个任意选择的初始值运行四个马尔可夫链。评估迹线图和Brooks-Gelman-Rubin统计量以确保收敛[24]。使用潜在的规模缩减因子来评估近似收敛,该因子通过比较链内和链间方差来计算。如果其值为1或非常接近1,则达到了近似收敛。最后,我们估算了所有治疗的排名概率。根据累积排名曲线(SUCRA)下的面积报告治疗等级[25]。SUCRA值表示为曲线下面积的百分比。100%表示最佳治疗,0%表示最差治疗效果。
2.7不一致性分析。通过比较一致性和不一致模型的拟合度,以及分别计算网络中所有闭环中的直接和间接估计之间的差异,来评估直接证据和间接证据之间的全局和局部不一致[26]。节点分裂法用于评估模型的不一致性[27]。
2.8其他分析。我们绘制了网状meta分析的漏斗图以评估偏倚风险的影响。如果该图是不对称的,则提示在纳入的研究中存在偏移风险[25]。我们还进行了meta回归分析,以评估主要结果与研究规模,男性百分比,平均年龄和随访时间之间的关系。
3结论
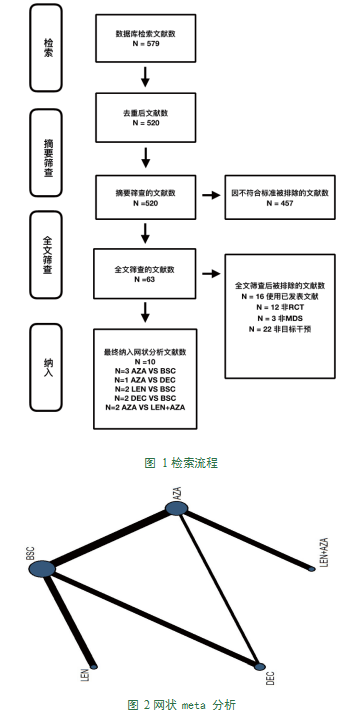
3.1研究纳入。通过搜索确定了579篇文章,对63篇潜在的合格研究进行了全文检索(图1)。最后,我们纳入了2002年至2019年之间发表的10份报告。我们的分析总共包括1647名患者,每项研究的详细信息可见表1。合格的比较网络如图2所示。
3.2质量分析结果。在质量评估中,70%的研究被判断为随机测序产生的风险较低,30%的研究的分配隐藏为低风险,90%的研究数据不完整的风险为低。在许多试验中,盲法信息提供有限的,分别仅将所有试验的20%和30%判定为参与盲法和结果数据盲法的低风险。结果详细显示在附录2中。
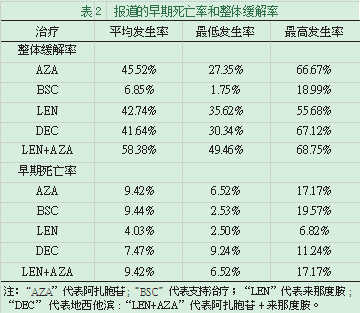
3.3整体缓解率和早期死亡率。表2总结了所报告的10项纳入试验的总体缓解率。在整个试验中,AZA,DEC,LEN和AZA+LEN治疗的平均ORR分别为45.52%,41.64%,42.74%和58.38%。支持治疗的平均ORR仅为6.85%,范围为1.75%至16.99%。对于早期死亡率的结果,药物治疗与支持治疗之间的区别并不明显。AZA,DEC,LEN和AZA+LEN治疗的10项试验的早期死亡率分别为9.42%,7.47%,4.03%和5.78%。支持治疗的平均早期死亡率为9.44%,范围从2.53%到19.57%。
3.4网状meta分析结果。根据异质性分析,纳入的研究之间几乎没有异质性。ORR和早期死亡的全局I2分别为6%和2%。低异质性表明适合对这两个结果进行网状meta分析。配对比较已在附录3中进行了总结,大多数比较均未显示出统计学上的显着差异。
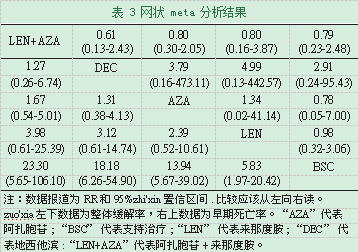
我们为网状meta分析选择了随机效应模型。表3的左下部分显示了ORR的网状meta分析的结果,表3的右上部分显示了早期死亡的结果。就ORR的风险而言,所有四种疗法AZA,LEN,DEC和AZA+LEN与支持治疗相比,ORR明显更高,RR分别为13.94、5.83、18.18和22.3。四种药物治疗在ORR上未观察到统计学差异。至于早期死亡,药物治疗与支持治疗之间未发现统计学差异。
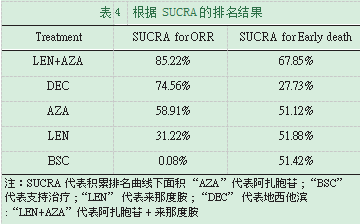
表4中列出了根据其SUCRA进行的治疗排名。考虑ORR时,MDS的最佳治疗方法是AZA+LEN(85.22%)。DEC排名第二(74.56%),而AZA和LEN分别排名第三和第四。支持治疗的排名最低(0.08%)。考虑早期死亡率时,最好的疗法是AZA+LEN(67.85%),更糟糕的是DEC(27.73%)。LEN,BSC和AZA排名第二至第四,彼此之间几乎没有差异。
3.5不一致性分析结果。在全局和局部两级的对不一致性评估表明,在主要结果中没有明显的不一致性。节点分裂测试的结果也没有发现任何比较对之间的不一致性(附录4)。
3.6其他分析。对网络meta分析的漏斗图是不对称的,这表明ORR分析中的存在小样本效应,而早期死亡率的图几乎是对称的,表明没有小样本效应(附录5)。此外,我们进行了meta回归分析,结果与研究规模,男性比例,平均年龄和随访时间之间未发现统计学上显着的相关性(附录6)。
4讨论
4.1主要发现。在这项系统综述和网络meta分析中,我们纳入了所有可检索的RCT,它们研究了阿扎胞苷,地西他滨,来那度胺及其组合在MDS治疗中的应用。数据表明,AZA,LEN,DEC和AZA+LEN治疗的总缓解率分别为45.52%,41.64%,42.74%和58.38%。支持治疗的平均ORR仅为6.85%。然后进行的网络meta分析以评估每种疗法的ORR。结果表明,与支持治疗相比,四种药物疗法(AZA,DEC,LEN,AZA+LEN)的ORR显着更高,RR分别为13.94、5.83、18.18和22.3。然而,就ORR而言,在这四种疗法(AZA,DEC,LEN,AZA+LEN)之间未发现统计学差异。
根据SUCRA,我们根据ORR对所有治疗方法进行了排名,发现AZA+LEN的嘴和最有可能(85.22%)在MDS患者中达到ORR。DEC排名第二(74.56%),而AZA和LEN分别排名第三和第四。支持治疗的排名最低(0.08%)。
我们还发现,药物治疗不会增加MDS患者的早期死亡率。所有干预措施的平均死亡率为4.03%至9.44%。早期死亡率的网络meta分析结果表明,任何干预措施之间均无显着差异。SUCRA不同管理的结果也非常相似。
4.2临床意义。在这篇综述中,我们试图纳入尽可能多的RCT,以全面分析MDS的治疗。我们仅将ORR和早期死亡作为主要结果。还有其他一些可以用于评估治疗效率和安全性的结果,包括无进展时间,总体生存率和不良事件。由于两个原因我们没有包括这些结果:首先,网状meta分析分析在二分量数据上效果最好,而生存分析在网状meta分析的方法论上还不成熟。其次,某些结果未在每次试验中都报告,对不完整的数据分析可能会产生偏差。因此,我们选择了最谨慎的方法,仅包括ORR和早期死亡(每项试验都报告了该结果),以代表疗效和安全性。附录中总结了RCT中报告的其余结果,供读者识别。主要发现的结果是可靠的,并得到一系列其他测试的支持,其中包括异质性,不一致,敏感性和meta回归测试。
该网络Meta分析分析将五种疗法进行了全面比较。结果表明,与支持治疗相比,药物治疗显示出更好的ORR,而没有增加早期死亡的风险。基于排名的SUCRA建议使用AZA+LEN作为最佳治疗方法。但是,应根据患者的预后风险分层和临床表现来谨慎解释这些发现。对于MDS患者,最佳的药物治疗方案仍然没有定论的。一方面,目前关于这些药物作用的证据是有争议的。我们的发现与一线研究的结果一致。在Kenealy的研究中,他报告AZA和AZA+LEN患者的总缓解率无统计学差异(57%vs 69%,P=0.14)[28]。Sekeres也观察到了相似的结果,他们报道AZA治疗和AZA+LEN治疗的患者的ORR分别为38%和49%,无统计学意义(P=0.14)[29]。目前NMA研究的结果也未发现两种HMA药物(AZA和DEC)之间的统计学差异。然而,在Jabbour进行的RCT中,他对低风险MDS患者应用了低剂量AZA和低剂量DEC,并观察到ORR从AZA治疗患者的49%增至DEC患者的70%,并且没有发生早期死亡情况(P=0.03)[30]。另一方面,除了这些有争议的证据外,许多有关MDS的研究还注意到反应率与生存率无关。因此,决定使用哪种药物不应完全依赖ORR。
这是首次对MDS患者中的阿扎胞苷,地西他滨,来那度胺进行全面比较的meta分析。这也是MDS治疗领域中人口最多的meta分析。为了使偏差最小化,所有纳入的研究均为RCT。2010年,Gurion纳入了四项试验进行meta分析,以比较支持治疗和阿扎胞苷或地西他滨的疗效和耐受性[17]。
他发现HMA类药物可以显着延长生存时间并提高总体生存率。由于局限于传统的meta分析方法,他无法间接比较阿扎胞苷和地西他滨。在另一个系统评价中,Almasri纳入了四项比较阿扎胞苷和地西他滨的试验。他的研究发现,与支持治疗相比,用阿扎胞苷或地西他滨治疗的患者表现出临床指标的改善,但两种药物之间的差异无统计学意义[18]。我们的发现不仅与先前的系统评价相符,而且还加入来那度胺及其与阿扎胞苷的组合。纳入研究之间的异质性较低,且其他结果具有良好的一致性,也证明了我们的发现是正确的.这项研究并非没有局限性。首先,与所有meta分析一样,系统评价的质量是基于结论研究的。在目前的NMA中,一些纳入试验被认为在盲法阶段具有高风险,而许多试验并未提供有关其盲法阶段的详细信息。漏斗图还检测到较小的发布偏差。但是,我们不认为这会影响我们的主要结果,因为所有测试(包括异质性,不一致和meta回归)都表明该发现是可靠且稳定的。其次,最好建立风险分层亚组分析以研究不同风险组中治疗的效果。但是,由于数据不足,我们没有进行相关挖掘。当有更多的证据报道时,未来需要对该领域进行meta分析。
5结论
与支持治疗相比,阿扎胞苷,地西他滨,来那度胺和阿扎胞苷+来那度胺疗法均可改善MDS患者的总体缓解率,而不会增加死亡率。SUCRA结果表明,阿扎胞苷+来那度胺是MDS患者的最佳治疗方法,但在四种治疗方法之间未观察到统计学意义。需要更多的试验来进一步研究这些疗法的相对有效性。同时,药物的选择应根据患者的药物可获得性,费用和临床表现而定。
参考文献
[1]Sekeres MA,Cutler C.How we treat higher-risk myelodyspla stic syndromes[J].Blood,2014,123(6):829-836.
[2]Greenberg PL,Tuechler H,Schanz J,et al.Revised international pr o gn os tic s c oring sys t em for myelo dysplas tic syndromes[J].Blood,2012,120(12):2454-2465.
[3]Greenberg P,Cox C,LeBeau MM,et aj.International scoring system for evaluating prognosis in myelodysplastic syndromes[J].Blood,1997,89(6):2079-2088.
[4] G an gat N,Patnaik MM,Tef feri A Myel o dysplas tic syndromes:contemporary review and how we treat[J].American journal of hematology,2016,91(1):76-89.
[5]Arber DA,Orazi A,Hasserjian R,et al.The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J].Blood,2016,127(20):2391-2405.
[6]Sekeres MA Epidemiology.Natural history,and practice patterns of patients with myelodysplastic syndromes in 2010[J].Journal of the National Comprehensive Cancer Network,2011,9(1):57-63.
[7]Christman JK.5-Azacytidine and 5-aza-2′-deoxycytidine as inhibitors of DNA methylation:mechanistic studies an d t h eir implic ation s for c an c er t h erapy[J].Oncogene,2002,21(35):5483.
[8]Silverman LR,Demakos EP,Peterson BL,et al.Randomized controlled trial of azacitidine in patients with t h e my el o dy s pl as ti c sy n d r o me:a s t u dy o f t h e cancer and leukemia group B[J].Journal of Clinical oncology,2002,20(10):2429-2440.
[9]Kornblith AB,Herndon JE,Silverman LR,et al.Impact of azacytidine on the quality of life of patients with myelodysplastic syndrome treated in a randomized phase III trial:a Cancer and Leukemia Group B study[J].Journal of Clinical Oncology,2002,20(10):2441-2452.
[10]List A,Kurtin S,Roe DJ,et al.Efficacy of lenalidomide in myelodysplastic syndromes[J].New England Journal of Medicine,2005,352(6):549-557.
[11]Kotla V,Goel S,Nischal S,et al.Mechanism of action of lenalidomide in hematological malignancies[J].Journal of hematology&oncology,2009,2(1):36.
[12]Fenaux P,Giagounidis A,Selleslag D,wt al.,Del Cañizo C A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with Low-/Intermediate-1-risk myelodysplastic syndromes with del5q[J].Blood,2011,118(14):3765-3776.
[13]Sibon D,Cannas G,Baracco F,Prebet T,Vey N,Banos A,Besson C,Corm S,Blanc M,Slama B,et al.Lenalidomide in l o w e r‐r is k myel o dy spl a s tic sy n dr o me s w it h karyotypes other than deletion 5q and refractory to erythropoiesis‐stimulating agents[J].British journal of haematology,2012,56(5):619-625
[14]Raza A,Reeves JA,Feldman EJ,et al.Phase 2 study of lenalidomide in transfusion-dependent,low-ri s k,a n d int e r me diat e-1–ri s k myel o dy splas tic syndromes with karyotypes other than deletion 5q[J].Blood,2008,111(1):86-93.
[15]Santini V,Almeida A,Giagounidis A,et al.Randomized Phase III Study of Lenalidomide Versus Placebo in RBC Transfusion-Dependent Patients With Lower-Risk Non-del(5q)Myelodysplastic Syndromes and Ineligible for or Refractory to Erythropoiesis-Stimulating Agent s[J].Journal of clinic al onc olo gy:official j o ur nal of t h e A me ric a n S o c i ety of Clinic al Oncology,2016,34(25):2988-2996.
[16]Komrokji R,Swern AS,Grinblatt D,et al.Azacitidine in Lower‐Ris k Myelodysplastic Syndromes:A Met a‐Analysis of Data from Prospective Studies[J].The oncologist,2018,23(2):159-170.
[17]Gurion R,Vidal L,Gafter-Gvili A,et al.5-azacitidine prolongs overall survival in patients with myelodysplastic syndrome-a systematic review and meta-analysis[J].haema tologica,2010,95(2):303-310.
[18]Almasri J,Alkhateeb HB,Firwana B,et al.A systematic review and network meta-analysis comparing azacitidine and decitabine for the treatment of myelodysplastic syndrome[J].Systematic reviews,2018,7(1):144.
[19]Hutton B,Salanti G,Caldwell DM,Chaimani A,Schmid CH,Cameron C,Ioannidis JP,Straus S,Thorlund K,Jansen JP,et al.The PRISMA extension statement for reporting of systematic reviews incorporating network meta-analyses of health care interventions:checklist and explanations[J].Annals of internal medicine,2015,162(11):777-784.
[20]Cheson BD,Greenberg PL,Bennett JM,et al.Clinical application and proposal for modification of the International Working Group(IWG)response criteria in myelodysplasia[J].Blood,2006,108(2):419-425.
[21]Deeks J,Higgins J,Altman D,et al.Cochrane handbook for systematic reviews of interventions version 5.1.0(updated March 2011)[J].The Cochrane Collaboration,2011.
[22]Salanti G,Higgins JP,Ades A.Ioannidis JP.Evaluation of networks of randomized trials[J].Statistical methods in medical research,2008,17(3):279-301.
[23]Neupane B,Richer D,Bonner AJ,et al.Network meta-analysis using R:a review of currently available automated packages[J].PLoS One,2014,9(12):e115065.
[24]Brooks SP,Gelman A.General methods for monitoring convergence of iterative simulations[J].Journal of computational and graphical statistics,1998,7(4):434-455.
[25]Salanti G,Ades A,Ioannidis JP.Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis:an overview and tutorial[J].Journal of clinical epidemiology,2011,64(2):163-171.
[26] Chaimani A,Higgins JP,Mavridis D,et al.Graphical tools for network meta-analysis in STATA[J].PloS one,2013,8(10):e76654.
[27]Dias S,Welton N,Caldwell D,et al.Checking consistency in mixed treatment comparison meta‐analysis[J].Statistics in medicine,2010,29(7‐8):932-944.
[28]Kenealy M,Hertzberg M,Benson W,et al.Azacitidine with or without lenalidomide in higher risk myelodysplastic syndrome&low blast acute myeloid leukemia[J].Haematol ogica,2019,104(4):700-709.
[29]Sekeres MA,Othus M,List AF,et al.Randomized Phase II Study of Azacitidine Alone or in Combination With Lenalidomide or With Vorinostat in Higher-Risk Myelodysplastic Syndromes and Chronic Myelomonocytic Leukemia:North American Intergroup Study SWOG S1117[J].Journal of clinical oncology:official journal of the American Society of Clinical Oncology,2017,35(24):2745-2753.
[30]Jabbour E,Short NJ,Montalban-Bravo G,et al.Randomized phase 2 study of low-dose decitabine vs low- dose azacitidine in lower-risk MDS and MDS/MPN[J].Blood,2017,130(13):1514-1522.
[31]Sanchez-Garcia J,Falantes J,Medina Perez A,etval.Prospective randomized trial of 5 days azacitidine versus supportive care in patients with lower-risk myelodysplastic syndromes without 5q deletion and transfusion-dependent anemia[J].Leukemia and Lymphoma,2018,59(5):1095-1104.
[32]Lübbert M,Suciu S,Baila L,wt al.Low-dose decitabine versus best supportive care in elderly patients with intermediate-or high-risk myelodysplastic syndrome(MDS)ineligible for intensive chemotherapy:Final results of the randomized phase III study of the european organisation for research and treatment of cancer leukemia group and the German MDS study group[J].Journal of Clinical Oncology,2011,29(15):1987-1996
[33]Fenaux P,Giagounidis A,Selleslag D,et al.randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with Low-/Intermediate-1-risk myelodysplastic syndromes with del 5q[J].Blood,2011,118(14):3765-3776.
[34]Fenaux P,Mufti GJ,Hellstrom-Lindberg E,et al.Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes:a randomised,open-label,phase III study[J].The Lancet Oncology,2009,10(3):223-232.
[35]Kantarjlan H,Issa JPJ,Rosenfeld CS,et al.Decitabine impr oves patient o ut c omes in myelo dysplas tic syndromes:Results of a phase III randomized study[J].Cancer,2006,106(8):1794-1803.
[36]Silverman LR,Demakos EP,Peterson BL,et al.Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome:a study of the cancer and leukemia group B[J].Journal of clinical oncology:official j o ur nal of t h e A me ric an S o c i ety of Clinic al Oncology,2002,20(10):2429-2440.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网! 文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/26033.html