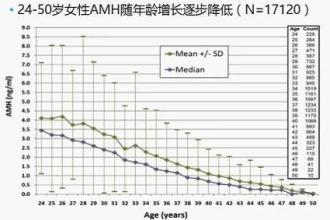
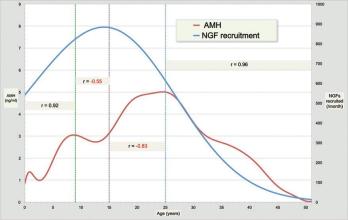
SCI论文(www.lunwensci.com):
摘要:抗苗勒管激素(anti-Müllerian hormone,AMH)在辅助生殖领域常用于评估卵巢功能、预测女性生育力、卵巢反应性和指导辅助生殖用药。愈来愈多的研究显示辅助生殖用药对女性血清 AMH 水平有影响,有相关临床误读风险,不能真实显现 AMH 的临床效用。该文献综述相关用药对女性血清 AMH 水平影响的研究报告,为临床医生正确判读和有效使用 AMH 检测报告作参考。
关键词:抗苗勒管激素;辅助生殖;药物
本文引用格式:蔡文慧 , 何人可 , 朱小明 . 辅助生殖用药对血清 AMH 水平的影响 [J]. 世界最新医学信息文摘 ,2018,18(76):56-57,60.
1抗苗勒管激素(anti-Müllerian hormone,AMH)
AMH 是一种二聚体糖蛋白,属于转化生长因子 -β 超家族成员,其血清学水平反映了卵巢中窦前卵泡和小窦卵泡的数目,与卵巢储备功能及卵巢反应性密切相关。AMH 相对于其他卵巢功能评估指标更具超前性和稳定性。临床上,常根据血清 AMH 水平评估卵巢功能、预测女性生育力、卵巢反应性和指导辅助生殖用药 [1]。
2辅助生殖用药对血清 AMH 水平的影响
2.1促性腺激素类药物
临床上常用的促性腺激素类药物主要有促卵泡刺激素类(如重组促卵泡激素)、促黄体生成激素类(如重组促黄体生成素)和相应的混合制剂类(如人绝经促性腺激素等)。这些均是辅助生殖基础药物,主要用于诱导排卵、卵巢刺激,模拟内源性促黄体生成素峰诱导卵泡发育成熟、触发排卵和维持黄体功能等。
重组促卵泡刺激素类药物对血清 AMH 水平影响与用药剂量及促排卵方案密切相关。非多囊卵巢综合症患者,使用较低剂量的重组促卵泡刺激素诱导排卵时,血清 AMH 水平无明显变化 [2-4];而使用相对较高剂量的重组促卵泡刺激素卵巢刺激时,血清 AMH 水平显著下降 [3,5]。多囊卵巢综合症患者,使用较低剂量的重组促卵泡刺激素诱导排卵时,血清 AMH 水平即显著下降 [6]。Liberty 和 Bottcher 报告卵巢功能正常女性使用重组促卵泡刺激素(37.5IU/d~112.5IU/ d)诱导排卵 [2,3],血清 AMH 水平无明显变化。Fábregues 报告 WHO Ⅱ型排卵功能障碍患者使用重组促卵泡刺激素诱导排卵(起始剂 75IU/d), 血清 AMH 水平也无明显变化 [4]。 Bottcher 报告使用重组促卵泡刺激素(150IU/d~300IU/d)卵巢刺激时,不管是否多囊卵巢综合症患者,用药第 4d~5d 血AMH 水平皆有显著下降(28.0%;P=0.01)[3]。Li 报告卵巢储备功能低下(血清基础促卵泡激素 =10mIU/mL~20 mIU/mL, 卵巢基础窦卵泡计数 <4 个)抑或正常女性使用重组促卵泡刺激素(150IU/d~225IU/d)卵巢刺激时,在用药第 5d 就发现AMH 水平显著下降,其中卵巢储备功能低下者下降更为明显(26.1%vs.17.1%)[5]。Catteau-Jonard 报告多囊卵巢综合症患者使用重组促卵泡刺激素(50IU/d~150IU/d)诱导排卵,血清 AMH 水平持续下降,优势卵泡日的血清 AMH 水平较二周前下降 25.0%[6]。
重组促黄体生成素使用对血清 AMH 水平的影响与患者卵巢功能有关 [7, 8]。Lan 报告卵巢储备不良女性,在促性腺激素释放激素类似物辅助的卵巢刺激长方案周期中补充重组促黄体生成素(自重组促卵泡刺激素使用第 6 d 开始,直至取卵日,75IU/d),其成熟卵泡颗粒细胞 AMHmRNA 表达明显增加 [7]。Durnerin 报告卵巢反应正常不孕女性,黄体中期使用促性腺激素释放激素激动剂(4.2mg)达到垂体降调节状态后,添加重组促黄体生成素(300IU/d,共 7d),血清 AMH 水平无明显变化,尽管此时添加重组促黄体生成素组血清促黄体生成素水平显著高于未添加组(2.8 IU/L vs. 1.0 IU/L)[8]。 Cook-Andersen 用两种剂量(25g 和 250g)重组人绒毛膜促性腺激素,模拟月经周期促黄体生成素峰诱导排卵, 发现不管是否多囊卵巢综合症,用药 48h 的血清 AMH 水平皆没有明显改变 [9]。Andersen 报告卵巢功能正常女性使用来曲唑和人绝经期促性腺激素组合的促性腺激素释放激素拮抗剂卵巢刺激方案,在月经第 2d 追加单次重组人绒毛膜促性腺激素(1250IU),发现取卵日卵泡液 AMH 水平显著高于未追加重组人绒毛膜促性腺激素组((2.6±0.3)ng/mL vs.(1.5±0.4)ng/mL)[10]。
Thuesen 报告卵巢功能正常女性使用促性腺激素释放激素激动剂辅助的重组促卵泡刺激素卵巢刺激长方案,在重组促卵泡刺激素(150IU/d)使用期间每天添加重组人绒毛膜促性腺激素(0IU、50IU、100IU 或 150IU),发现各组间血清 AMH 水平直到人绒毛膜促性腺激素注射日仍无明显差异,各组血清 AMH 水平均下降约 50.0% 自重组促卵泡刺激素使用第一日至人绒毛膜促性腺激素注射日 [11]。
人绝经期促性腺激素使用对血清 AMH 水平的影响与患者卵巢功能有关 [4, 12]。Chan 报告一例特发性低促性腺激素性性腺功能减退症患者使用人绝经期促性腺激素(75IU/d),在 第 60d 血样本发现 AMH 水平显著上 升(1.0pmol/L vs.1.3pmol/L)[12]。但 是,Fábregues 报告 WHO Ⅱ型排卵 障碍女性使用人绝经期促性腺激素(起始剂量 75 IU/d;共(12.5±1.3)d)诱导排卵没有发现血清 AMH 的明显变化 [4]。
2.2促性腺激素释放激素类似物
临床上常借助促性腺激素释放激素激动剂或拮抗剂,同步化卵泡发育,抑制内源性促黄体生成素峰,增进卵巢刺激药效。Cai 报告非多囊卵巢综合症不孕女性在促性腺激素释放激素激动剂辅助的超促排卵长方案中,促性腺激素释放激素激动剂使用后血清 AMH 的变化依基础 AMH 值而不同;较高的基础 AMH 值(均值 5.7ng/mL)在促性腺激素释放激素激动剂使用后血清 AMH 值有较明显的下降(≥ 1.0ng/ mL),较低的基础 AMH 值(均值 3.4ng/mL)在促性腺激素释放激素激动剂使用后血清 AMH 值变化不明显甚至有升高(≥ 1.0ng/mL)[13]。Su 报告健康志愿者黄体中期单用促性腺激素释放激素激动剂(3.75mg),其后 1 月内的血清 AMH 水平呈“先降后升”双向改变:用药第7d 降至最低(较用药前下降约 24.0%);随后逐渐上升,在第 14d 及第 30d 已明显高于用药前水平(分别上升13.0% 和 32.0%)[14]。Marschalek 报告子宫内膜异位症患者多周期促性腺激素释放激素激动剂(3.75 mg)治疗,每次用药一月后检测血清 AMH 水平,皆没有发现明显变化 [15]。Lee 报告促性腺激素释放激素激动剂或拮抗剂辅助卵巢刺激时,获卵日患者血清及成熟卵泡液 AMH 水平并无明显差异,提示促性腺激素释放激素拮抗剂对血清AMH 水平影响与促性腺激素释放激素激动剂相似 [16]。
2.3促性腺激素释放激素类似物与促性腺激素联合用药
促性腺激素释放激素激动剂或拮抗剂与促性腺激素联合用药,血清 AMH 水平下降显著 [3,5,17-19]。Bottcher 报告不孕女性的卵巢刺激,不管是促性腺激素释放激素激动剂或拮抗剂辅助,也不管是否伴有多囊卵巢综合症,人绒毛膜促性腺激素注射日血清 AMH 水平皆明显下降(58.9%~66.5%)[3]。 vonWolff 报告不孕女性实施促性腺激素释放激素拮抗剂辅助的卵巢刺激,获卵日血清 AMH 水平显著低于自然周期时(17.2pmol/Lvs.12.7pmol/L,P=0.03);卵泡液 AMH 水平也明显低于自然周 期(32.8pmol/Lvs.10.7pmol/L,P<0.0001)[17]。 Li 报告卵巢储备功能低下女性(基础促卵泡激素 =10mIU/ mL~20 mIU/mL,卵巢基础窦卵泡计数 <4 个)实施促性腺激素释放激素拮抗剂辅助的卵巢刺激,人绒毛膜促性腺激素注射日血清 AMH 水平下降较正常女性更为明显(60.2%vs.53.4%, P<0.001)[5]。Eldar-Geva 报告卵巢功能正常的不孕患者 和不伴高雄激素血症的多囊卵巢患者实施促性腺激素释放激素激动剂辅助的卵巢刺激,人绒毛膜促性腺激素注射日的血清 AMH 水平下降比伴有高雄激素血症的多囊卵巢患者下降更明 显(分别 是(71.0±18.0)%;(60.0±25.0)%;(34±24)%)[18]。Fanchin 报告促性腺激素释放激素激动剂辅助的卵巢刺激长方案,人绒毛膜促性腺激素注射日后 7d(其间有鲜胚移植和移植后黄体酮 600mg/d 经阴道给药)血清AMH 水平较人绒毛膜促性腺激素日下降 59.3%[19]。
2.4芳香化酶抑制剂
来曲唑(Letrozole)是临床中常用的芳香化酶抑制剂之一。Andersen 报告卵巢功能正常不孕女性使用来曲唑(2.5mg/d,月经第 2d~8d 使用)和人绝经期促性腺激素(150IU/d~225IU/d,月经第 8d~ 取卵前 48h 使用)组合的促性腺激素释放激素拮抗剂辅助卵巢刺激方案,取卵日卵泡液AMH 水平与相应没有来曲唑干预的用药方案相比,没有显著差异 [10]。
2.5雌激素受体拮抗剂
枸橼酸氯米芬(Clomifene Citrate,CC)是该类药的经典代表。Liberty 报告卵巢功能正常女性使用 CC(50mg/d,月经第 5 d~9 d 使用)诱导排卵,其血清 AMH 水平在用药结束后一周没有明显变化 [2]。Bottcher 报告卵巢功能正常女性同上使用 CC 后,续用小剂量重组促卵泡刺激素(37.5IU/d~100 IU/d)诱导排卵,人绒毛膜促性腺激素注射日血清 AMH 水平与基础值无明显差异 [3]。
2.6辅助生殖其他用药
避孕药:在辅助生殖临床,避孕药常用于卵巢预处理,以获取较好的诱导排卵或卵巢刺激效果。避孕药长期使用可引起血清 AMH 水平显著下降 [20, 21]。Johnson 报告:无论是既往放化疗女性,还是健康女性,使用避孕药(口服的单孕激素或雌孕激素联合制剂,或阴道置剂)满 1 年者,其血清 AMH 水平均显著低于未使用者,降幅可达55.0%[20]。Kallio 报告雌孕激素联合制剂,无论何种给药途径,用药 9 周后血清 AMH 水平皆显著下降 [21]。
硫酸脱氢表雄酮:该药在辅助生殖临床的应用旨在改善卵巢储备、提高卵巢反应性,增进助孕疗效。多项研究表明卵巢储备功能低下及卵巢低反应女性,补充硫酸脱氢表雄酮后,血清 AMH 水平可显著上升 [22, 23]。Yilmaz 报告卵巢储备功能低下患者补充硫酸脱氢表雄酮(75mg/d),6 周后不管年龄是否在 35 岁上或下,血清 AMH 水平均显著提高 [22]。
Vlahos 报告卵巢低反应患者使用硫酸脱氢表雄酮(75mg/d), 3 个月后也有类似的血清 AMH 水平提升 [23]。但是,卵巢功能衰竭患者补充硫酸脱氢表雄酮,血清 AMH 水平没有明显变化 [24, 25]。
二甲双胍:二甲双胍在辅助生殖临床中常用于伴胰岛素抵抗的多囊卵巢综合症不孕患者的助孕治疗,促进自然排卵或提高卵巢反应性。多项研究报告显示二甲双胍可显著降低多囊卵巢综合症患者血清 AMH 水平,下降幅度与患者体质指数、是否合并胰岛素抵抗及用药剂量和时间有关 [26-28]。Tomova 报告多囊卵巢综合症患者使用二甲双胍(2550mg/d;共 6 个月),有 76.0% 的患者血清 AMH 水平显著下降;血清 AMH 水平下降者的 BMI 值显著高于无明显下降者 [26]。 Romualdi 报告伴高胰岛素血症的多囊卵巢综合症患者在二甲双胍(1700mg/d,共 6 个月)治疗后,血清 AMH 水平显著下降(约 29.5%);而不伴高胰岛素血症患者类似的二甲双胍治疗,其血清 AMH 水平无明显变化 [27]。Fleming 报告伴胰岛素抵抗的多囊卵巢综合症患者使用二甲双胍(1500mg/d 或2250mg/d)治疗 4个月后,血清 AMH 水平没有明显变化;但是,当治疗延长至 8 个月时,血清 AMH 水平显著下降,下降幅度达22.8%[28]。
3小结
综上,多种辅助生殖药物使用可致血清 AMH 水平明显改变。如多囊卵巢综合症患者小剂量重组促卵泡刺激素诱导排卵、单用重组促卵泡刺激素类药物或与 GnRH 类似物联用卵巢刺激,激素类避孕药长期使用,皆可引发卵泡期血清AMH 水平显著下降。而卵巢储备功能低下及卵巢低反应女性,补充硫酸脱氢表雄酮后,血清 AMH 水平显著上升。辅助生殖药物使用对血清 AMH 水平的影响,与女性卵巢功能状态、内分泌环境(如下丘脑 - 垂体功能及糖代谢状态)、用药方案、时间、剂量等明显相关。临床医生解读血清 AMH 水平时需综合考虑相关用药及影响因素,正确判读和应用。
参考文献:
[1]Tal R, Seifer DB. Ovarian reserve testing: a user’s guide[J]. Am J Obstet Gynecol, 2017,217(2):129-140.
[2]Liberty G, Ben-Chetrit A, Margalioth EJ, et al. Does estrogen directly modulate anti-mullerian hormone secretion in women?[J]. Fertil Steril, 2010,94(6):2253-2256.
[3]Bottcher B, Tsybulyak I, Grubinger T, et al. Dynamics of anti-Mullerian hormone during controlled ovarian stimulation[J]. Gynecol Endocrinol, 2014,30(2):121-125.
[4]Fabregues F, Castelo-Branco C, Carmona F, et al. The effect of different hormone therapies on anti-mullerian hormone serum levels in anovulatory women of reproductive age[J]. Gynecol Endocrinol, 2011,27(4):216-224.
[5]Li Y, Nie M, Liu Y, et al. The dynamic changes of anti-Mullerian hormone and inhibin B during controlled ovarian hyperstimulation in decreased ovarian reserve women and the effect on clinical outcome[J]. Gynecol Endocrinol, 2015,31(6):450-453.
[6]Catteau-Jonard S, Pigny P, Reyss AC, et al. Changes in serum anti-mullerian hormone level during low-dose recombinant follicular-stimulating hormone therapy for anovulation in polycystic ovary syndrome[J]. J Clin Endocrinol Metab, 2007,92(11):4138-4143.
[7]Lan KC, Chang SY, Huang FJ, et al. Analysis of androgen receptor and anti- Mullerian hormone pathways in human granulosa cells under luteinizing hormone treatment[J]. Reprod Biol Endocrinol, 2013,11:11.
[8]Durnerin CI, Erb K, Fleming R, et al. Effects of recombinant LH treatment on folliculogenesis and responsiveness to FSH stimulation[J]. Hum Reprod, 2008,23(2):421-426.
Cook-Andersen H, Chuan SS, Maas K, et al. Lack of Serum anti-Mullerian hormone responses after recombinant human chorionic gonadotropinstimulation in women with polycystic ovary syndrome[J]. J Clin Endocrinol Metab, 2015,100(1):251-257.
[10]Andersen CY, Lossl K. Increased intrafollicular androgen levels affect human granulosa cell secretion of anti-Mullerian hormone and inhibin-B[J]. Fertil Steril, 2008,89(6):1760-1765.
[11]Thuesen LL, Smitz J, Loft A, et al. Endocrine effects of hCG supplementation to recombinant FSH throughout controlled ovarian stimulation for IVF: a dose-response study[J]. Clin Endocrinol (Oxf), 2013,79(5):708-715.
[12]Chan C, Liu K. Clinical pregnancy in a woman with idiopathic hypogonadotropic hypogonadism and low AMH: utility of ovarian reserve markers in IHH[J]. J Assist Reprod Genet, 2014,31(10):1317-1321.
[13]Cai J, Liu L, Zheng J, et al. Differential response of AMH to GnRH agonist among individuals: the effect on ovarian stimulation outcomes[J]. J Assist Reprod Genet, 2018,35(3):467-473.
[14]Su HI, Maas K, Sluss PM, et al. The impact of depot GnRH agonist on AMH levels in healthy reproductive-aged women[J]. J Clin Endocrinol Metab, 2013,98(12):E1961-E1966.
[15]Marschalek J, Ott J, Husslein H, et al. The impact of GnRH agonists in patients with endometriosis on prolactin and sex hormone levels: a pilot study[J]. Eur J Obstet Gynecol Reprod Biol, 2015,195:156-159.
[16]Lee JR, Kim SH, Kim SM, et al. Follicular fluid anti-Mullerian hormone and inhibin B concentrations: comparison between gonadotropin-releasing hormone (GnRH) agonist and GnRH antagonist cycles[J]. Fertil Steril, 2008,89(4):860-867.
[17]von Wolff M, Kollmann Z, Fluck CE, et al. Gonadotrophin stimulation for in vitro fertilization significantly alters the hormone milieu in follicular fluid: a comparative study between natural cycle IVF and conventional IVF[J]. Hum Reprod, 2014,29(5):1049-1057.
[18]Eldar-Geva T, Margalioth EJ, Gal M, et al. Serum anti-Mullerian hormone levels during controlled ovarian hyperstimulation in women with polycystic ovaries with and without hyperandrogenism[J]. Hum Reprod, 2005,20(7):1814-1819.
[19]Fanchin R, Mendez LD, Louafi N, et al. Dynamics of serum anti-Mullerian hormone levels during the luteal phase of controlled ovarian hyperstimulation[J]. Hum Reprod, 2005,20(3):747-751.
[20]Johnson LN, Sammel MD, Dillon KE, et al. Antimullerian hormone and antral follicle count are lower in female cancer survivors and healthy women taking hormonal contraception[J]. Fertil Steril, 2014,102(3):774-781.
[21]Kallio S, Puurunen J, Ruokonen A, et al. Antimullerian hormone levels decrease in women using combined contraception independently of administration route[J]. Fertil Steril, 2013,99(5):1305-1310.
[22]Yilmaz N, Uygur D, Inal H, et al. Dehydroepiandrosterone supplementation improves predictive markers for diminished ovarian reserve: serum AMH, inhibin B and antral follicle count[J]. Eur J Obstet Gynecol Reprod Biol, 2013,169(2):257-260.
[23]Vlahos N, Papalouka M, Triantafyllidou O, et al. Dehydroepiandrosterone administration before IVF in poor responders: a prospective cohort study[J]. Reprod Biomed Online, 2015,30(2):191-196.
[24]Wong Q, Yeung T, Yung S, et al. The ef fec t of 12 -month dehydroepiandrosterone supplementation on the menstrual pattern, ovarian reserve markers, and safety profile in women with premature ovarian insufficiency[J]. J Assist Reprod Genet, 2018,35(5):857-862.
[25]Yeung TW, Li RH, Lee VC, et al. A randomized double-blinded placebo- controlled trial on the effect of dehydroepiandrosterone for 16 weeks on ovarian response markers in women with primary ovarian insufficiency[J]. J Clin Endocrinol Metab, 2013,98(1):380-388.
[26]Tomova A, Deepinder F, Robeva R, et al. Anti-Mullerian hormone in women with polycystic ovary syndrome before and after therapy with metformin[J]. Horm Metab Res, 2011,43(10):723-727.
[27]Romualdi D, De Cicco S, Tagliaferri V, et al. The metabolic status modulates the effect of metformin on the antimullerian hormone-androgens-insulin interplay in obese women with polycystic ovary syndrome[J]. J Clin Endocrinol Metab, 2011,96(5):E821-E824.
Fleming R, Harborne L, MacLaughlin DT, et al. Metformin reduces serum mullerian-inhibiting substance levels in women with polycystic ovary syndrome after protracted treatment[J]. Fertil Steril, 2005,83(1):130-136.
《辅助生殖用药对血清 AMH 水平的影响论文》附论文PDF版下载:
http://www.lunwensci.com/uploadfile/2018/1215/20181215035614398.pdf
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/2209.html