SCI论文(www.lunwensci.com):
摘要:目的 研究端粒长度、端粒酶逆转录酶 (TERT) 和端粒保护蛋白 1(POT1) 在阿尔茨海默病大鼠外周血中的表达情况。分析阿司匹林对 AD 大鼠模型的端粒长度、TERT 和 POT1 基因表达的影响。方法 将 45 只 SD 大鼠分为对照组、模型组和阿司匹林组,每组 15 只。对模型组及阿司匹林组的大鼠注射 Aβ 以构建阿尔茨海默病大鼠模型。建模后对照组、模型组和阿司匹林组分别给予生理盐水及阿司匹林灌胃。于灌胃后 4 周,测定各组大鼠的外周血白细胞端粒相对长度、TERT 和 POT1 mRNA 的相对表达量及脑脊液中POT1 蛋白表达情况。结果 建模后 1 周,经morris 水迷宫检测模型组和阿司匹林组各有 10 只大鼠建模成功;对照组、阿司匹林组和模型组大鼠相对端粒长度依次缩短 (P<0.05);对照组、模型组和阿司匹林组的 POT1 mRNA 表达量依次增高 (P<0.05);模型组和阿司匹林组 TERT mRNA 表达量均低于对照组 (P<0.05),但两组间的比较无显著差异 (P>0.05)。结论 AD 大鼠可能由于端粒酶活性下降而导致端粒长度的缩短,阿司匹林或可通过上抬 POT1 的表达从而发挥保护端粒作用。
关键词:阿尔茨海默病;阿司匹林;端粒;端粒酶逆转录酶 ; 端粒保护蛋白 1;大鼠
本文引用格式:吴奇 , 韩东阳 , 李昕 . 阿司匹林对 AD 大鼠端粒长度、端粒酶逆转录酶及端粒保护蛋白 1 基因表达的影响 [J]. 世界最新医学信息文摘 ,2018,18(76):28-30,35.
Impact of Aspirin on Telomere length and Expressions of Telomerase Reverse Transcriptase and Pmtection of Telomere 1 in Rats with Alzheimer’s Disease
WU Qi, HAN Dong-yang, LI Xin*
(Department of Neurology, the Second Hospital Affiliated to Zhengzhou University, Zhengzhou Henan)
ABSTRACT: Objective To explore the impact of simvastatin on telomere length, expressions of telomerase reverse transcriptase(TERT) and pmtection of telomere 1 (POT1) in rats with Alzheimer’s disease. The effects of aspirin on the telomere length, TERT and POT1 gene expression in the AD rat model were analyzed. Methods Forty-five SD rats were divided into the control group, the model group and the aspirin group, with 15 rats in each group. The rats in the model group and the aspirin group were injected with Aβ to construct the rat model of Alzheimer’s disease. After modeling, the control group, the model group and the aspirin group were given saline and aspirin respectively. Four weeks after intragastric administration, the relative length of peripheral blood leukocyte telomeres, the relative expression of TERT and POT1 mRNA, and the expression of POT1 protein in cerebrospinal fluid were measured in each group of rats. Results At a week after modeling, AD occurred in ten rats in each group except the control group; The relative telomere length of control group, aspirin group and model group rats were shortened (P<0.05); The levels of POT1 mRNA in control group, model group and aspirin group increased in turn (P<0.05);TERT mRNA expression in model group and aspirin group was lower than that in control group (P<0.05), but there was no significant difference between the two groups. Conclusion The telomere length is shortened in AD rats probably because of the decreased telomerase activation.Aspirin can achieve protective effects on the telomere by promoting the expression of POT1.
KEY WORDS: Alzheimer’s disease; Aspirin; Telomeres; Telomerase Reverse Transcriptase; Pmtection of Telomere 1; Rat
引 言
阿尔茨海默病(AD)作为人类最常见的衰老性疾病,是发生在老年期及老年前期的一种原发性退行性脑病 [1],是一种持续性高级神经功能活动障碍,即在没有意识障碍的状态下,记忆,思维,分析判断,视空间辨认,情绪等方面的障碍 [2、3]。AD 是细胞衰老在人体整体上的宏观表现[4]。在衰老的器官中, 由于端粒缩短或(和)端粒相关结合蛋白功能紊乱增加了染色体的不稳定性,促使衰老干细胞增殖能力减退,痴呆发生的风险也随之增加 [5、6]。最近有研究发现,AD 的神经退化与大脑中的炎症密切相关[7-10]。淀粉样斑块、神经纤维缠结和突触丢失是 AD[11、12] 的病理特征,在 AD 内侧颞叶和皮质发现老年斑和细胞内神经纤维缠结,并伴有神经胶质细胞的局部炎症反应。反应性小胶质细胞和星形胶质细胞产生促炎性细胞因子[13],可能与 AD 中的神经元功能障碍有关。神经炎症诱发 (Aβ) 淀粉样蛋白沉积和募集炎症介质、白细胞到中枢神经系统去调节神经炎症和清除神经退行性变的细胞。而白细胞积累进一步加重血浆细胞因子和中枢神经系统特异性Aβ 抗体在 AD 大脑沉积,这形成了 AD 慢性炎症
反馈回路 [14、15]。端粒是位于染色体末端的 DNA- 蛋白结构, 由 TTAGGG 重复序列和大量的端粒结合蛋白组成 [16],具有维持基因组稳定性的作用。端粒缩短代表了导致衰老细胞DNA 损伤累积和激活 DNA 损伤检验点的内在机制 [17]。端粒功能失调激活 DNA 损伤检验点,导致细胞衰老,最终可引发痴呆 [18],而以 POT1 为核心的Shelterin 复合体,能和端粒酶一起通过抑制 DNA 损伤修复而保护端粒 [19]。有文献报道, 衰老小鼠大脑皮层POT1 表达明显降低,POT1 表达增加有神经元保护作用,进一步研究还发现 POT1 还可抑制化疗药物诱导的 DNA 损伤修复,不仅在端粒而且在染色体其它 DNA 损伤部位抑制 DNA 损伤反应的启动 [20]。因此,POT1 可能是发展了某些端粒功能的古老而通用的 DNA 损伤修复因子。
阿司匹林(乙酰水杨酸)是临床上应用广泛的解热镇痛药,目前主要用于发热、止痛、预防血栓的临床治疗。有研究表明,阿司匹林的抗炎、抗氧化应激等多种功效或可对抗高血压、血流动力学改变、糖尿病等危险因素以及减缓大鼠端粒长度缩短,从而起到一定 AD 的预防作用 [21]。Chang CW 等研究发现长期服用非甾体类抗炎药 (NSAIDs) 的个体中 AD 的风险降低,他们认为 NSAIDs 通过阻止 AD 中的神经炎症,可以治疗大脑和神经系统的退化 [22]。本实验旨在观察 NSAIDs 的代表药- 阿司匹林对AD 大鼠端粒长度、端粒酶逆转录酶 (TERT) 及端粒保护蛋白1(POT1) 的影响,从而为下一步探索端粒保护药物及 AD 的药物预防与治疗新策略提供一定的参考。
1材料与方法
1.1实验动物及试剂、仪器
雌性 SD 大鼠 45 只,体重 200~250g( 郑州大学实验动物中心提供 ) ,给予标准饮食,适应性喂养 1 周。DNA 提取试剂盒、RNA 提取试剂盒、cDNA 第一链合成试剂盒(普诺生生物科技有限公司),UltraSYBR Mixture(With ROX)( 康为世纪公司 ),Batson’s #17 Anatomical Corrosion Kit( 汉诺生物技术有限公司 ),POT1 鼠抗人抗体(Santa-Cruz 公司),超微量分光光度计、多功能 PCR 仪 ( 赛默飞世尔科技公司 ),ABI Stepone 实时荧光定量PCR 仪,手术显微镜,Morris 水迷宫( 玉研科学仪器有限公司 ),戊巴比妥钠 ( 可典公司 )。
1.2分组、造模及给药
将 45 只SD 大鼠随机分为对照组、模型组和阿司匹林组, 每组 15 只。在前 6 周内,模型组及阿司匹林组大鼠每日腹腔注射 D- 半乳糖 (60mg/kg),诱导衰老模型,对照组大鼠注射等量生理盐水,在第 6 周结束时,模型组和阿司匹林组的大鼠以 2%(0.02g/mL) 戊巴比妥钠按 80mg/kg 腹腔注射麻醉,用立体定位器精确定位侧脑室 ( 前囟门后 1.0 毫米,正中缝旁开 1.5 毫米,大脑皮层表面下 3.5 毫米 ),5lAβ1-42(2g/l) 慢慢注入,1 周后,经 morris 水迷宫检测模型组和阿司匹林组大鼠建模效果,剔除失败者。然后,阿司匹林组每日按300mg/kg 剂量给予阿司匹林灌胃 1 次,模型组和对照组每日给予 1mL 生理盐水灌胃 1 次,持续 4 周直至处死前 1 天。各组大鼠均予以标准饮食正常饲养。
1.3DNA、RNA 及脑脊液标本采集
阿司匹林灌胃 4 周后,各组大鼠均以 1% 的戊巴比妥钠按 40mg/kg 进行腹腔麻醉,经眶下静脉丛取血 1mL,留取脑脊液 3mL 保存待用。严格按照试剂盒说明书提取外周血白细胞基因组的 DNA 和总 RNA,并立即将 RNA 反转录成 cDNA。
1.4端粒长度、TERT 及 POT1 mRNA 表达水平测定mRNA 表达水平的测定定量 PCR 反应体系为 25l,根据分光光度计定量测定结果,加入 50ng DNA 或 25ng cDNA。采用两步法进行扩增:95℃ 10min 预变性,95℃ 15s、60℃ 1min 共 40 个循环,95 ℃ 15s、60 ℃ 1min、95 ℃ 15s、60 ℃15s,融解曲线分析,应用 2-ΔΔCt 法得出相对端粒长度、TERT和 POT1 mRNA 的相对表达量。引物序列和浓度如表 1。
1.5POT1 蛋白表达水平测定
蛋白质印迹法检测 POT1 蛋白表达:留取脑脊液,提取总蛋白,BCA 法测定蛋白浓度。行 SDS-PAGE,转膜,封闭,加入一抗 ( 鼠抗人 POT1 抗体 1:200 稀释,β-Actin 抗体 1:2000稀释 )4℃过夜。加入 HRP 标记的二抗,室温孵育 1h,ECL 显影,定影。以 Image J 软件分析目的蛋白条带灰度值与内参β-Actin 条带灰度值的比值,作为目的蛋白相对表达量。
1.6统计学分析
应用 SPSS 19.0 进行统计学分析。计量资料以 ( ±s) 表示,比较采用单因素方差进行分析,两两比较采用 t 检验,以P<0.05 为差异有统计学意义。
2结果
2.1AD 建模情况
建模后 1 周,经 morris 水迷宫检测模型组和阿司匹林组各有 10 只大鼠建模成功,建模失败则进行相应剔除。对照组大鼠未形成 AD。
2.23 组端粒长度、TERT 及 POT1 mRNA 表达水平比较阿司匹林灌胃 4 周后,阿司匹林组与模型组大鼠端粒的相对长度短于对照组 (*P=0.0143;***P<0.0001),并且模型组要短于阿司匹林组 (***P=0.0015); 阿司匹林组和模型组大鼠 POT1 mRNA 相对表达量都要高于对照组 (***P=0.0003;***P=0.0002),并且阿司匹林组要高于模型组(*P=0.0316);模型组和阿司匹林组的 TERT mRNA 表达量均低于对照组(***P<0.0001;***P<0.0001),但是模型组与阿司匹林组间的比较,差异无统计学意义 (P=0.46)。如图 1。
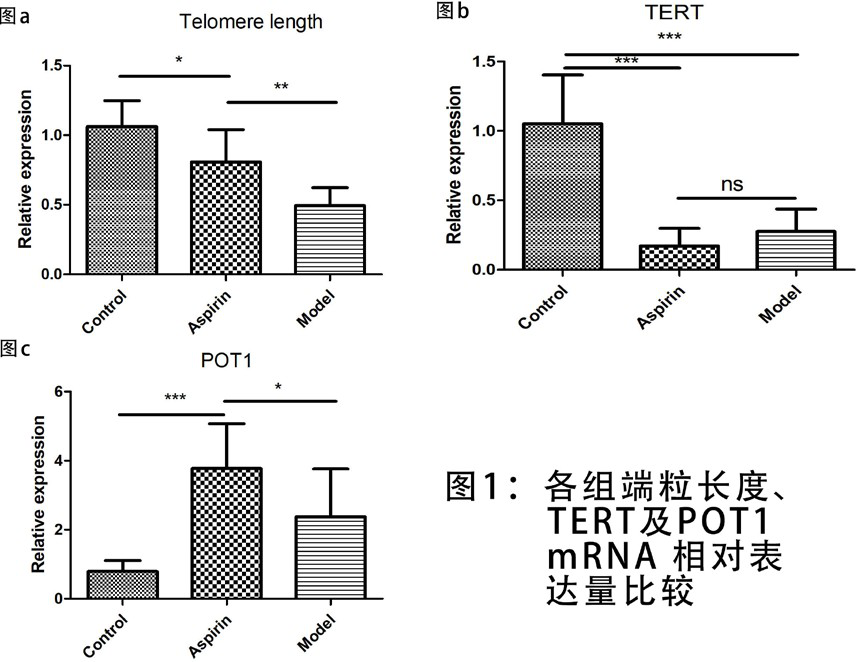
图 1 各组端粒长度、TERT 及 POT1 mRNA 相对表达量比较
2.33 组 POT1 蛋白表达
蛋白质印迹法检测显示各组有较明显的 POT1 蛋白条带,阿司匹林组和模型组 POT1 蛋白表达量均较对照组显著升高,以阿司匹林组升高更为明显。如图 2。
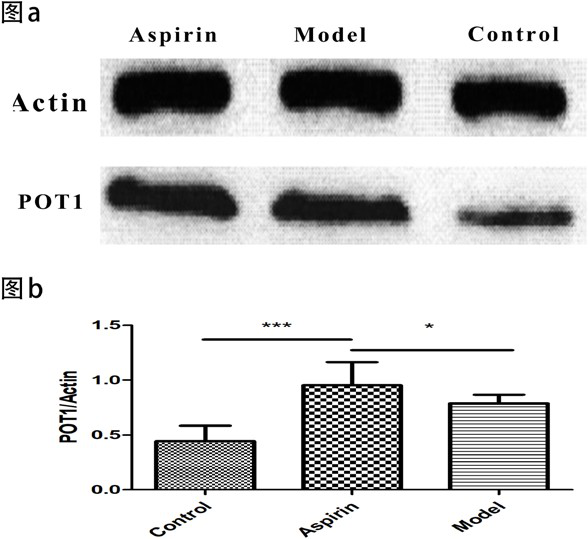
图 2 各组 POT1 蛋白表达情况
虽然阿司匹林在临床上通常被作为抗血小板药物应用,但其越来越多的作用正在逐渐被发现,包括抑制晶状体蛋白变性 [23]、促进胰岛素释放 [24]、抑制前列腺素合成 [25] 等,但其是否能够对 AD 大鼠外周血白细胞端粒长度造成影响及其可能的机制尚未见报告。
本研究结果显示,模型组和阿司匹林组大鼠的外周血白细胞端粒长度短于对照组 (P<0.05),提示端粒长度可能参与 AD 的病理生理过程,这与国内外文献报道一致 [26、27], 当端粒长度损耗到一定程度时,可诱导抑癌基因 p53 的表达,从而启动凋亡信号通路 [28],并抑制线粒体氧化相关蛋白,启动氧化应激程序,进而通过端粒 - 线粒体通路造成细胞衰老 [29],最终导致神经 / 突触功能障碍和神经退化,促进 AD 的形成与发展。而且,阿司匹林组大鼠端粒长度长于模型组 (P<0.05),表明阿司匹林可有效减缓端粒长度的损耗。有报道称外周血白细胞的端粒长度能反映血管整体衰老水平 [30],阿司匹林或可用于延缓血管整体老化,从而成为一种新型的端粒保护药物。
端粒酶是一种特殊的逆转录酶,能够催化延长端粒末端的核糖核酸蛋白酶,其以自身 RNA 为模板,合成端粒 DNA 并添加到染色体末端,从而弥补端粒的损耗。关于端粒酶的研究,现大多集中于肿瘤疾病,发现端粒酶的活性表达与肿瘤密切相关 [31]。本研究结果显示,阿司匹林喂养后 4 个月,对照组大鼠的 TERT 表达高于模型组和阿司匹林组(P<0.05),这表明模型组和阿司匹林组大鼠端粒酶的表达受到一定的抑制。端粒酶活性降低可能是造成大鼠端粒明显缩短的主要原因。AD 大鼠机体氧化应激水平明显升高,在过多的炎性介质、氧自由基的作用下,端粒 DNA 被错误氧化, 使端粒酶的活性明显降低。在应用阿司匹林后,虽然大鼠的端粒酶活性略有提高,但与模型组相比,差异无明显统计学意义 (P>0.05),这表明端粒酶可能并不是阿司匹林减缓端粒长度损耗的靶点。
POT1 是一种序列高度保守的端粒保护蛋白,主要通过参与 T 环形成、抑制经典的非同源末端重组 DNA 修复机制和 ATM 依赖的 DNA 损伤信号转导途径来调节端粒的完整性 [32]。在本研究中,模型组和阿司匹林组大鼠 POT1 的表达水平都高于对照组 (P<0.05),这很可能是端粒功能失衡后导致 POT1 发生代偿性的增高,而且经阿司匹林灌胃后的大鼠POT1 的表达水平高于模型组 (P<0.05),表明阿司匹林干预后大鼠的 POT1 表达进一步增高。这提示阿司匹林可能是通过促进 POT1 的表达,从而促进 T 环形成,维持端粒结构的完整性,并最终起到了减缓端粒长度缩短的作用。
综上所述,本实验通过大鼠阿尔茨海默病模型的建立, 并实施阿司匹林干预,观察了大鼠的外周血端粒长度、端粒酶的活性及端粒保护蛋白 POT1 表达的变化情况,从端粒保护机制的角度,为探索 AD 药物治疗提供新的方向。
参考文献:
[1]Mesquita S.D.,Ferreira A.C.,Sousa J.C.,Correia-Neves M.,Sousa,F.Marques Insights on the pathophysiology of Alzheimer’s disease:the crosstalk between amyloid pathology, neuroinflammation and the peripheral immune system[J]. Neurosci Biobehav Rev,2016,68:547-562.
[2]Green C.,Zhang S.Predicting the progression of Alzheimer ’s disease dementia:A multidomain health policy model[J].Alzheimers Dement,2016,12:776-785.
[3]Camfield D.,Scholey A.,Pipingas A.,Silberstein R.,Kras M.,Nolidin K.,et al.Steady state visually evoked potential (SSVEP) topography changes associated with cocoa flavanol consumption[J].Physiol Behav,2012,105: 948-957.
[4]Reddy PH, Williams J,Smith F, Bhatti JS, et al. MicroRNAs, Aging, Cellular Senescence, and Alzheimer’s Disease[J].Prog Mol Biol Transl Sci,2017,146:127-171.
[5]Cai Z,Yan LJ,Ratka A.Telomere shortening and Alzheimer’s disease[J].Neuromolecular Med,2013 ,15(1):25-48.
[6]Spilsbury A, Miwa S, Attems J, Saretzki G.The role of telomerase protein TERT in Alzheimer’s disease and in tau-related pathology in vitro[J].J Neurosci, 2015 ,35(4):1659-74.
[7]Whittington RA, Planel E, Terrando N.Impaired Resolution of Inflammation in Alzheimer’s Disease:A Review[J].Front Immunol,2017,8:1464.
[8]Holmes C. Review: systemic inflammation and Alzheimer’s Disease[J]. Neuropathol Appl Neurobiol,2013,39:51-68.
[9]Franceschi C, Campisi J.Chronic inflammation (inflammaging) and its potential contribution to age-associated diseases[J].J Gerontol A Biol Sci Med Sci,2014,69(1):S4-9.
[10]Gabuzda D,Yankner B.A.Physiology: inflammation links ageing to the brain[J].Nature,2013,497:197-198.
[11]Selkoe DJ,Hardy J.The amyloid hypothesis of Alzheimer’s disease at 25 years[J].EMBO Mol Med,2016,8(6):1-14.
[12]Campion D, Pottier C, Nicolas G, Le Guennec K, Rovelet-Lecrux A.Alzheimer disease: modeling an Abeta-centered biological network.Mol[J]. Psychiatry, 2016,21: 861-871.
[13]Heneka M.T, Carson M.J, Khoury J.E, Landreth G.E, Brosseron F, Feinstein D.L,et al.Neuroinflammation in Alzheimer’s disease[J].Lancet Neurol,2015,14:388-405.
[14]Shamim D,Laskowski M.Inhibition of Inflammation Mediated Through the Tumor Necrosis Factor Biochemical Pathway Can Lead to Favorable Outcomes in Alzheimer Disease[J].Journal of Central Nervous System Disease,2017, 9 :1179573517722512.
[15]Osborn L.M, Kamphuis W, Wadman W.J, Hol E.M.Astrogliosis: an integral player in the pathogenesis of Alzheimer’s disease.Prog[J].Neurobiol, 2016,144:121-141.
[16]Lu W, Zhang Y, Liu D, Songyang Z, Wan M. Telomeres-structure, function, and regulation[J].Exp Cell Res ,2013,319:133-41.
[17]Muraki K, Murnane JP.The DNA damage response at dysfunctional telomeres, and at interstitial and subtelomeric DNA double-strand breaks[J]. Genes Genet Syst,2017,17-00014.
[18]Blackburn E.H, Greider C.W., Szostak J.W. Telomeres and telomerase: the path from maize, Tetrahymena and yeast to human cancer and aging[J].Nat. Med,2006,12: 1133-1138.
[19]Kim JK, Liu J, Hu X, Yu C, Roskamp K, Sankaran B, Huang L, Komives EA, Qiao F.Structural Basis for Shelterin Bridge Assembly[J].Mol Cell,2017,68(4):698-714.e5.
[20]Wu L., Multani AS, He H,et al. Pot1 deficiency initiates DNA damage checkpoint activation and aberrant homologous recombination at telomeres[J].Cell,2006,126(1):49-62.
[21]Parmar HS, Houdek Z, Pesta M, Vaclava C, Dvorak P, Hatina J.Protective Effect of Aspirin Against Oligomeric Aβ42 Induced Mitochondrial Alterations and Neurotoxicity in Differentiated EC P19 Neuronal Cells[J]. Curr Alzheimer Res,2017,14(8):810-819.
[22]Chang CW, Horng JT, Hsu CC, Chen JM.Mean Daily Dosage of Aspirin and the Risk of Incident Alzheimer’s Dementia in Patients with Type 2 Diabetes Mellitus: A Nationwide Retrospective Cohort Study in Taiwan[J].J Diabetes Res,2016,2016:9027484.
[23]Harding JJ.Aspirin and cataract[J].Ophthalmology,1999,106(12):2233-4.
[24]Amiri L, John A, Shafarin J, et al. Enhanced Glucose Tolerance and Pancreatic Beta Cell Function by Low Dose Aspirin in Hyperglycemic Insulin-Resistant Type 2 Diabetic Goto-Kakizaki (GK) Rats[J].Cell Physiol Biochem,2015,36(5):1939-50.
[25]Dovizio M, Bruno A, Tacconelli S, et al.Mode of action of aspirin as a chemopreventive agent[J].Recent Results Cancer Res,2013,191:39-65.
[26]Boccardi V., Pelini L., Ercolani S., Ruggiero C., Mecocci P.From cellular senescence to Alzheimer’s disease, the role of telomere shortening[J]. Ageing Res Rev,2015,22:1-8.
Scarabino D, Broggio E, Gambina G, Corbo RM. Leukocyte telomere lengthin mild cognitive impairment and Alzheimer’s disease patients[J].Exp Gerontol,2017,98:143-147.
[28]Haghighi MM, Aghagolzadeh P, Zadeh SM, et al. Telomere shortening: a biological marker of sporadic colorectal cancer with normal expression of p53 and mismatch repair proteins[J].Genet Test Mol Biomarkers, 2014,18(4):236-44.
[29]Zole E, Zadinane K, Pliss L, et al.Linkage between mitochondrial genome alterations, telomere length and aging population[J].Mitochondrial DNA A DNA Mapp Seq Anal,2017,24:1-8.
[30]Zhu H,Wu H,Liu X,et al. Role of MicroRNA miR-27a and miR-451 in the regulation of MDR1 / P-glycoprotein expression in human cancer cells[J]. Biochem Pharmacol,2008,76(5):582-588.
[31]Burchett KM, Etekpo A, Batra SK, et al. Inhibitors of telomerase and poly(ADP-ribose) polymerases synergize to limit the lifespan of pancreatic cancer cells[J].Oncotarget,2017,8(48):83754-83767.
[32]Hu C,Rai R, Huang C, Broton C, et al.Structural and functional analyses of the mammalian TIN2-TPP1-TRF2 telomeric complex[J].Cell Res,2017,27(12):1485-1502.
《阿司匹林对AD大鼠端粒长度、端粒酶逆转录酶及端粒保护蛋白1基因表达的影响论文》附论文PDF版下载:
http://www.lunwensci.com/uploadfile/2018/1215/20181215024056811.pdf
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/2198.html



