SCI论文(www.lunwensci.com):
摘要:肺纤维化指的是成纤维细胞增殖、大量细胞外基质聚集,同时伴有炎症损伤、组织结构破坏的一种肺部疾病终末期改变,也是正常肺泡组织损伤后修复失调的结果。microRNA作为一类调节基因表达的关键小RNA分子,在肺纤维化的发生发展中发挥着重要作用。
本文就肺纤维化发生发展过程中关键的几种microRNA的作用作一综述,miRNAs与病变组织的纤维化关系密切,其特异性表达能够促进或抑制肺纤维化的发病过程。随着研究通过调控miRNAs会是肺纤维化治疗的有效方法,为肺纤维化的临床诊断和治疗提供新的依据和方向。
关键词:micro-RNA;肺纤维化;研究进展
本文引用格式:陈思,高俊玲.Micro-RNA在肺纤维化中的研究进展[J].世界最新医学信息文摘,2019,19(52):66-67,71.
Research Progress of Micro-RNA in Pulmonary FibrosisCHEN Si,GAO Jun-ling(North China University of Technology,Tangshan Hebei)
ABSTRACT:Pulmonary fibrosis refers to the end-stage changes of pulmonary diseases with fibroblasts proliferation,large amounts of extracellular matrix aggregation,inflammation damage and tissue destruction.It is also the result of repair imbalance after normal alveolar tissue injury.As a key small RNA molecule regulating gene expression,microRNA plays an important role in the occurrence and development of pulmonary fibrosis.
This article reviews the role of several key microRNAs in the pathogenesis and development of pulmonary fibrosis.MicroRNAs are closely related to fibrosis in pathological tissues,and their specific expression can promote or inhibit the pathogenesis of pulmonary fibrosis.
With the development of research,the regulation of microRNAs will be an effective method for the treatment of pulmonary fibrosis,providing a new basis and direction for the clinical diagnosis and treatment of pulmonary fibrosis.KEY WORDS:Micro-RNA;Pulmonary fibrosis;Research progress
0引言
肺纤维化指的是成纤维细胞增殖、大量细胞外基质聚集,同时伴有炎症损伤、组织结构破坏的一种肺部疾病终末期改变,也是正常肺泡组织损伤后修复失调的结果。
肺纤维化发生的病理过程大致为内在或外界的理化、有害因素造成肺组织损伤,纤维母细胞大量合成、分泌胶原来修复损伤的肺组织,导致肺间质中胶原和细胞外基质(extracellular matrix,ECM)过度沉积,进而形成肺纤维化。由于病因学较为复杂、发病机制尚不明确,使得目前临床中对肺纤维化还没有特效的治疗方法。
近年来,随着microRNA(miRNA)研究热度的不断上升[1]。作为一类调节基因表达的关键小RNA分子,在肺纤维化的发生发展中也发挥着重要作用。
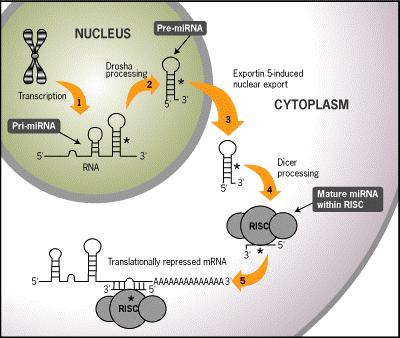
microRNA是由内源基因编码长度为22~35个核苷酸的非编码单链RNA分子,能够识别靶信使RNA(messenger RNAs,mRNAs)的3’非翻译区(untranslated regions,3’-UTR)的互补位点,抑制mRNA翻译或促进其降解,进而调控编码蛋白的表达。本文就肺纤维化发生发展过程中关键的几种microRNA的作用作一综述,现报道如下。
1肺纤维化中上调的microRNAs
1.1miR-21
miR-21是人类组织和细胞中较早被发现,且广泛存在的一种miRNA,其失调与肺纤维化的发生、发展密切相关。为实验小鼠导入miR-21反义探针或将miR-21基因敲除,能够减轻肺纤维化,导入miR-21前体物质则会使肺纤维化加重,也就是说miR-21有致纤维化作用[2]。
体外研究中,分别将miR-21模拟物和miR-21抑制剂干预肺成纤维细胞,前者能够促进肺成纤维细胞的增殖和胶原蛋白的合成,后者作用相反[3]。
刘理静[4]等对博来霉素诱导的大鼠肺纤维化模型分别尾静脉注射miR-21激动剂(miR-21 agomir)和miR-21拮抗剂(miR-21 antagomir),结果显示miR-21 antagomir组大鼠肺泡炎和肺纤维化程度显著轻于miR-21 agomir组。
ADAMTS-1是miR-21的靶基因,它在肺纤维化大鼠血清中的水平降低,与肺纤维化程度评分呈负相关[5],miR-21通过负性调控ADAMTS-1的表达影响肺纤维化的发生、发展。TGF-β1/Smad信号通路在其中发挥着重要调控作用,miR-21与TGF-β可能在肺纤维化发病过程中发挥协同作用,TGF-β是通过Smad途径促进miR-21表达,使miR-21抑制Smad-7表达,进而增加TGF-β促纤维化作用。屈艳[6]应用大黄酸干预博来霉素诱导的大鼠肺纤维化模型,结果显示大黄酸用药组的肺泡炎和肺纤维化程度显著降低,肺组织中miR-21表达降低,Smad7的mRNA蛋白表达水平升高。表明大黄酸的抗纤维化作用可能与抑制miR-21表达,干预TGFβ1/Smad信号通路,进而减少细胞外基质沉积来实现的。
1.2 miR-155
mi R-155在肺纤维化的肺组织和血清中的表达是增加的,m i R-155的促纤维化作用是通过抑制角质化细胞生长因子(keratinocyte growth factor,KGF)表达而实现的。KGF有着促进上皮细胞再生,抑制上皮间质转化的作用。研究显示[7],转染mi R-155前体后正常人肺成纤维细胞释放的KGF减少,反之,敲除miR-155后KGF释放增加;同时miR-155能够有效抑制KGF mRNA3’-UTR结合抑制KGF表达。
ATIR是miR-155的靶基因之一,在博来霉素诱导的肺纤维化中表达增加,当ATIR表达上调时会促进纤维化的发生和成纤维细胞内胶原的合成。Kurowska-Stolarska等[8]将miR-155基因敲除,会促进胶原蛋白沉积,胶原蛋白1、3mRNA的表达,转化生长因子β产生,替代性活化的巨噬细胞的激活,进而加剧小鼠肺纤维化的发生和进展;当抑制miR-155的靶因子——肝X受体α时,延缓肺纤维化。
2肺纤维化中下调的microRNAs
2.1miR-26α
miR-26α在小鼠肺纤维化模型中的表达是下调的,抑制miR-26α会导致肺上皮细胞转化为肌成纤维细胞(EMT),加重肺纤维化;将miR-26α过度表达可以减少EMT的产生,延缓肺纤维化,由此可见miR-26α具有抗纤维化作用[9]。
miR-26α的靶基因中与肺纤维化相关的有高迁移率族蛋白A2(High mobility group protein A2,HMGA2)、Lin28B、Smad4、细胞周期蛋白D2(Cyclin D2,CCND2)。
有研究[10]表明HMGA2能够与DNA中富含A-T的序列相结合,调控大量靶基因的转录。HMGA2蛋白通过正向调节肺泡上皮间质转化(epithelial-mesenchymal transition,EMT)参与肺纤维化发病。转染过表达miR-26α可以减少HMGA2的表达抑制EMT,进而抑制肺纤维化。Lin28B可抑制let-7d进而诱导EMT,因此通过调控miR-26α来抑制Lin28B就可以发挥减轻EMT、抑制肺纤维化的作用[11]。
Smad4是p-Smad2/Smad3核转位的决定因素,转染miR-26a可以抑制Smad4,抑制p-Smad3核转位,进而影响TGF-β/Samd通路,减少成纤维细胞的增殖,达到抑制肺纤维化的目的[12]。
miR-26a能够直接与CCND2基因mRNA3'-UTR相结合,抑制CCND2蛋白表达,调控细胞G1/S期转换,进而抑制肺纤维化过程中成纤维细胞的增殖[13]。
2.2miR-29
敲除肺成纤维细胞的miR-29基因后会加重肺纤维化程度,转染miR-29过表达的模拟物会减轻肺纤维化程度。Cushing[14]的研究发现ITGA11、ADAM12、ADAMTS9及NID1是miR-29的靶基因,以上基因在肺纤维化的发生发展中均发挥着重要作用,miR-29下调会促使以上相关基因的表达,导致肺纤维化。
肺纤维化发生时miR-29表达下调后会增加TGF-β和结缔组织生长因子(connective tissue growth factor,CTGF)的表达以及Smad3的磷酸化,也会促使肺纤维化。除此之外,miR-29的下调会减弱PI3K-AKT通路和Wnt/β-catenin信号通路的抗纤维化作用。
MMP1、MMP3及TIMP1均为miR-29的靶基因,主要在巨噬细胞等炎症细胞中表达,许梦婷[15]等在博来霉素诱导的大鼠肺纤维化模型中,活性维生素D3可以促进miR-29表达,进而使MMP1、MMP3及TIMP1的表达降低,抑制肺纤维化的发生发展。
2.3 miR-149
二氧化硅诱导的肺纤维化小鼠模型肺组织中miR-149的表达显著下降,而IL-6表达增加,因此miR-149的下调可能参与SiO2刺激后肺纤维化的发生。Clay[16]的研究发现将过表达的miR-149的上皮细胞暴露于臭氧,miR-149可以与IL-6mRNA3'-UTR结合进而抑制IL-6蛋白合成,这种机制也同时发生在骨关节炎时的软骨细胞当中[17]。而在肺纤维化中,miR-149是否通过这种机制调控IL-6的合成还需进一步探索。
2.4 miR-200家族
miR-200a、miR-200b、miR-200c、miR-141及miR-429均属于miR-200家族,其中miR-200b和miR-200c在小鼠肺纤维化模型和特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)患者肺组织中的表达均下调,miR-200家族可能是通过抑制TGF-β1诱导的肺泡上皮细胞发生EMT,进而抑制肺纤维化的发生[18]。
曹永梅[19]等在脂多糖诱发的急性肺损伤后的早期肺纤维化的小鼠模型中发现,随着肺纤维化程度的不断加重,miR-200b、miR-200c的水平呈下降趋势,其靶基因ZEB1mRNA、ZEB2mRNA的水平升高。因此在脂多糖诱发的急性肺损伤后早期肺纤维化过程中miR-200b和miR-200c的表达降低,且负性调控其基因转录抑制因子ZEB1mRNA、ZEB2mRNA的表达进而促进上皮向间质转化。
2.5 miR-101
自噬是肺纤维化发病过程中的一个重要环节,前期本课题组使用Affymetrix miRNA芯片筛查体外染尘的肺泡巨噬细胞中差异表达的microRNA,其中miR-101在自噬过程中的表达是显著降低的。Frankel[20]等称miR-101作为自噬的抑制因子,通过下调靶基因STMN1、RAB5A和ATG4D的表达抑制自噬的激活,减少细胞死亡。
在心梗后心肌纤维化模型中,miR-101的过表达可以减轻间质性纤维化和心脏恶化,提示miR-101作为自噬的负性调控因子,可以成为心肌纤维化及其它器官纤维化疾病潜在治疗靶点[21]。
同时miR-101家族是肝纤维化和TGP-β信号通路的重要调控因子,四氯化碳诱导的肝纤维化小鼠模型中发现miR-101能够通过靶向TGF-β的受体(TGF-βreceptorⅠ,TβRⅠ)和转录激活因素6(transcriptional activator Kruppel-like 6,KLF6)进而抑制TGF-β信号通路[22]。miR-101在肺纤维化中是否发挥着同样的作用还有待进一步考证。
2.6 let-7家族
let-7家族共有16个成员,其中let-7 d在大鼠肺纤维化模型和IPF患者肺组织中表达降低。研究表明IPF患者肺组织肺泡上皮细胞的HMGA2增加,其机制在于HMGA2是let-7 d的靶目标,IPF发生时let-7d下调促进EMT,进而促进肺纤维化的发生。反之转染let-7d的纤维母细胞会使HMGA2的表达降低,抑制EMT,进而抑制肺纤维化[23]。
梁海海[24]等的研究,在博来霉素诱导的小鼠肺纤维化模型中检测Lin28 B的表达显著升高,进而诱导成纤维细胞增殖肌成纤维细胞转变,而过表达的let-7 d能够抑制Lin28B以上作用,进而抑制肺纤维化的发展。
3microRNAs与肺纤维化的诊断人体血浆/血清中也存在着丰富且稳定的mRNAs,与肺纤维化的发生发展有着密切的关系,且随着病理状态、疾病进程,miRNAs的表达谱也会发生相应变化,因此血清/血浆miRNAs是肺纤维化疾病早期诊断标志物的候选物。
IPF患者血清中共有8中miRNAs的表达上调,52种miRNAs表达降低。LiP[25]等对IPF患者血清中miRNAs进行研究,发现IPF患者血清中miR-21和miR-155的水平显著增高,且miR-21的表达水平与肺纤维化程度呈正比,miR-101-3p的下调最为显著。
但血清/血浆中的miRNAs的含量极少,其分泌方式、血液中维持稳定的保护机制以及凝血过程对miRNAs的影响尚需进一步探索,miRNAs在体内作用的靶基因和调控机制尚未明确,单纯的看血清/血浆miRNAs的上调和下调来诊断疾病是片面的,1种miRNAs的改变可能存在于多种疾病,同种疾病也可能有多种miRNAs的改变[26]。
血清/血浆miRNA提取检测有着创伤小、方法准确、便捷等优势,且血清/血浆内miRNA表达稳定,检测技术日益成熟,能够及时、有效地应用无创手段对肺纤维化的发展进程进行监测或干预,为作为肺纤维化疾病诊断、疗效监测和预后评估提供了可能,辅助甚至替代目前临床尚存不足的诊疗手段,并且在临床上得到更广泛地推广应用。
4microRNAs与肺纤维化的治疗
以往肺纤维化的临床治疗主要是通过糖皮质激素、免疫抑制剂、抗纤维化药物、抗生素、细胞因子特异性抑制剂等,虽然能够一定程度上延缓肺纤维化的进程,但是并不能从根本上治愈,且长期服用很容易引发严重的不良反应。肺移植虽然能够从根本上治愈肺纤维化,但存在较多的不利因素,因而限制其应用。
越来越多的研究表明miRNAs的异常表达参与着肺纤维化的发生,通过选择特定miRNAs干预其靶基因,进而调控肺纤维化的发展进程是未来研究的主要方向。理论上讲,miRNAs表达上调的肺纤维化,导入反义核苷酸,起到下调miRNAs的作用,从而调控其到正常水平,治疗肺纤维化;反之,miRNAs表达下调的肺纤维化,将miRNAs转染进体内,发挥治疗作用。随着肺纤维化miRNAs与其靶基因研究的愈加深入,能够为肺纤维化的诊断和治疗提供重要的参考价值。
5结语与展望
本文对肺纤维化发病过程中显著改变的miRNAs作一概述,miRNAs与病变组织的纤维化关系密切,miRNAs的特异性表达能够促进或抑制肺纤维化的发病过程。
miRNAs的功能作用非常复杂,且目前许多miRNAs的具体作用靶点和调控机制尚不明确,还有一些问题尚待解决[27]:
①虽然已有动物和IPF患者研究显示miRNAs在肺纤维化发病过程中发挥重要作用,但仍需大量实验进一步验证;
②单个miRNAs有多个靶目标,如何使miRNAs单纯作用于与肺纤维化相关的靶目标而不会对其他靶目标造成影响;
③如何有效地将miRNAs导入进人体内,且发挥预期的效果。随着研究的深入,我们相信通过调控miRNAs仍然是肺纤维化治疗的有效方法,为肺纤维化的临床诊断和治疗提供新的依据和方向。
参考文献
[1]Ebrahimi A,Sadroddiny E.MicroRNAs in lung diseases:Recent findings and their pathophysiological implications[J].Pulm Pharmacol Ther,2015,34:55-63.
[2]Liu G,Friggeri A,Yang Y,et al.miR-21 mediates fibrogenic activation of pulmonary fibroblasts and lung fibrosis[J].J Exp Med,2010,207(8):1589-1597.
[3]刘理静,钱红.上调miR-21表达促进肺成纤维细胞增殖和胶原蛋白合成[J].细胞与分子免疫学杂志,2015,31(7):918-922.
[4]刘理静,尹辉明,黄民江,等.miR-21通过下调ADAMTS-1表达促进大鼠肺纤维化[J].细胞与分子免疫学杂志,2016,32(12):1636-1645.
[5]Castan-Laurell I,Dray C,Attane C,et al.Apelin,diabetes,and obesity[J].Endocrine,2011,40(1):1-9.
[6]屈艳,张崇,贾岩龙,等.大黄酸通过抑制miR-21而干预TGF-β1/Smad通路并减轻博来霉素所致大鼠肺纤维化[J].中国病理生理杂志,2017,33(1):149-153.
[7]Pottier N,Maurin T,Chevalier B,et al.Identification of keratinocyte growth factor as a target of microRNA-155 in lung fibroblasts:implication in epithelial-mesenchymal interactions[J].PLoS One,2009,4(8):e6718.
[8]Kurowska-Stolarska M,Hasoo MK,Welsh DJ,et al.The role of microRNA-155/liver X receptor pathway in experimental and idiopathic pulmonary fibrosis[1].J Allergy Clin Immunol,2016(16):31130-31132.
[9]Liang H,Gu Y,Li T,et al.Integrated analyses identify the involvement of microRNA-26a in epithelial-mesenchymal transition during idiopathic pulmonary fibrosis[J].Cell Death Dis,2014,5:e1238.
[10]Bustin M,Reeves R.High-mobility-group chromosomal proteins:architectural components that facilitate chromatin function[J].Prog Nucleic Acid Res Mol Biol,1996,54:35-100.
[11]Liang H,Liu S,Chen Y,et al.miR-26a suppresses EMT by disrupting the
(Lin28B/let-7d axis:potential cross-talks among MicroR-NAs in IPF[J].J Mol Med(Berl),2016,94(6):655-665.
[12]Li X,Liu L,Shen Y,et al.MicroRNA-26a modulates transforming growth factor beta-1-induced proliferation in human fetal lung fibroblasts[J].Biochem Biophys Res Commun,2014,454(4):512-517.
[13]Ando K,Ajchenbaum-Cymbalista F,Griffin JD.Regulation of G1/S transition by cyclins D2 and D3 in hematopoietic cells[J].Proc Natl Acad Sci U S A,1993,90(20):9571-9575.
[14]Cushing L,Kuang PP,Qian J,et al.miR-29 is a major regulator of genes associated with pulmonary fibrosis[J].Am J Respir Cell MolBiol,2011,45(2):287-294.
[15]许梦婷,刘乃国,刘营,等.基质金属蛋白酶1、3,基质金属蛋白酶组织抑制剂1和miR-29在大鼠肺纤维化中及活性维生素D3处理后表达与作用[J].解剖学杂志,2017,40(3):266-285.
[16]Clay CC,Maniar-Hew K,Gerriets JE,et al.Early life ozone exposure results in dysregulated innate immune function and altered microRNA expression in airway epithelium[J].PLoS One,2014,9(3):e90401.
[17]Santini P,Politi L,Vedova PD,et al.The inflammatory circuitry of miR-149 as a pathological mechanism in osteoarthritis[J].Rheumatol Int,2014,34(5):711-716.
[18]Yang S,Banerjee S,de Freitas A,et al.Participation of miR-200 in pulmonary fibrosis[J].Am J Pathol,2012,180(2):484-493.
[19]曹永梅,吕毅,刘玉静,等.miR-200及其靶基因ZEB1/2在急性肺损伤后早期肺纤维化中上皮-间质转化(EMT)过程[J].昆明医科大学学报,2016,37(12):1-7.
[20]Frankel L B,Wen J,Lees M,et al.microRNA 101 is a potent inhibitor of autophagy[J].Embo Journal,2011,30(22):4628–4641.
[21]Pan Z,Sun X,Shan H,et al.MicroRNA-101 Inhibited Postinfarct Cardiac Fibrosis and Improved Left Ventricular Compliance via the FBJ Osteosarcoma Oncogene/Transforming Growth Factor-β1 Pathway[J].Circulation,2012,126(7):840-850.
[22]Tu X,Zhang H,Zhang J,et a l.Micro RNA-101 suppresses l iver fibrosis by targeting the TGFβsignalling pathway[J].Journal of Pathology,2014,234(1):46-59.
[23]Huleihel L,Ben-Yehudah A,Milosevic J,et al.Let-7d microRNA affects mesenchymal phenotypic properties of lung fibroblasts[J].Am J Physiol Lung Cell Mol Physiol,2014,306(6):L534-L542.
[24]梁海海,李天宇,解岩,等.Lin28B/let-7d环路调控成纤维细胞功能参与肺纤维化发生[J].中国药理学通报,2017,33(2):175-180.
[25]Li P,Li J,Chen T,et al.Expression analysis of serum microRNAs in idiopathic pulmonary fibrosis[J].Int J Mol Med,2014,33(6):1554-1562.
[26]刘义涛.血清特异性microRNA作为尘肺早期诊断生物标志物的研究[D].天津医科大学,2013.
[27]刘秋萍,徐凌.MicroRNAs在肺纤维化中的研究进展[J].临床肺科杂志,2017,22(8):1503-1507.
关注SCI论文创作发表,寻求SCI论文修改润色、SCI论文代发表等服务支撑,请锁定SCI论文网!
文章出自SCI论文网转载请注明出处:https://www.lunwensci.com/yixuelunwen/11460.html